Бензол және оның туындылары: құрылымы, физика-химиялық қасиеттері, реакциялары және қолданылуы


ЖОСПАР
1. Бензол құрылысы;
2. Бензолдың қасиеттері;
3. Толуол;
4. Толуолдың қасиеттері;
5. Ароматты сульфоқышқылдар;
6. Нитротопша;
7. Ароматты аминдер;
8. Пайдаланған әдебиеттер.
Бензол құрылысы
Ароматты көмірсутектердің басты өкілі-бензол. Оны 1825 ж. М. Фарадей жарық газын зерттей отырып, соның құрамынан тапқан, ал Э. Митчерлих 1834 ж. бензой қышқылын құрғақ айдау арқылы алған.
Кекуле 1865 ж. бензолдың циклді формуласын ұсынды. Кекуле бойынша бензол молекуласы қосыаланған үш байланысы бар циклогексатриенді тұйық жүйе:
Бұл формуланы қазіргі күнге дейін қолданып жүр.
Бензол және оның туындыларының өздеріне тән ерекше қасиеттері бар.
1. Ароматты көмірсутектердің молекуласында алты π-электрондардың біртұтас тұйық электрондық система құруы-ароматикалық қасиеттің басты белгісі. Бұл бензол және оның гомологтарының физикалық және химиялық қасиеттерін анықтайды.
2. Ароматты көмірсутектер тотықтырғыштардың әрекетіне тұрақты.
3. Ароматты көмірсутектер қосылу реакциясына қиын түседі, ал электрофильді орынбасу реакциясына оңай түседі.
2. Алу жолдары және табиғи көздері
Ароматты көмірсутектерді негізінен тас көмірді құрғақ айдау арқылы алады. Ол үшін тас көмірді 900-1С ауа қатыстырмай қыздырады. Нәтижесінде құрғақ қалдық кокс, газдар мен тас көмір смоласы алынады. 1м3 газдың құрамында 30 г. бензол және 10 г. толуол болады. Смола құрамында бензол, толуол, ксилол, фенолдар, көп ядролы ароматты көмірсутектер және гетероциклді қосылыстар болады.
Бензол молекуласын алудың көптеген синтетикалық жолдары бар:
1. Алкандар оксидті катализатордың қатысуында циклдену және дегидрогендеу реакцияларына түсіп, арендер түзеді:
А) H3C-(CH2 ) 5 -CH3
 C6H5-CH3+4H2 (Cr2 O3 кат. қатысында)
C6H5-CH3+4H2 (Cr2 O3 кат. қатысында)
B) H3C-(CH2) 6-CH3
 (о-) C6H4CH3CH3 (Cr2 O3 кат. қатысында)
(о-) C6H4CH3CH3 (Cr2 O3 кат. қатысында)
2. Ацетилен және оның гомологтары металлорганикалық катализатордың қатысуында циклотримерлену реакциясына түсіп, бензол және оның гомологтарын түзеді:
3CH3-C≡CH
 (1, 3, 5) C6 H3 (CH3) 3
(1, 3, 5) C6 H3 (CH3) 3
3. Циклоалкандар жоғары темтературада және катализатордың қатысуында дегидрогенделіп, арендерге айналады.
4. Бензой қышқылының тұздары сілтімен қосып айдау арқылы бензол алады:
C6H5COONa+NaOH
 C6H6 +Na2CO3
C6H6 +Na2CO3
5. Бензол гомологтарын галоген туындылардан Вюрц-Фиттиг (1864) реакциясы бойынша жеңіл алады:
C6H5Br+2Na+BrC2H5→C6H5-C2H5+2NaBr
6. Бензол гомологтарын алудың маңызды әдісі Фридель-Крафтс-Густавсон реакциясы (1877) :
C6H5-CO-CH3+2H2→C6H5-C2H5+H2O
Тотықсыздану реакциясы қышқылдық ортада мырыш амальгамасының қатысуында жүреді.
Бензолдың физикалық қасиеті
Бензолдың гомлогтық қатарының төменгі өкілдері, негізінен сұйықтық болады. Оның молекулалық массасы өскен сайын қайнау температурасы да, артады, орта-изомерлер, әдетте, пара-изомерлерге қарағанда жоғары температурада қайнайды.
Бензолдың қайнау температурасы (80, 10С) гексанның қайнау температурасынан (68, 80С) жоғары.
Симметриялы құрылысты изомерлердің балқу температурасы жоғарырақ болып келеді. Екі орынбасарлары изомерлердің ішінде-пара-изомер ең жоғары температурада балқиды.
Май қатары мен алициклді қатар көмірсутектерден тығыздығы және жарық сындыру көрсеткіштері анағұрлым жоғары.
Бензол қатарындағы ароматты көмірсутектер судан жеңіл, суда ерімейді, ал көптеген органикалық еріткіштерде жақсы ериді. Олардың буымен ұзақ уақыт тыныс алғанда адам уланады.
Ароматикалық көмірсутектердің физикалық қасиеттері

Химиялық қасиеттері
Қосылу реакциялары. Ароматты көмірсутектер кәдімгі жағдайда қосылу реакциясына түспейді, яғни олар борм суын, калий перманганатының ерітіндісін түссіздендірмейді. Бірақ ерекше жағдайларда қосылу реакциясына түсіруге болады.

1. Катализатордың қатысуында және жоғары температурада ароматты көмірсутектер сутекті қосып алып, циклогексан және оның гомологтарын түзеді.

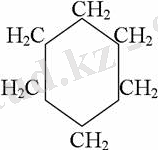
2. Ультракүлгін сәуленің әсерінен арендер хлор мен бромды қосып алып, гексагалогенидтер түзеді.
3. Бензол мен оның гомологтары қанықпаған көмірсутектер секілді озонды қосып алып, өте қопарылғыш зат-үш озонидтер түзеді. Бұл озонидтер сумен гидролизденіп, дикарбонильді қосылыстар (глиоксаль) түзеді.

Орынбасу реакциялары . Бензол мен оның гомологтары галогендермен (катализатордың қатысуымен), азот және күкірт қышқылдарымен басқаша әрекеттеседі. Барлық жағдайда да атомдар мен қалдықтар бензол ядросы сутектерінің орнын басады.
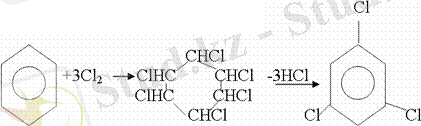
1. Катализатордың, мысалы, темірдің қатысуымен хлор немесе бром бензолмен әрекеттестіргенде галоген сутек атомдарының орнын басады, әрі бағытталу ережесі сақталады: хлор бензолдан көбінесе дихлор бензолдардың пара-изомері алынады:

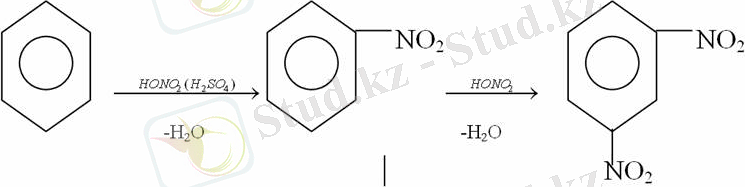
2. Бензолға нитрлегіш қоспамен (азот және күкірт қышқылдарының қоспасы) әсер еткенде сутек атомдарының орнын нитротоп басады. Нитрлеу әрі қарай жүргенде де орнын басу ережесі сақталады: нитробензолдан динитробензолдың мета-изомері алынады.
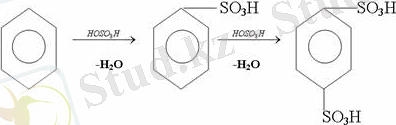
3. Бензолды концентрлі күкірт қышқылымен әрекеттестіргенде
с у л ь ф о л а н д ы р у реакциясы жүреді. : сульфо топ сутек атомдарының орнын басады. Бұл арада моносульфоқышқылмен м-дисульфоқышқыл пайда болады:
4. Тотығу реакциялары. Бензол сақинасы кәдімгі тотықтырғыштарға өте тұрақты. Кәдімгі жағдайда хром оксиді, азот қышқылы, калий перманганаты секілді күшті тотықтырғыштар бензолға әсер етпейді.
Бензол гомологтары бензол сақинасынан және бүйір тізбектен тұрады. Соған сәйкес, бензол гомологтарындағы бензол сақинасының қасиеттері бензолдың өз қасиетіне жақын болады да, ал бүйір тізбектің қасиеттері алифатты көмірсутектердің қасиеттеріне жақын болады.
Бензол гомологтарының тотығуы. Бензол сақинасы тотықтырғыштармен өте қиын әрекеттеседі.
V2O5 катализатор есебінде қолданып бензолды ауадағы оттекпен тотықтырғанда малеин қышқылы түзіледі.
Бензол гомологтары әдетте тотықтырғыштардың әсерімен ароматик қышқылдарға айналады. Ұзын-қысқалығына қарамай бүйір тізбек карбоксил тобын береді. Бірнеше орынбасарлары болса, тотықтырғыштарды іріктеп қолдану арқылы алдымен ұзындау, содан кейін қысқалау тізбектерді немесе керісінше тотықтыруға болады. Бұл реакция ароматик көмірсутектерді айырып білу үшін пайдаға асады.
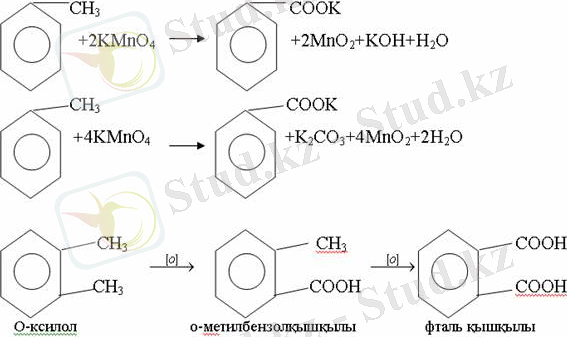
5. Бензолдың қолданылуы.
Бензол-кең түрде қолданылатын арен. Бензолды еріткіш ретінде көп қолданады. Ол майларды, каучукті, полимерлерді, лактарды, мұнай өнімдерін жақсы ерітеді. Бензол суда нашар ериді, сумен азеотропты қоспа түзеді. Химиялық өнеркәсіпте нитробензол, хлорбензол, анилин, фенол, стирол және т. б. өнімді алу үшін шикізат ретінде қолданады.
6. Ароматты галоген туындылары.
Молекуласында тікелей ароматты сақинамен байланысқан, немесе бүйір тізбекте орналасқан бір немесе бірнеше галоген атомдары бар қосылыстарды ароматты көмірсутектердің галоген туындылары немесе галогенарендер деп аталады.
Алыну жолдары:
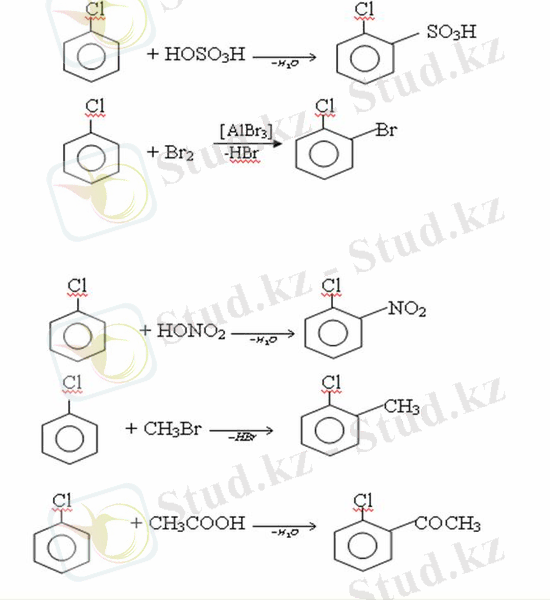
1. Хлорлау. Реакцияның жүру жағдайына қарай хлорлау реакциясы тікелей сақинада немесе бүйір тізбекте жүруі мүмкін.

Реакция электрофильді орынбасу механизмімен төмендегі схема бойынша жүреді:

Реакцияны ары қарай жүргізу арқылы дихлорбензол, үшхлорбензол және гексахлорбензолға дейін алуға болады.
Толуолдың хлорлануы мына схемамен жүреді:
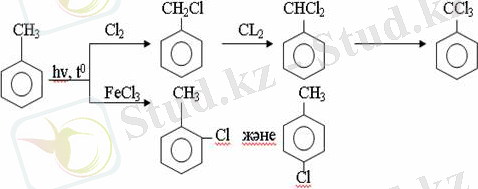
Арендерді тікелей фторлау арқылы фтортуындыларды алу мүмкін емес. Сондықтан, фтортуындыларды жанама жолмен алады. Мысалы, жоғары температурада және қысым астында хлортуындыларға калий фторидімен әрекет етіп, фтортуындылрды алуға болды:
C6Cl6 + KF
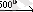 C6F6
C6F6
Гексафторобензол
Ароматты диазоқосылыстардан гологен туындылардың барлығын, оның ішінде фтортуындыларды да алуға болады.
Химиялық қасиеті.
Галогенарендердің нуклеофильдік орынбасу реакцияларына түскіштігі галогеналкандарға қарағанда едәуір төмен.

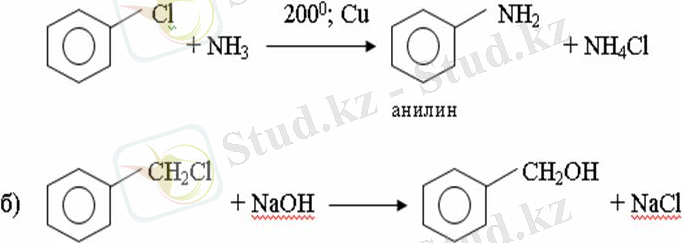
Галогенарендер металдармен галогеналкандар секілді жеңіл әрекеттесіп, металлорганикалық қосылыстар түзеді:
в) С6H5Br + Mg эфир C6H5MgBr
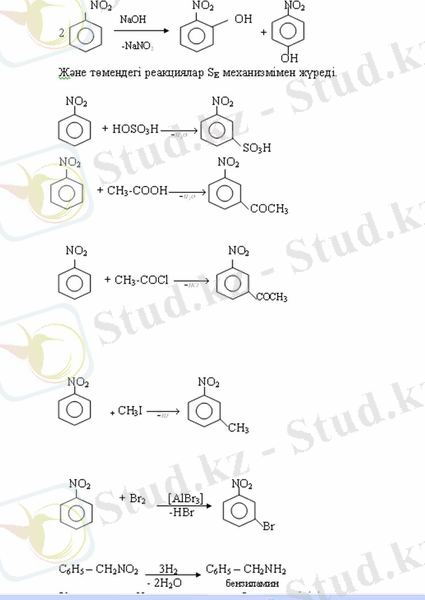
Cондай-ақ сульфурлеу, галогендеу, нитрлеу, алкилдеу, ацилдеу реакциялары SE механизмімен жүреді.
Физикалық қасиеттері. Ароматты галоген туындылар-суда ерімейтін сұйықтықтар немесе кристалдық заттар. Галоген сақинамен тікелей байланысқан галоген туындылардың жағымды ароматты иісі болады. Галоген туындылардың қайнау температурасы фтордан иодтуындыларғы қарай артады. Галогенарендерде электрофильді орынбасу реакциясы бензолға қарағанда қиын жүреді. Галоген атомы жаңадан келетін орынбасушыны орто- және пара- жағдайға бағыттайды.
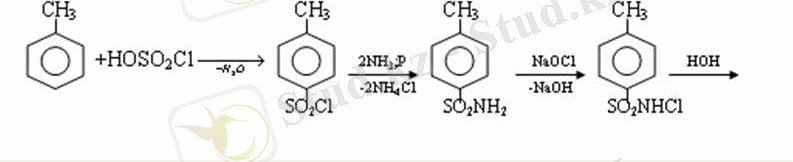
Ароматты сульфоқышқылдар.
Молекуласында сульфатопшасы бар ароматты көмірсутектердің туындыларын ароматты сульфоқышқылдар дейді.
Алыну жолдары:
Ароматты сульфоқышқылдарды бензолды және оның гомологтарын сульфурлеу арқылы алады. Сульфурлеу реакциясы әдеттегі электрофильді орынбасу механизмімен жүреді. Төмендегі схемамен түзілетін гидросульфон ионы реагент болады.

Химиялық қасиеті.
Сульфотопшаның реакциялары:
а) тұздардың түзілуі
C6H5 SO3H + NaOH C6H5 SO3Na + H2O
б) хлоронгидридтердің түзілуі
C6H5 SO3H + PCl5 C6H5 SO2Cl + H2O
C6H5 SO2Cl + NaOC2H5 C6H5 SO2 OC2H5 + NaCl


 Бензосульфақышқылының этил эфирі
Бензосульфақышқылының этил эфирі
C6H5 SO2Сl + 2 NH3 C6H5 SO2NH2 + NH4Cl
 Бензосульфоамид
Бензосульфоамид







C6H5 SO2NH2 + 2 HOCl C6H5 SO2NCl2 + 2H2O
C6H5 SO3H + H2O C6H6 + H2SO4
C6H5 SO3Na + 2 NaOH C6H5 ONa + Na2SO3 + H2O
2C6H5 SO3Na + H2SO4 2C6H5OH + Na2SO4
фенол
Сульфоқышқылдардағы бензол сақинасы электрофильді орынбасу яғни галогендеу, нитрлеу және сульфурлеу реакцияларына түседі. Электроноакцепторлы сульфотопша бензол сақинасындағы пи электрондарды өзіне қарай тартып, сақинаның электрондық тығыздығын кемітеді. Электрондық тығыздық орто- және пара- жағдайларда көбірек кемиді,
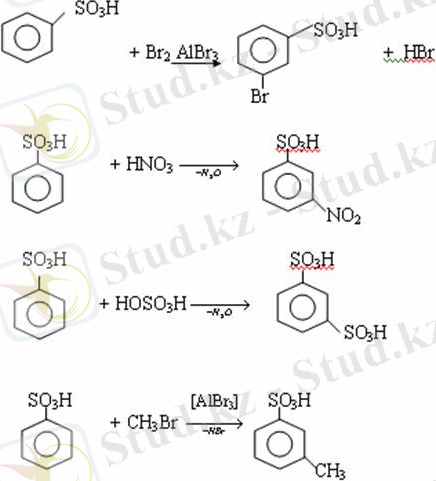 келесі орынбасушы м-жағдайға орналасады.
келесі орынбасушы м-жағдайға орналасады.
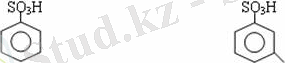

Қолданылуы.
Ароматты сульфоқышқылдар фенолдар, бояулар және дәрі-дәрмек өндірісінде кеңінен қолданылады.

8. Ароматты нитроқосылыстар.
Молекуласында тікелей бензол сақинасымен байланысқан немесе бүйір тізбекте орналасқан бір немесе бірнеше нитротопшалары бар қосылыстарды ароматты нитроқосылыстар деп атайды.
Алыну жолдары:
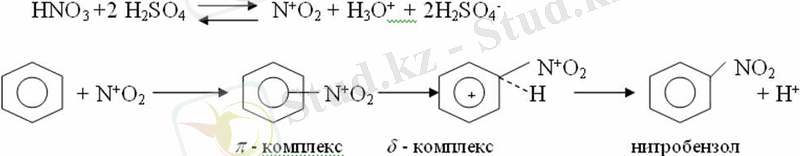
Бұл реакцияда күкірт қышқылы нитроний катионының түзілуіне мүмкіндік беретін катализатордың ролін атқарады. Нитротопша екінші ретті орынбасушыға жататындықтан, нитрлеу реакциясын ары қарай жүргізу қиындай түседі. Дегенмен, реакцияның жүруіне жағдай туғызып, екінші және үшінші нитротопшаларды сақинаға енгізуге болады. Олар бір-біріне метажағдайда орналасады.

Химиялық қасиеті:
Бірінші ретті орынбасушылар нитрлеу реакциясының жүруін жеңілдетеді.
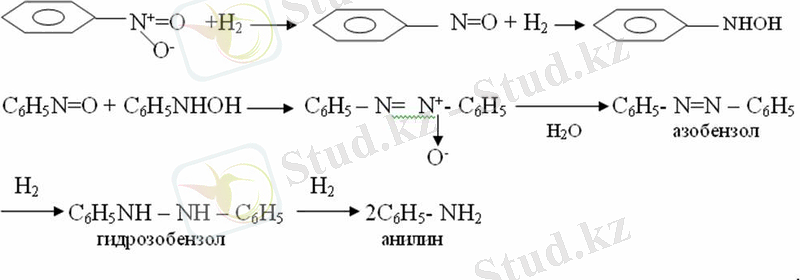
Нитротопша нуклеофильді орынбасу реакциясының жүруін жеңілдетеді.
. АРОМАТТЫ АМИНДЕР
1. Классификациясы, номенклатурасы және изомериясы
Молекуласында бензол сақинасымен байланысқан амин топшасы /-NH2/ бар қосылыстарды ароматты аминдер деп атайды.
Ароматты аминдері алифатты аминдер секілді амиактың туындылары ретінде қарауға болады. Соған сәйкес, ароматты аминдер де біріншілік / I /, екіншілік / II / және үшіншілік / III / болып бөлінеді:
Ar - NH2 (Ar) 2 NH (Ar) 3N
I II III
Молекуласында екі амин топшасы бар қосылыстарды диаминдер дейді. Әдетте, ароматты аминдерді тарихи номенклатура бойынша атайды. Халықаралық номенклатура бойынша радикалдың атына амин деген сөзді қосып атайды:
Қосылыстар: Т. Н. Х. Н.
C6H5 - NH2 анилин фениламин
C6H5 - NH - CH3 N - метиланилин метилфениламин
CH3 - C6H4 - NH2 толуидин толуиламин
N - метиланилинге төрт изомер сәйкес келеді:

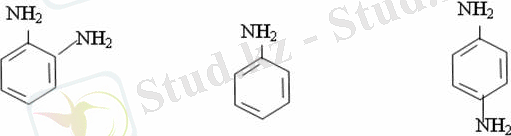
N - метил-анилин о-толуидин м-толуидин п-толуидин
 Екі амин топшасы бар қосылыстар фенилендиаминдер үш изомер түрінде
Екі амин топшасы бар қосылыстар фенилендиаминдер үш изомер түрінде
Физикалық және химиялық қасиеттері
Ароматты аминдер - өзіне тән жағымсыз иісі бар сұйықтықтар немесе қатты заттар. Уландырғыш. Суда аз ериді. Молекулада аминтопшалары көбейсе, ергіштігі артады.
Ароматты аминдердің химиялық қасиеттерін бензол сақинасымен байланысқан амин топшасы анықтайды.
I. Ароматты аминдердің негізділік сипаты алифатты аминдерге қарағанда төмен болады. Себебі, азот атомындағы бос электрон жұбы бензол сақинасының П-электрондарымен қосарланады /Р, П - қосарлану /:
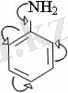
Бұлай қосарлану бос электрон жұбының протонды қосып алу / анилин қышқылмен әрекеттескенде / қабілетін төмендетеді. Демек, аминнің негізділігі төмендейді.
Егер сақинаға электронакцепторлы топшалар орналасса, олар аминдердің негізділігін одан ары төмендетеді. Мысалы, анилиннің негізділік константасы 3, 8 . 10-10 тең болады, ал 0-, М- және П-нитроанилиндердің сәйкес негізділік константалары 1 . 10-14, 4 . 10-12 және 1 . 10-12 тең болады.
Егер молекуладағы амин топшасына алкил-радикалдар енгізсе, онда ароматты аминдердің негізділігі артады. Мысалы, N- метиланилинмен N, N- диметиланилиннің сәйкес негізділік константалары 7 . 10-10 және 1, 1 . 10-9 тең болады.
Ароматты амин молекуласында бензол сақинасы көбейген сайын, олардың негізділігі өте күшті төмендейді. Мысалы, дифениламиннің негізділігі константасы 7, 6 . 10-14 тең болады, ал үшфениламин негізділік қасиетін іс жүзінде көрсетпейді. Негізділік күшінің төмендеуіне қарай аминдерді мына қатарға орналастыруға болады:
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz