Белоктар, ферменттер, витаминдер және көмірсулар: 18 зертханалық жұмысқа арналған биохимиялық әдістемелік нұсқаулық


МАЗМҰНЫ
Кіріспе . . . 4
1. Белоктар. Зертханалық жұмыс № 1. Белоктарға және амин қышқылдарына сапалық реакциялар . . . 5
2. Зертханалық жұмыс № 2. Белоктарды тұндыру реакциялары . . . 11
3. Зертханалық жұмыс № 3. Казеинді бөліп алу және оның изоэлектрлік нүктесін анықтау . . . 13
4. Зертханалық жұмыс № 4. Белоктар диализі . . . 16
5. Зертханалық жұмыс № 5. Қағаздағы хроматография әдісімен
амин қышқылдарын бөлу . . . 18
6. Зертханалық жұмыс № 6. Серенсен бойынша формольдік
титрлеу арқылы аминдік азот мөлшерін анықтау . . . 20
7. Ферменттер. Зертханалық жұмыс №7. Биологиялық материалдағы
ферменттерді ашу . . . 22
8. Зертханалық жұмыс № 8. Ферменттердің қасиеттері . . . 25
9. Ферменттер активтілігін сандық анықтау.
Зертханалық жұмыс № 9. Каталаза активтілігін анықтау . . . 30
10. Зертханалық жұмыс № 10. Субстрат ретінде пирокатехинді
пайдалану арқылы пероксидаза активтілігін анықтау . . . 33
11. Зертханалық жұмыс № 11. Сүт майының гидролизі реакция-
сындағы липаза активтілігін анықтау . . . 34
12. Витаминдер. Зертханалық жұмыс № 12. Витаминдерге сапалық реакциялар . . . 36
13. Зертханалық жұмыс № 13. С витаминінің мөлшерін иодометрлік титрлеу арқылы сандық анықтау . . . 41
14. Белоктардың қорытылуы. Зертханалық жұмыс № 14. Белоктардың пепсин және ұйқы безі ферменттері әсерінен қорытылуы . . . 42
15. Нуклеин қышқылдары. Зертханалық жұмыс № 15. Ашытқыдан бөліп алу және гидролиз өнімдерін
сапалық анықтау . . . 44
16. Көмірсулар. Зертханалық жұмыс № 16. Көмірсуларға сапалық реакциялар . . . 46
17. Зертханалық жұмыс № 17. Көмірсулардың ас қорыту жолында қорытылуы . . . 49
18. Зертханалық жұмыс № 18. Ашу процесі кезінде бейорганикалық фосфаттың пайдаланылуы . . . 50
Пайдаланылған әдебиет тізімі . . . 52
КІРІСПЕ
Биологиялық химия курсы тіршіліктің материалдық негізі мағынасын, тірі организмдерде өтетін химиялық және биологиялық процестерді түсіндіре отырып, биология-химия мамандықтары студенттерін дайындау жүйесінде маңызды рөл атқарады.
Биохимия курсының мақсаты - тірі организмдерді құрайтын қосылыстардың негізгі кластарының химиялық құрамы, құрылысы және тіршілік процестеріне қатысуы жөнінде білім қалыптастыру.
Оқу құралына енгізілетін зертханалық жұмыстар студенттерге биохимиядан теориялық білімді бекітуге, биохимиялық экспериментті, соның ішінде модельді тәжірибелер түріндегі экспериментті жүргізудің практикалық дағдыларын алуға көмектесуі тиіс.
Берілген оқу құралына химик және биолог-студенттерге арналған биохимияның «Белоктар», «Ферменттер», «Витаминдер», «Көмірсулар» тараулары бойынша 18 зертханалық жұмыстың әдістемелік нұсқаулары енгізілген. Әрбір жұмыстың сипаттамасы теориялық бөлімнен және жұмыстың мақсаты, тәжірибелерді жүргізу барысы, олардың химизмі көрсетілген практикалық бөлімнен тұрады. Жұмысқа дайындалу және оның нәтижелерін қорытындылауға көмек ретінде бақылау сұрақтары келтірілген.
Зертханалық жұмыстар оқытудың кәсіби бағдары ескеріліп таңдалып алынған. Олар студенттерді тек биохимиялық эксперимент жүргізу дағдысын алып қана қоймай, сонымен қатар болашақ биология және химия мұғалімі қызметінде пайдалануға қажет болатын биохимиялық тәжірибелерді таңдап алып, мектеп бағдарламасына бейімдеуге бағыт береді. Оқу құралының ерекшелігі - биохимияны оқытуды биосфераның антропогенді ластану проблемаларымен байланыстыратын биохимиялық-экологиялық эксперименттердің енгізілуі.
Оқу құралы биохимия элементтерін тек биология және химия сабақтарында пайдаланып қана қоймай, оқушылардың ғылыми жұмысын ұйымдастыруға пайдалана білу дайындығын алуда болашақ мұғалімдерге көмегін тигізеді.
БЕЛОКТАР
Зертханалық жұмыс №1
Белоктарға және амин қышқылдарына сапалық реакциялар
Теориялық бөлім
Белоктар - бір-бірімен пептидтік байланыстар арқылы байланысқан амин қышқылдары қалдықтарынан тұратын азотты жоғары молекулалы қосылыстар (биополимерлер) . Белоктарды басқаша протеиндер деп атайды. Белоктардың мономерлері - протеиногенді амин қышқылдары. Амин қышқылдарының жалпы формуласы келесідей:
Н 2 N - CН - СООН
ﺍ
R
Протеиногенді амин қышқылдарының саны - 20. Амин қышқылдары бір-бірінен бүйір радикалының R структурасы және соған байланысты физика-химиялық қасиеттері бойынша ерекшеленеді, мысалы:
Н 2 N - CН 2 - СООН глицин (гли) Н 2 N - CН - СООН серин (сер)
ﺍ
СН 2 ОН
Н 2 N - CН - СООН аланин (ала) Н 2 N - CН - СООН цистеин (цис)
ﺍ ﺍ
СН 3 СН 2 SH
Радикалдардың химиялық табиғаты алуан түрлі. Радикалдарда әртүрлі функционалдық топтар болғандықтан амин қышқылдары да, белоктар да басқа заттармен химиялық реакцияларға белсенді түрде түседі. Нақты белок молекуласындағы амин қышқылдары қалдықтарының орналасу тәртібі оның 1-ші ретті құрылымын анықтайды. Белоктың 1-ші ретті құрылымы оның құрылымының келесі деңгейлерін және соған байланысты болатын биологиялық функциясын анықтайды.
Биологиялық маңызы бойынша амин қышқылдары алмастыруға болатын, жартылай алмастырылатын және алмастыруға болмайтын деп бөлінеді. Алмастыруға болмайтын амин қышқылдары адам организмінде синтезделмейді, сондықтан олар тағаммен бірге өтуі тиіс. Жартылай алмастырылатын амин қышқылдары организмде жеткіліксіз мөлшерде түзіледі, сондықтан олардың жетіспейтін мөлшері белокты тағаммен толықтырылуы тиіс.
Практикалық бөлім
Жұмыс мақсаты:
- белоктардың сапалық реакцияларымен танысу;
- олардың ішінен мектепте «Белоктар» тақырыбын оқу кезінде пайдалануға болатындарын бөліп көрсету.
Белоктарды ашу және олардың аминқышқылдық құрамын анықтау үшін сапалық (түсті) реакциялар қолданылады. Барлық белоктар үшін тән (биурет, нингидрин реакциялары) және белоктың құрамындағы жеке амин қышқылдары үшін тән (ксантопротеин реакциясы, Миллон реакциясы, Фоль реакциясы және т. б. ) түсті реакциялар болады. Реакцияларда түсті өнімдердің түзілуі белок құрамына кіретін амин қышқылдарының белгілі бір топтарына және пептидтік байланыстардың болуына байланысты болады.
Жұмыс нәтижелерін кесте түрінде көрсету және түсініктеме қорытындылар жасау.
1. Биурет реакциясы 2-ден кем емес пептидтік байланыстары бар қосылыстар үшін тән. Мұндай қосылыстар ішіндегі қарапайымы - биурет Н 2 N - СО - NН - СО - NН 2 реакцияға атау берді. Бос амин қышқылдары әдетте биурет реакциясына түспейді.
Тәжірибе барысы. Белок ерітіндісінің 5 тамшысына 5 тамшы 10 %-дық NаОН және 1 тамшы 1 %-дық СuSО 4 ерітіндісін қосады. Араластырады. Ерітінді түсінің өзгеруін бақылау. Реакцияны әртүрлі белок ерітінділерімен жасау, олардың реакция нәтижесіндегі түсін салыстыру. Белок ерітіндісі пептидтік байланыстардың санына қарай көк-күлгіннен қызыл-күлгінге дейінгі түстерді береді.
Реакция химизмі. Күлгін түстің пайда болуы мыс иондарының белоктың пептидтік топтарымен комплексті қосылыс түзуіне байланысты. Координациялық байланыстар түзу үшін пептидтік байланыстар енолдық формаға өтуі тиіс деп есептеледі:
О H ОН
ﺍﺍ ﺍ ﺍ
- С - N- ↔︎ - С = N - енолды форма
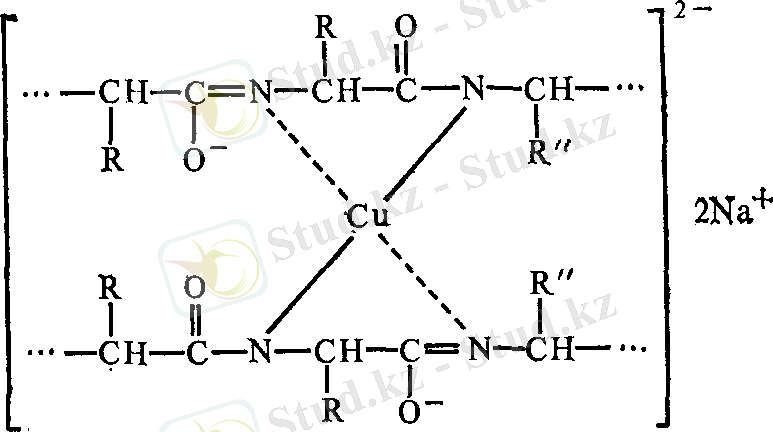 Түсті комплекс құрылысы шамамен келесідей:
Түсті комплекс құрылысы шамамен келесідей:
2. Нингидрин реакциясы бос амин топтарының болуына байланысты, сондықтан белоктармен де, амин қышқылдарымен де орындалады.
Тәжірибе барысы . Белок ерітіндісінің 1 мл-не 1-2 тамшы 1 %-дық нингидриннің ацетондағы ерітіндісін қосады. Ішіндегісін араластырғаннан кейін пробирканы 70 0 С температуралы су моншасына бірнеше минут қояды. Көк-күлгін түс пайда болады.
Реакция химизмі. Нингидрин қатысында қыздырғанда амин қышқылдары мен пептидтердің α-амин тобы тотыға дезаминделеді, ал нингидрин молекуласы тотықсызданады. Тотықсызданған нингидрин аммиакпен және тотыққан нингидриннің басқа молекуласымен әрекеттесіп, боялған қосылыс түзеді (көк-күлгін түсті Руэман комплексі) . Реакцияның қорытынды теңдеуі:
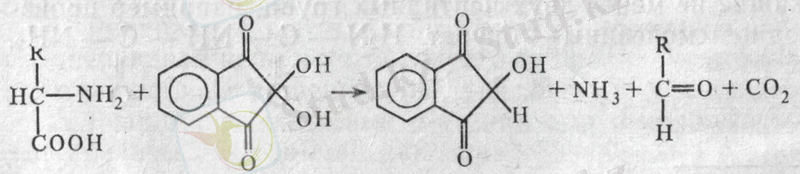
амин қышқылы тотыққан тотықсызданған альдегид
нингидрин нингидрин
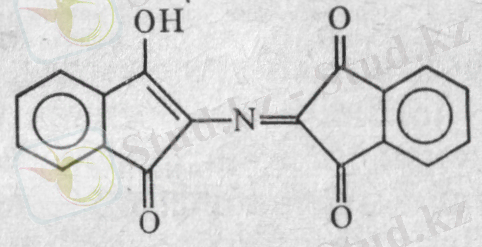
көк-күлгін түсті бояу
3. Ксантопротеин реакциясы. Бұл реакцияға аромат амин қышқылдары және құрамына сондай амин қышқылы қалдықтары (тирозин, фенилаланин, триптофан) кіретін белоктар түседі. Реакцияның аты гректің «ксантос» - сары деген сөзінен шыққан, себебі азот қышқылы әсерімен реакцияны жүргізгенде сары түсті нитроқосылыстар түзіледі: Концентрлі азот қышқылы тигенде тері мен тырнақтың сары түске боялуы олардағы белоктардың аромат амин қышқылдары азот қышқылымен әрекеттесуінен болады.
Тәжірибе барысы. Сақтықпен жұмыс істеу! Белок ерітіндісінің 1 мл-не 1-2 тамшы конц. НNО 3 қосып, әлсіз қыздырады. Алдымен түзілетін ақ тұнба сары түске боялады. Салқындағаннан кейін пробирка ішіндегісіне тамшылатып, қызыл-сары түс пайда болғанша 30 %-дық NаОН ерітіндісі қосылады.
Реакция химизмі. Алдымен азот қышқылы әсерінен белок денатурациясы жүреді. Қыздырғанда сары түсті нитроқосылыстардың түзілуімен тирозин мен триптофанның (фенилаланин қиын нитрленеді) аромат радикалдары бойынша нитрленуі жүреді. Сілтілік ортада хромофор топтары бар қосылыстар түзілгендіктен қызыл-сары түс пайда болады. Тирозин мысалында жүретін реакциялардың схемасын жазуға болады:
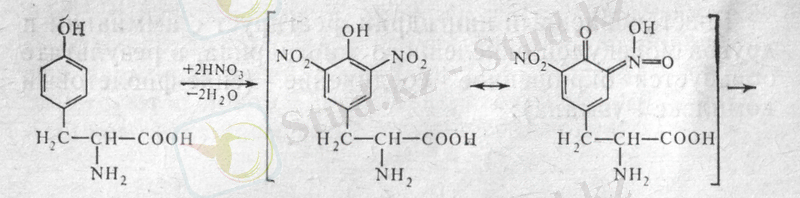
тирозин динитротирозин хиноидты формасы
(сары түсті)
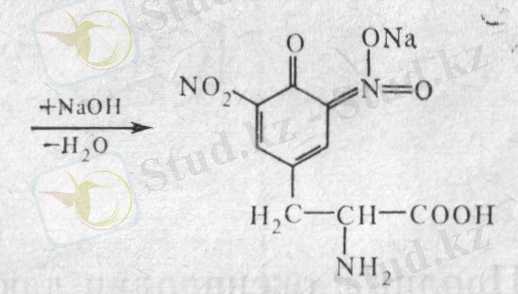
динитротирозиннің натрий тұзы
(қызыл-сары түсті)
4. Фоль реакциясы құрамында күкіртті амин қышқылы бар белоктар үшін тән.
Тәжірибе барысы. Белок ерітіндісінің 5 тамшысына 5 тамшы 30 %-дық NаОН және 1 тамшы 5 %-дық (СН 3 СОО) Рb ерітіндісін қосады. Сақтықпен қыздыру. Сұйықтық қараяды, қорғасын сульфидінің қара тұнбасы түзіледі.
Реакция химизмі.
СH 2 SH CH 2 OH
CHNH 2 + 2 NaOH → CHNH 2 + Na 2 S + H 2 O
COOH COOH
цистеин серин
Натрий сульфидін анықтау үшін қорғасын ацетатын пайдаланады, ол натрий гидроксидімен әрекеттесіп, плюмбитке айналады:
Pb(CH 3 COO) 2 + 2NaOH → Pb(ONa) 2 + 2CH 3 COOH
Қорғасын мен күкірт иондарының әрекеттесуі нәтижесінде қара немесе қоңыр түсті қорғасын сульфиді түзіледі:
Na 2 S + Pb(ONa) 2 + 2H 2 O → PbS↓ + 4NaOH
5. Паули реакциясы гистидин және тирозин қалдықтары бар белоктарға тән.
Тәжірибе барысы. Пробиркада 3 тамшы 1 %-дық сульфанил қышқылының тұз қышқылындағы (5 %-дық) ерітіндісіне 3 тамшы 0, 5 %-дық NaNO 2 ерітіндісін қосады, тез араластырады және 5 тамшы белок ерітіндісін қосады, араластырады және 5 тамшы 10 %-дық Na 2 СО 3 ерітіндісін қосады. Сұйықтық қызылсары-қызыл немесе шие-қызыл түске боялады.
Реакция химизмі. Сульфанил қышқылының қышқыл ерітіндісі натрий нитритімен әрекеттескенде диазобензолсульфон қышқылы түзіледі, ал соңғысы гистидинмен (тирозинмен) боялған азоқосылыс береді:
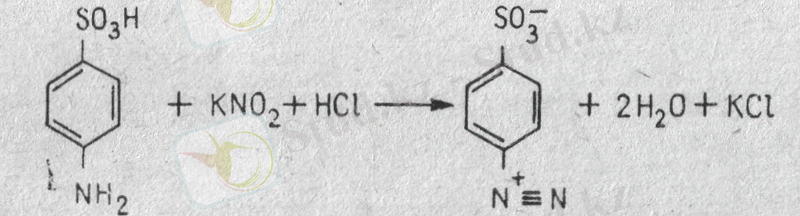
сульфанил қышқылы диазобензолсульфон қышқылы
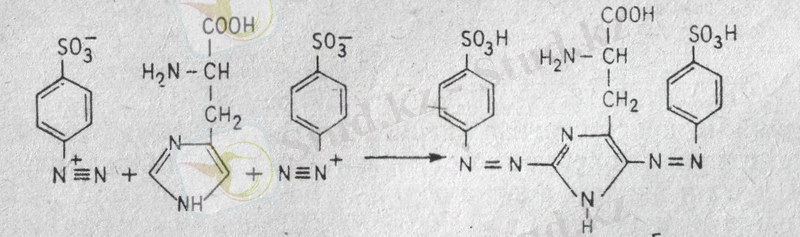
гистидин 2, 5-бис-n-
6. Миллон реакциясы тирозин және құрамында тирозин қалдықтары бар белоктарға тән.
Тәжірибе барысы. Белок ерітіндісінің 5 тамшысына 1 тамшы Миллон реактивін (сынап нитраты мен нитритінің конц. азот қышқылындағы ерітіндісі) қосады және сақтықпен қайнағанша қыздырады. Қызғылт немесе қызыл түсті тұнба түзіледі (тирозиннің сынапты нитротуындысы) .
Реакция химизмі.
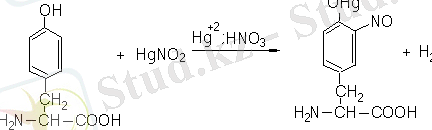 Кесте
Кесте
Қорытынды. Жұмыс мақсатына сәйкес қорытынды жасау. Мектеп практикасында қолдануға болады деген реакциялардың таңдап алыну себебін көрсету.
Бақылау сұрақтары
1 Қай органикалық қосылыстар амин қышқылдары деп аталады? Амин қышқылдарына қандай химиялық қасиеттер тән?
2. Аспарагин қышқылы мысалында амин қышқылдарының амфотерлілігін көрсетіңіз.
3. Белоктың «аминқышқылдық құрамы» және «бірінші ретті құрылымы» түсініктерінің айырмашылығы неде?
4. Белоктың 2-ші ретті құрылымы деген не?
5. Белоктың 3-ші ретті құрылымы деген не? Оны қамтамасыз ететін әрекеттесулердің типтері қандай?
6. Белоктардың сапалық реакцияларын қалай жіктеуге болады?
7. Реакциялардың қайсысы сақтықпен орындауды талап етеді, не себепті?
8. Нингидрин реакциясы көмегімен қандай атомдық топтар ашылады?
9. Белоктағы цистеинді, гистидинді қалай ашуға болады?
10. Миллон реакциясының көмегімен белоктағы қай амин қышқылы ашылады?
11. Ксантопротеин реакциясымен белоктардағы қай амин қышқылдары қалдықтары ашылады? Реакция неге солай аталады? Қайсысы - тирозин немесе фенилаланин - оңай нитрленеді? Не себепті?
12. «Биурет реакциясы» терминінің шығу тегі қандай? Оның химизмі қандай?
13. Мектепте пайдалануға қай реакцияларды және қандай критерийлері бойынша таңдап алдыңыз?
Зертханалық жұмыс № 2
Белоктарды тұндыру реакциялары
Теориялық бөлім
Белоктарды тұндыру реакцияларын екі топқа бөлуге болады. Қайтымды тұндыру кезінде ерітіндіден бөлініп шығатын белок өзінің табиғи қасиеттерін сақтайды және қайтадан ерітіндіге өткізіле алады. Белоктарды аммоний, сілтілік және сілтілік-жер металдары тұздары әсерімен тұнбаға түсіру қайтымды тұндыру мысалы бола алады. Бұл тұздар белоктың сулы қабықшасын жояды және зарядсыздандырады. Белоктардың сулы қабықшасы шамасы мен тұздар концентрациясы арасында тікелей байланыс бар: гидраттық қабықша аз болған сайын тұздар да аз қажет болады. Мысалы, ірі, ауыр молекулалары бар және су қабықшасы аз болатын глобулиндер ерітіндіні тұздармен толық қанықтырмағанда тұнбаға түседі. Ал неғұрлым кіші молекулалар ретіндегі және үлкен су қабықшасымен қоршалған альбуминдер тұнбаға ерітіндіні тұзбен толық қанықтырғанда түседі. Тұздармен тұнбаға түсіру белок фракцияларын бөлу үшін қолданылады.
Қайтымсыз тұндыру белок құрылымының молекула ішіндік терең өзгерістерімен байланысты, бұл кезде оның табиғи қасиеттері (ерігіштігі, биологиялық активтілігі және т. б. ) жойылады. Мұндай белок денатурацияланған белок, ал процесс денатурация деп аталады. Белоктардың денатурациясы күшті қышқылдық ортасы бар (рН 1-2) асқазанда жүреді және бұл протеолиздік ферменттер әсерінен олардың ыдырауына себеп болады.
Денатурация кезінде белоктың 3-ші, 4-ші ретті құрылымдары бұзылады, биологиялық қасиеттері жойылады. Белоктардың қайтымсыз тұндырылуы оларды қыздырғанда, минералдық қышқылдармен, кейбір органикалық қышқылдармен (трихлорсірке, сульфосалицил және т. б. қышқылдар), ауыр металдардың тұздарымен және басқа заттармен әсер еткенде жүреді (химиялық факторлар) . Мысалы, трихлорсірке қышқылымен тұндыру кейбір зерттеулерде белокты бөліп алып тастау үшін қолданылады. Белоктардың денатурациясы ауыр металдармен улануды емдеу негізіне қаланған. Бұл кезде уланған адамға сүт немесе шикі жұмыртқа ішкізеді, себебі металдар сүт немесе жұмыртқа белоктарын денатурациялай отырып, олардың бетіне адсорбцияланады және асқазан мен ішектің кілегейлі қабықшасына әсер етпейді, сонымен қатар қанға сіңірілмейді.
Денатурацияны болдыратын физикалық факторларға температура, механикалық әсерлер, ультрадыбыспен өңдеу, ионизациялық сәулелендіру жатады.
Практикалық бөлім
Жұмыс мақсаты:
- белоктарды қайтымды және қайтымсыз тұндыру реакцияларын жүргізуді меңгеру;
- белоктар денатурациясы құбылысымен танысу;
- белок қасиеттерін мектепте демонстрациялау үшін тәжірибелер таңдап алу.
Тәжірибе 1. Жұмыртқа белогы альбуминдері мен глобулиндерін тұзбен тұндыру арқылы бөлу.
Жұмыртқа белогы ерітіндісінің 2 мл-не сонша көлемде (NН 4 ) 2 SО 4 қаныққан ерітіндісін қосады. Түскен глобулиндер тұнбасын сүзеді және оның белокты табиғатын сәйкес реакция көмегімен дәлелдейді. Фильтратқа қаныққанша (NН 4 ) 2 SО 4 ұнтағын қосады. Альбуминдер тұнбасы беткі қабатқа көтеріледі, себебі ерітіндінің тығыздығы үлкенірек. Альбуминдердің белокты табиғатын дәлелдеу. Ерітіндіні аммоний сульфатымен қанықтырудың қандай дәрежесінде глобулиндер, қандай дәрежесінде альбуминдер тұнбаға түсетіні туралы қорытынды жасау.
Тәжірибе 2. Белоктарды концентрлі минералды қышқылдармен тұндыру.
Үш құрғақ пробирка алу, біреуіне 5 тамшы конц. НNО 3 , екіншісіне 5 тамшы конц. НСl, үшіншісіне 5 тамшы конц. Н 2 SО 4 тамызу. Пробиркаларды еңкейте отырып, әрқайсысына абайлап ішкі қабырғасы бойынша 5 тамшы белок ерітіндісін қосады. Белок ерітіндісінің қышқылмен жанасу шекарасында сақина түрінде белок тұнбасы түзіледі. Пробирканы сақтықпен шайқағанда тұнбалар (конц. НNО 3 бар пробиркадағы тұнбадан басқалары) ериді.
Тәжірибе 3. Белоктарды органикалық қышқылдармен тұндыру.
Екі пробиркаға 5-7 тамшыдан белок ерітіндісін құяды және 1-2 тамшыдан бірінші пробиркаға сульфосалицил қышқылын, екінші пробиркаға трихлорсірке қышқылын қосады. Тұнбалардың түзілуін байқау. Сульфосалицил қышқылы тек белоктарды ғана емес, олардың ыдырау өнімдерін де тұнбаға түсіреді. Трихлорсірке қышқылы тек белоктарды тұнбаға түсіреді де, ал олардың ыдырау өнімдерін тұнбаға түсірмейді.
Тәжірибе 4. Белоктарды ауыр металдар тұздарымен тұндыру.
Үш пробиркаға 5 тамшыдан белок ерітіндісін құяды. Бірінші пробиркаға 1 тамшы 5 %-дық CuSO 4 , екіншісіне - 1 тамшы 5 %-дық (СН 3 СОО) 2 Pb, үшіншісіне 1 тамшы 5 %-дық ZnSO 4 ерітіндісін қосады. Ауыр металдар катиондары әсерінен белоктың коагуляциялануы жүреді. Тұнбалардың түзілуін байқау. Ауыр металл тұздарымен улану кезінде белоктың зарарсыздандырғыш ретінде қолданылуы оның ауыр металл иондарымен берік қосылыстар түзу қасиетіне негізделген.
Жұмыс мақсатына сәйкес жалпы қорытындылар жасау.
Бақылау сұрақтары
1. Денатурация деген не? Ол қандай факторлар және реактивтер әсерінен жүреді. ?
2. Денатурация кезінде белок молекуласының құрылымы қалай өзгереді?
3. Денатурациясын болдырмай белокты ерітіндіден қалай тұндыруға болады?
4. «Тұзбен тұндыру» термині нені білдіреді?
5. Жұмыртқа белогы ерітіндісіндегі глобулиндерді альбуминдерден қалай бөліп алуға болады?
6. Альбуминдер мен глобулиндердің белокты табиғатын қандай реакциямен дәлелдеуге болады?
7. Биологиялық материалдан алынған сірінді анализі кезінде белоктарды бөліп алып тастау қажет болғанда қай реактивті пайдалануға болады?
8. Тәжірибелердің қайсысын мектепте «Белоктар» тақырыбын оқыту кезінде көрсетуге болады?
Зертханалық жұмыс № 3
Казеинді бөліп алу және оның изоэлектрлік нүктесін анықтау
Теориялық бөлім
Белоктардың маңызды қасиеті - олардың қышқылдық та, негіздік те қасиет көрсету, яғни амфотерлі электролиттер ролін атқару қабілеті. Бұл амин қышқылдары құрамына кіретін әртүрлі диссоциацияланушы топтар есебінен қамтамасыз етіледі. Мысалы, белокқа қышқылдық қасиетті аспарагин, глутамин қышқылдарының карбоксил топтары, ал негіздік қасиетті аргинин, лизин және гистидин радикалдары береді. Белок құрамында дикарбон қышқылдары неғұрлым көп болса, оның қышқылдық қасиеттері күштірек байқалады және керісінше.
Аталған топтардың белок молекуласының жалпы зарядын қалыптастыратын электрлік заряды да болады. Құрамында аспарагин және глутамин қышқылдары көп болатын белоктардың заряды теріс болады, ал негіздік амин қышқылдарының көп болуы белок молекуласына оң заряд береді. Осының салдарынан белоктар электр өрісінде жалпы зарядының шамасына байланысты катодқа немесе анодқа қарай жылжиды. Мысалы, сілтілік ортада (рН 7-14) белок протонды беріп, теріс зарядталады, ал қышқылдық ортада (рН 1-7) қышқылдық топтардың диссоциациясы тежеледі де, белок катионға айналады:
NH 3 + Қышқылдық орта NH 3 + Сілтілік орта NH 2
R R R
COOH COO - COO -
Катион Амфион Анион
Сонымен, белоктың катион немесе анион ретінде болуын анықтайтын фактор - сутек иондарының концентрациясымен анықталып, рН шамасы арқылы өрнектелетін орта реакциясы. Бірақ рН шамасының белгілі бір мәндерінде оң және теріс зарядтардың саны теңесіп, молекула электрнейтралды болады, яғни ол электр өрісінде жылжымайтын болады. Ортаның рН шамасының осындай мәні белоктардың изоэлектрлік нүктесі деп аталады. Бұл кезде белок тұрақтылығы төмен күйде болады және рН-тың қышқыл немесе сілтілік жаққа қарай аздаған өзгерісі кезінде оңай тұнбаға түседі. Көптеген табиғи белоктар үшін изоэлектрлік нүкте әлсіз қышқыл ортада (рН 4, 8-5, 4) . Бұл олардың құрамында дикарбон қышқылдарының басым болатындығын көрсетеді.
Практикалық бөлім
Жұмыс мақсаты:
- казеинді бөліп алу әдістемесін меңгеру, сапалық реакциялар көмегімен оның белокты табиғатын және фосфаттардың болуын дәлелдеу;
- казеиннің изоэлектрлік нүктесін анықтау әдістемесін меңгеру.
Тәжірибе 1 . Казеинді бөліп алу.
Казеинді сүттен бөліп алу оны изоэлектрлік нүктесінде (рН 4, 7) тұндыру арқылы жүзеге асырылады.
Тәжірибе барысы.
1. Центрифугалық пробиркаға 10 тамшы сүт, 10 тамшы су, 1 тамшы 10 %-дық сірке қышқылы ерітіндісін құяды. Казеиннің тұнбасы түзіледі.
2. Сынаманы 5 минут 3000 айналым/мин. жылдамдықпен центрифугалау.
3. Тұнба үстіндегі сұйықтықты құйып алады, ал тұнбаға 30 тамшы су қосады және гомогенді массаға дейін мұқият шайқап, араластырады.
4. Казеин ерітіндісін оның құрам бөліктеріне сапалық реакцияларды жүргізу үшін екі пробиркаға бөледі.
а) Биурет реакциясы:
Казеин ерітіндісіне 10 тамшы күйдіргіш натр ерітіндісін және 1 тамшы мыс (II) сульфаты ерітіндісін қосады. Пробирка ішіндегісі сілкіп-шайқағанда көк-күлгін түске боялады.
б) Молибдендік сынама:
Казеин ерітіндісіне 2-3 мл молибден реактивін қосады. Қоспаны араластырады және 1 минутқа қайнаған су моншасына қояды. Сұйықтық лимон-сары түске боялады, бұл фосфаттардың бар екендігін көрсетеді.
Тәжірибе 2. Казеиннің изоэлектрлік нүктесін анықтау.
Белоктардың ерітіндісі изоэлектрлік нүктеде неғұрлым тұрақсыз, сондықтан белоктар оңай тұнбаға түседі. Сол себепті белоктың изоэлектрлік нүктесін анықтау белок ерітіндісі неғұрлым көп лайланатын рН мәнін анықтауға келіп тіреледі.
Зерттеу материалы: натрий ацетатының 0, 2 М ерітіндісіндегі 0, 4 %-дық казеин ерітіндісі.
Реактивтер: сірке қышқылының 0, 2 М ерітіндісі, дистильденген су.
Құрал-жабдықтар: пробиркалары бар штатив, өлшеуіш пипеткалар, бюреткалар.
Тәжірибе барысы.
Белгілі бір рН мәні бар буферлі ерітінділер дайындау үшін 6 құрғақ пробиркаға реактивтерді кестеде көрсетілгендей мөлшерде құяды:
Кесте
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz