Органикалық химия пәні бойынша зертханалық сабақтарға әдістемелік нұсқаулар (6В01508 Химия мамандығы, Шәкәрім атындағы Семей мемлекеттік университеті, 2021)


ҚАЗАҚСТАН РЕСПУБЛИКАСЫ ҒЫЛЫМ ЖӘНЕ БІЛІМ МИНИСТРЛІГІ
СЕМЕЙ қаласының ШӘКӘРІМ атындағы МЕМЛЕКЕТТІК УНИВЕРСИТЕТІ
СМЖ 3 дәрежелі құжаты
№1 басылым 25. 02. 2015 ж.
Жаратылыстану-математика факультеті
Химия және география кафедрасы
ОРГАНИКАЛЫҚ ХИМИЯ
пәні бойынша зертханалық сабақтарға
әдістемелік нұсқаулар
6В01508- «Химия» мамандығы бойынша оқитын студенттерге
Семей
2021
Мазмұны
1. Кіріспе
2. Зертханалық сабақтардың мазмұны
3. Әдебиет және интернет-ресурстар
Кіріспе
Қазіргі кезде химияны оқытуда органикалық химияның манызы зор. Ең алдымен ол органикалық синтез өнімдерінің кеңінен қолданылуына, техиикада, тұрмыста және медицинада жаңа органикалық материалдардың қажеттілігінің өсуіне, сонымен катар жануарлар мек өсімдіктер оргамизмдердің тіршілігінде органикалық реакциялардың атқаратын роліне байланысты. «Органикалық химия» пәні студенттердің дүниенің әлемдік бейнесі қөзқарастарын қалыптастыруға, шығармашылық ойлау қабілеттерін дамытуға, химия мен тіршіліктің арасындағы байланысты орнатуға, педагогикалық іс-әрекетінде қажетті білім, практикалық дағдырлары және құзырлықтарымен болашақ оқытушыны қаруландыруға бағытталған
Зертханалық сабақтарды орындау мақсаты
- Зертханалық сабақтарды орындау нәтижесінде студент білу керек:
пәнді оқу нәтижесінде білім алушы білуі қажет:
Пәнді оқыту нәтижесінде студент білу керек:
Білу :
- органикалық қосылыстар номенклатурасының жіктелуінің теориялық негіздерін білуі;
- негізгі стехиометриялық және фундаменталды заңдарды меңгеруі;
- органикалық қосылыстарды синтездеу әдістерін білуі;
Біліктілігі:
- органикалық химия реакциялар теңдеулерін құрастыра білуі
- органикалық заттардың класстарына сәйкес химиялық қасиеттерін сипаттай білуі;
Дағдысы:
- жаратылыстану ғылымдарының оқулықтарымен жұмыс жасай білу және және барлық анықтама түрлерімен жұмыс жасай білу;
- өздігінен ғылыми-зеріттеу жұмыстарын қоюды ұйымдастыра білуге тиіс.
2. Зертханалық сабақтардың мазмұны
Зертханалық жұмыс №1
Тақырыбы: Органикалық химия зерітханасындағы техникалық қауіпсіздік. Органикалық қосылыстардың сапалық элементтік анализі
Мақсаты: Органикалық химия зерітханасындағы техникалық қауіпсіздік ережелерін, органикалық қосылыстардың сапалық элементтік анализі жөнінде,
органикалық қосылыстар номенклатурасының жіктелуінің теориялық негіздерін білуі; органикалық қосылыстардың гибридтену типтерін ажырата білуі
Органикалық химия зерітханасында
жұмыс орындаудың жалпы ережелері
Студент Зертханалық жұмысты жасаудың алдында келесі ережелерді орындауы тиіс. Алдымен студент оқулықтан Зертханалық жұмысқа қажетті тарауларды, дәріс конспектісін оқып және Зертханалық жұмыстың мазмұнымен танысады. Қауыпсіздік ережесімен алдын ала танысу керек.
- Тәжірибеге қажетті ыдыстардың, реактивтердің, құрал- жабдықтардың тазалығын тексермей жұмыс бастамайды.
- Тәжірибені жасағанда оқулықта (әдістемелік құралда) көрсетілген жұмыс ретін сақтап, жұмысқа қажетті заттардың дәл мөлшерін алуы тиіс.
- Тәжірибе кезінде зерітханада орынсыз қозғалыс жасап, сыртқы киіммен тұруға болмайды.
- Жанғыш және қауіпті заттармен жұмыс жасағанда сақтық шараларын мұқият орындауы қажет.
- Тәжірибе кезінде байқалатын құбылыстарды зер салып бақылап, өзгерістерді арнаулы дәптерге жазып отыруы керек.
- Зерітханада тамақ жеуге, темекі тартуға болмайды.
- Зертханалық жұмыс біткеннен кейін әрбір студент жұмыс орнын, қолданған ыдыстарды жуып, тазалауы қажет.
- Тез тұтанатын заттарды құйғанда немесе өлшегенде оларды оттан алыс ұстау қажет;
- Натрий, калий металдарымен жұмыс кезінде көзге қорғағыш көзілдірік кию қажет.
- Натрий, калий металдарын қолмен ұстауға, сулы орынға немесе қалдық заттар салынатын ыдысқа тастауға болмайды.
- Күкірт қышқылын сұйылту үшінкүкірт қышқылын суғақұяды. Қышқыл немесе сілті қосылған қоспаның аузын қолмен басып тұрып немесе ашып қойып, қатты шайқауға болмайды.
12. Зерітханада студент қай жерде қауыпсіздікке қажет құралдар (бетперде, биялай, газдан қорғауыш, дәрі қобдишасы т. б. ) тұрғанын білуі керек.
№ 1 Зертханалық жұмыс
Органикалық қосылыстардың сапалық анализі
Органикалық заттардың сапалық құрамы оның молекуласында қандай заттар болуымен сипатталады. Органикалық қосылыстарда көміртегіден басқа сутегі, оттегі, күкірт, галогендер, фосфор болады. Органикалық қосылыстардың құрамына енетін заттар бейорганикалық және аналитикалық химия әдістерімен анықталады.
Жұмыстың мақсаты: органикалық заттарды және олардың негізгі элементтерін ашу әдістерімен танысу.
Реактивтер мен жабдықтар: сахароза, Ва(ОН) 2 ерітіндісі, СuO, штатив, пробиркалар, газ жүретін түтікшелі тығын, спирт шамы.
1- тәжірибе. Көміртегіні және сутегіні анықтау
Жұмыс барысы: Пробиркаға 0, 1 г зеріттелетін затты және мыс оксидін салып, газ жүретін түтікшелі тығынмен жабады және оның ұшын көлемінің 1/3 бөлігіне барий гидроксидінің ерітіндісі құйылған екінші пробиркаға түсіреді. Спирт шамының жалынына қыздырғанда, зеріттелген зат ыдырайды, көміртегі атомдары көмір қышқыл газының молекуласына ауысады. Көмір қышқыл газын барий карбонатының тұнбасы түзілуінен байқауға болады . Зерітелетін қосылыстағы сутегі атомдары су молекуласына айналады. Су пробирканың жоғары жағына және газ жүретін түтікшеде түзіледі.
Реакция теңдеуі:
С 12 Н 22 О 11 + 24СuO → 12CO 2 + 11H 2 O + 24Cu
2- тәжірибе. Азотты анықтау
Реактивтер мен жабдықтар: натрий гидроксиді, органикалық зат (мочевина, жұмыртқанның ақуызы), шпатель, спирт шамы, мақта, мыс сымы, пробиркалар, лакмус қағазы, хлороформ, төртхлорлы көміртегі.
Жұмыс барысы: Құрғақ пробиркаға натрий гидроксидін және аз мөлшерде зеріттелетін затты (шпатель ұшыңда) салады. Пробирканы мақтамен жауып, үстіне ылғалды лакмус қағазын қояды. Алдымен пробирканы спирт шамымен әлсіз, содан кейін қатты қыздырады. Лакмус қағазының көк түске боялуы, азоттың барын көрсетеді, себебі тәжірибе шартында азот аммиакқа айналады.
3- тәжірибе. Галогендерді ашу - Бейльштейн реакциясы
Хлор, бром, иод Бельштейн сынамасымен оңай анықталады. Бұл реакция галогентуындыларды мыспен қыздырғанда, ұшқыш мыс галогенидтері түзіліп, жалынды жасыл түске бояуына негізделген.
Жұмыс барысы: мыс сымын иілген күйде мыс оксиді түзілгенше қыздырады. Суығаннан кейін сымның ұшын зеріттелетін затқа (хлороформ, төртхлорлы көміртегі) батырып, жалынға ұстайды. Мыс оксидінің түзілу және оның төртхлорлы көміртегімен әрекеттесу реакциялары теңдеулерін жазу керек. Түйін жазыңдар.
Өзін өзі бақылауға және Зертханалық жұмыстарды қорғауға арналған сұрақтар:
- Зертханалық тәжірибе жасауда қандай сақтық ережелерін сақтау керек?
- Органикалық заттарда көміртегі мен сутегінің болуы неге негізделген, түйін жасау керек.
- Бейльштейн сынамасының мәні неде?
- Органикалық қосылыстардағы азотты ашудың басқа тәсілдерін атаңыздар.
- Неге мыс сымы қыздырғанда қараяды? Теңдеуін жазу керек.
- Органикалық қосылыстардағы элементерді сапалық қалай анықтайды?
- Барий гидроксидінде қандай реакция жүреді?
Әдебиеттер:
- Сейтжанов, С. Ф. Органикалыќ химия. - Алматы, 2005
- Утелбаева, А. Химия. Т. 5 Органикалық химия. Гетерофункционалды қосылыстар . - Алматы, 2007
- Органическая химия. В 2-х кн. Кн. 1. Основной курс / В. Л. Белобородов / - 2008
Зертханалық жұмыс №2
Тақырыбы: Көмірсутектерді (алкандарды) алу және химиялық қасиеттері
Мақсаты: Алкандар құрылысымен, қасиеттерімен және номенклатура негіздерімен, алу тәсілдерімен танысу, органикалық реакциялардың жіктелу негізі туралы түсінік беру.
Көмірсутектерді (алкандарды) алу және химиялық қасиеттері
Жұмыстың мақсаты: Көмірсутектерді Зертханалық тәсілмен алуды игеру және олардың химиялық қасиеттерін зеріттеу.
Реактивтер мен жабдықтар: Натрий ацетаты (СН 3 СООNa), натронды ізбес (NaОН + Са(ОН) 2 ), калий перманганаты (КМnO 4 ), штатив, пробиркалар, спирт шамы, газ жүретін түтікшелі тығын, фарфор тостағаны, бром суы.
1- тәжірибе. Метанды алу және оның қасиеттерін зеріттеу
Жұмыс барысы: Бір бөлік сусыз натрий ацетаты мен екі бөлік натронды ізбестің қоспасын фарфор тостағанда араластырып құрғақ пробиркаға салып, аузын газ түтігі бар тығынмен бекітеді де, штативке көлбеу орнатады.
Алдымен пробирканы баяу, ал қоспа салынған жерін қатты қыздырады. Бөлінген метанды су астында жинайды. Метанды екі пробиркаға жинандар.
Метан жақсы жанады. Оны байқау үшін метаны бар пробирканың су астында бармақпен аузын басып тұрып, судан шығарады да спирт шамының жалынына ұстап аузынан тұтатады, метан көкшіл түсті күйесіз жалын шығарып жанады. Метан толық жану үшін пробиркаға шетінен аз- аздап су құю керек, сол кезде пробирка түбіндегі газ біртіндеп жоғары көтеріледі де, жану толық жүреді. Қоспаны қыздыра отырып, газ жүретін түтікшенің ұшын 1 мл калий перманганаты құйылған пробиркаға (1-2 тамшы концентрлі күкірт қышқылы құйылған) батырады, сосын газ жүретін түтікшенің ұшын 1 мл бром суы құйылған пробиркаға батырады. Бұл ерітінділерден газды 20-30 секундтай өткізеді. Қандай өзгеріс болады? Сосын газ жүретін түтікшенің ұшын жоғары қаратып, газ жүретін түтікшенің ұшында газды жағады.
Пробирка суыған соң бірнеше тамшы концентрлі тұз қышқылын құяды. Неге? Байқаған құбылысты сипаттап, реакция теңдеуін жазыңдар.
Өзін өзі бақылауға және Зертханалық жұмыстарды қорғауға арналған сұрақтар:
1. Метанды алу реакциясының теңдеуін жаза керек. Метан суда ери ме?
2. Метанның жану реакциясының теңдеуін жазыңыздар. Жалын түсі қандай? Неге?
3. Метанның түзілу реакциясын жазыңыздар.
4. Неге сусыз натрий ацетаты қолданылады? Натрон ізбесі не үшін қажет?
5. Калий перманганаты және бром суы ерітінділері арқылы метанды өткізгенде ерітінділер түсі қалай өзгереді? Метан қай гомологтық қатарға жатады?
Әдебиеттер:
- Сейтжанов, С. Ф. Органикалыќ химия. - Алматы, 2005
- Утелбаева, А. Химия. Т. 5 Органикалық химия. Гетерофункционалды қосылыстар . - Алматы, 2007
- Органическая химия. В 2-х кн. Кн. 1. Основной курс / В. Л. Белобородов / - 2008
Зертханалық жұмыс №3
Тақырыбы: Көмірсутектерді (алкендерді) алу және химиялық қасиеттері
Жұмыстың мақсаты: Алкендерді Зертханалық тәсілмен алуды игеру және олардың химиялық қасиеттерін зеріттеу. Метанның қасиеттерімен салыстыру.
Реактивтер мен жабықтар: этил спирті (С 2 Н 5 ОН), күкірт қышқылы (Н 2 SO 4 концентрлі), калий перманганатының (КМnO 4 ) ерітіндісі, штатив, пробиркалар, газ жүретін түтікшелі тығын, пемза үгінділері, спирт шамы.
Жұмыс барысы: Пробиркаға 0, 5 мл этил спиртін құйындар және оған абайлап 2 мл концентрлі күкірт қышқылын қосындар. Үстіне қыздырған кезде қоспа біркелкі қайнау үшін пемза түйірлерін салыңдар. Пробирканы баяу және ептілікпен қыздырындар.
Қыздырғанда пробиркадағы қоспа қарая бастайды, одан этилен газы бөлінеді.
Түтіктен шығып жатқан этиленді екінші пробиркадағы 1 мл калий перманганатының ерітіндісіне жіберіңдер. Не байқалады?
Бөлініп жатқан этиленді су астында жинап алып немесе газ түтігінің ұшында жағыңдар. Жалынның түсін байқандар. Қыздыруды тоқтатып, құралды суытыңдар.
Өзін-өзі бақылауға және Зертханалық жұмыстарды қорғауға арналған сұрақтар:
1. KMnO 4 ерітіндісі арқылы метан өткізгенде қандай өзгеріс болады? Неліктен?
2. Зерітханада этиленді алу реакциясының теңдеуін жазыңыздар.
3. Неліктен тәжірибеде қолданылған күкірт қышқылы концентрлі болуы керек?
4. Калий перманганатының ерітіндісі түссізденеді. Неге?
5. Этилен жалынымен метан жалынының айырмашылығы неде?
6. Этиленнің жану реакциясының теңдеуін жазыңыздар.
Әдебиеттер:
- Сейтжанов, С. Ф. Органикалыќ химия. - Алматы, 2005
- Утелбаева, А. Химия. Т. 5 Органикалық химия. Гетерофункционалды қосылыстар . - Алматы, 2007
- Органическая химия. В 2-х кн. Кн. 1. Основной курс / В. Л. Белобородов / - 2008
Зертханалық жұмыс №4
Көмірсутектерді ( Алкиндер. Алкадиендер) алу және химиялық қасиеттері
Жұмыстың мақсаты: ацетиленді тәжірибелік жолмен алу және ацетиленнің химиялық қасиеттерін зеріттеу.
Реактивтер мен жабдықтар: кальций карбиді, калий перманганаты ерітіндісі, бром суы, фенолфталеиннің 1%-тік спирттегі ерітіндісі, шыны пробиркалар, газ жүретін түтікшелі тығын, 0, 2н күміс нитраты ерітіндісі, мыс(І) хлоридінің аммиактағы ерітіндісі.
1- тәжірибе. Ацетилен алу және оның қасиеттері
Жұмыс барысы: Газ жүретін түтікшемен жабдықталған пробиркаға бір кесек кальций карбидін (СаС 2 ) салып, 3-4 тамшы су құйыңдар. Пробирка ішіндегі кальций карбиді сумен әрекеттесіп, ацетилен түзіледі.
СаС 2 + 2Н 2 О → Са(ОН) 2 + НС ≡ СН
Газ түтігінен шығып жатқан ацетиленді түтік ұшында тұтатыңдар, ол ашық қызғылт түсті күйелі жалынмен жанады.
Содан кейін газ жүретін түтікшенің ұшын калий перманганатының ерітіндісі құйылған пробиркаға(күкірт қышқылымен қышқылданған) батырыңдар. Дәл осындай тәжірибені бром суы ерітіндісімен, мыс(І) хлоридінің аммиактағы ерітіндісімен, күміс(І) диаммин гидроксиді ерітіндісімен жүргізіңдер. Күміс(І) диаммин гидроксиді ерітіндісін былай дайындайды:пробиркаға 2 тамшы күміс нитраты ерітіндісін құйып, бірнеше тамшы концентрлі аммиак ерітіндісін(түзілген күміс(І) оксидінің тұнбасы ерігенге дейін) қосады. Ацетиленнің бөлінуі аяқталған соң пробиркаға 1 тамшы фенолфталеиннің спирттегі ерітіндісін қосыңдар.
Ацетиленді алу реакциясының теңдеуін оның структуралық формуласын пайдаланып жазу керек.
2- тәжірибе. Каучуктің қанықпаушылық сипаты
Реактивтер мен жабдықтар: 5% каучуктің бензиндегі ерітіндісі, бромның бензиндегі ерітіндісі
Жұмыс барысы:
Сынауыққа 2 мл каучуктің бензиндегі ерітіндісін және бромның бензиндегі ерітіндісін пипеткамен тамшылатып құйып, оны қаттырақ шайқап отыра араластырады. Бромның каучук молекуласының қос байланысына қосылу салдарынан түссізденуі байқалады.
Өзін-өзі бақылауға және Зертханалық жұмыстарды қорғауға арналған сұрақтар:
1. Ацетиленнің жану реакциясының теңдеуін жазыңдар.
2. Ацетиленді калий перманганаты ерітіндісі арқылы өткізгенде, қандай өзгеріс болады? Реакция теңдеуін жазыңдар, электрондық баланс әдісін қолданыңдар (реакция нәтижесінде көмірқышқыл газы, марганец және калий сульфаттары, су бөлінеді) .
3. Ацетиленді бром суы арқылы өткізгенде, қандай өзгеріс байқалады? Реакция теңдеуін жазыңдар.
4. Бастапқы пробиркаға фенолфталеин ерітіндісін қосқанда, ерітінді түсінің өзгеруін түсіндіріңдер.
5. Ацетиленнің мыс(І) хлоридінің аммиактағы ерітіндісімен реакциясының теңдеуін жазыңдар.
6. Каучуктың броммен реакциясының теңдеуін жаз.
Зертханалық жұмыс №5
Тақырыбы: Алициклді қосылыстар. Ароматты көмірсутектер.
Мақсаты: Алициклді қосылыстар. Ароматты көмірсутектердің жіктелуі, номенклатурасы және изомерінің негізгі принциптерін, олардың физико-химиялық қасиеттерін білу; Алициклді қосылыстардың, ароматты көмірсутектердің формуласын құрастыра білу және алициклді қосылыстардың, ароматты көмірсутектерді және туындыларын атай білу.
Терпендер.
Реактивтер мен жабдықтар: скипидар, бром суы, калий перманганаты, калий идінің ерітіндісі, крахмал ерітіндісі.
1-Тәжірибе. Терпендердің қанықпаушылық сипаты.
Сынауыққа 2 тамшы бром суын және 1 тамшы скипидар косып, жақсылап шайқау керек. Скипидардың негізгі массасын құрайтын пинен қопарылыс кезінде бромның қос байланысы үзілуісалдарынан қосылады.
2-тәжірибе . Терпендердің тотығуы.
Сынауыққа 1 тамшы калий перманганатының ерітіндісін, 5 тамшы су және 1 тамшы скипидар кұйып араластырамыз. Ерітіндісі бар сынауықты қаттырақ шайқау керек.
3-тәжірибе. Ауаның пиненмен озондануы
Сынауыққа 1 тамшы калий идін, крахмал клейстерін және скипидар қосамыз. Сынауықтағы ерітіндіні араластырукерек. Ерітіндінің күлгін түстен көк түске өзгеруін байқаймыз. Көк түстің түзілуі бос тың тотығуымен түсіндіріледі.
Процесстің химизмі:
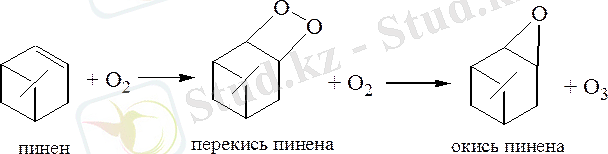
[О] + О 2 → О 3 2КI + О 3 + Н 2 О → 2КОН + I 2 + О 2 Пинен ауа оттегісімен жеңіл тотығып, пиненнің асқын тотығына айналады. Пиненнің асқын тотығынан оттегі атом түрінде бөлінеді де, пинен тотығы пайда болады. Ауа оттегісі атомдық оттегімен әрекеттесіп озонға айналады. Қылқанды орманда ауаның озондануы негізгі массасын пинен құрайтын скипидардың тотығуымен түсіндіріледі.
Ароматты көмірсутектер.
Реактивтер мен жабдықтар: 5% каучуктің бензиндегі ерітіндісі, бромның бензиндегі ерітіндісі
Жұмыс барысы:
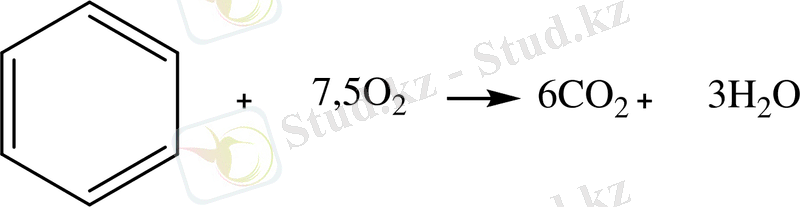
4-тәжірибе. Натрий бензоатынан бензол алу.
Құрғақ сынауыққа алдын ала дайындалған натрий бензоаты мен натронды әк(1:1) қоспасын араластырамыз. Сынауықты штативке горизонтальды орналастырып, газ өткізгіш түтікпен сынауықты бекітеміз, соңында түтіктің екінші ұшын су астындағы мұзбен жібереміз.
Реакцияға керекті сынауықты от жалынына қыздырамыз. Бензол бірден сынауықтағы қоспаға түспеу үшін сынауықты алдымен басынан, кейін қоспаны қыздырамыз. Біраз уақыттан соң қоспадағы суда майлы бензол тамшылары пайда болады. Сынауық суыған соң оның бетін ашамыз. Бензолдың өзіне тән иісі сезіледі.
5-тәжірибе. Бензолдың қосылысы. а) Бензол ерітіндісі әр түрлі ерітінділерде. 3 сынауыққа 1 тамшыдан бензол құямыз. Бірінші сынауыққа 3 тамшы су, келесі сынауыққа 3 тамшы спирт, үшінші сынауыққа - 3 тамшы эфирді пипеткамен тамызамыз. Қоспаны мұқият араластыру қажет. Сонымен, бензол тәжірибе жүзінде ерімейтін және органикалық қоспаларды жақсы еритінін тәжірибе жүзінде дәлелдейміз. Қорытынды: б) Бензол суының бром суына әсері. Сынауыққа 3 тамшы бром суын және 2 тамшы бензол құйып араластырамыз. Қаттырақ шайқап, оны аз уақытқа қоямыз. Байқау және қорытынды: в) Бензолдың жануы. (Тәжірибені тартқыш шкафта орындау керек!)Фарфорлы чашкаға 1 тамшы бензол салып, жағамыз. Олжарқыраған жалын болып жанады.
Өзін-өзі бақылауға және Зертханалық жұмыстарды қорғауға арналған сұрақтар:
- Терпендерге түсінік беріп, жіктеу негіздеріне сәйкес өкілдеріне мысал көрсет
- Стериндерге қандай қосылыстар жатады?
- Ароматты көмірсутектер қандай ерекшеліктеріне байланысты осы классқа жатқызылады?
- Ароматты көмірсутектерге қандай реакция типтері тән?
- Бензолды зерханада неден алады? Бензол қандай химиялық қасиет көрсетеді ?
Әдебиеттер:
- Сейтжанов, С. Ф. Органикалыќ химия. - Алматы, 2005
- Утелбаева, А. Химия. Т. 5 Органикалық химия. Гетерофункционалды қосылыстар . - Алматы, 2007
- Органическая химия. В 2-х кн. Кн. 1. Основной курс / В. Л. Белобородов / - 2008
Зертханалық жұмыс №6
Тақырыбы: Ароматты көмірсутектер туындылары
Мақсаты: Ароматты көмірсутектердің жіктелуі, номенклатурасы және изомерінің негізгі принциптерін, олардың физико-химиялық қасиеттерін білу; Ароматты көмірсутектердің формуласын құрастыра білу және ароматты көмірсутектерді және туындыларын атай білу.
Реактивтер мен жабдықтар : бензол (марки "хч") ; арнайы тазартылған толуол, ксилол, нафталин, хлорбензол, хлорлы бензил; концентрлі қышқылдар- күкіртті, азотты, тұз; 10%-ы бромды төртхлорлыкөміртек ерітіндіндісі; бром суы; калия перманганатының 1%-ы ерітіндісі; күміс нитратының 0, 2 н ерітіндісі; натронды әк; тотықсызданған темір, мұз және қар, көк лакмусты қағаз.
Жабдықтар : газөткізгіш түтікше, сынауықтар жинағы, фарфорлы чашка, 100 мл көлемдегі3 стакан, спирт шамы.
1- Тәжірибе. Ароматты қосылыстарды сульфирлеу
Бірінші сынауыққа 3 мл бензол, екінші сынауыққа 3 мл толуол, ал үшіншісіне нафталиннің бірнеше кристалын саламыз. Әр сынауыққа 4-5 тамшы концентрлі күкірт қышқылын құямыз және ыстық сулы моншада қыздырамыз. Нафталин жартылай буланып, сынауықтың шетінде сұйықтықтан жоғары деңгейде кристалданады, оны сынауықты толық қыздыру арқылы қайта еріту қажет. Біртекті ерітінді алу үшін көмірсутекке қажетті уақытты белгілеу қажет. Осыдан кейін сынауықтарды суық суда салқындатып, 0, 5 мл су құямыз. Егер сульфирлеу толық орындалса, мөлдір ерітінді түзіледі. Оның себебі сульфоқышқылдар суда жақсы ериді.
2-Тәжірибе. Бензол мен толуолды нитрлеу
Колбаға немесе стаканға 2 мл концентрлі азот қышқылы мен 3 мл концентрлі күкірт қышқылын араластырып, сулы моншада ақырындап салқындатамыз (тәжірибені тартқыш шкафта орындаймыз) . Салқындатылған қоспаны екі сынауыққа бөліп, біріншісіне 1, 5 мл бензолды тамшылатып, екіншісіне толуолды тамшылатып құямыз. Осыдан кейін реакция қоспасының температурасы 50-60°С-тан асып кетпеуін бақылау қажет. Аренді қосқаннан кейін қоспаны 3-5 минут шайқайды және 20 мл су құйылған стаканға құяды. Нитроқосылыстар ауыр майлы тамшылар түрінде тұнады және өткір иісі болады. Нитроқосылыстар улы болғандықтан оларды тәжірбеден кейін арнайы ыдыстарға құю керек. Арендердің нитрлену реакция теңдеуін жазыңыз. Бензол мен толуолдың нитрленуіндегі айырмашылықтарды салыстырамыз.
3-Тәжірибе. Нафталиннің нитрленуі
Сынауыққа 0, 3 г нафталинге 2 мл концентрлі азот қышқылын (ρ = 1, 4 г/см) қосамыз және қайнаған сулы моншада 5 минут қыздырамыз. Ары қарай ыстық ерітіндіні суық суы бар стақанға құямыз. Салқындау барысында нитронафталин кристалданады.
Нафталиннің нитрлену реакция теңдеуін жазыңыз. Нафталиндегі нитрогрупты ауыстыру қандай күйде болады? Шыққан өнімнің түсін белгілеу.
4-Тәжірибе. Бензолды, толуолды және нафталинді бромдау
Үш құрғақ сынауыққа 1 мл-ден бензолды, толуолды және 0, 1 г нафталинді орналастырамыз. (Тәжірибені тартқыш шкаф астында орындау қажет!) . Әрбір сынауыққа 1 мл төртхлорлы көміртекті бром ерітіндісін қосамыз. Сынауықты спиртшамның баяу жалынына қыздырамыз. Салқындаудан кейін бензолды сынауыққа бірнеше темір ұнтағының түйіршін салып тағы да абайлап 2-3 минут қыздырамыз. Кейін сынауықтағы затты 2 мл суы бар сынауыққа құямыз. Төртхлорлы көміртекті бромның бензолмен, толуолмен және нафталинмен реакциясы жүруі мүмкін бе? Сәйкес реакция теңдеулерін жазыңдар. Темір ұнтағының түйіршігін не үшін қосады? Бромның бензолға алканадармен және алкендермен химиялық әсерін салыстыр.
5-Тәжірибе. Бензол гомологтарының тотығуы.
Екі сынауыққа 0, 5 мл толуол және п-ксилол ерітіндісін құямыз. Әрбір сынауыққа әртүрлі мөлшерде күкірт қышқылымен қышқылдатылған калий перманганатының ерітіндісін құямыз. Сынауықтарды 1-2 минут шайқаймыз.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz