Судың электролиттік диссоциациясы, иондық және ерігіштік көбейтінділері


Дәріс №12
Тақырыбы: Судың электролиттік диссоциациясы.
Жоспары:
1. Судың электролиттік диссоциациясы.
2. Судың иондық көбейтіндісі.
3. Ерігіштік көбейтіндісі.
Негізгі ұғымдар: электролиттер, бейэлектролиттер, судың иондық көбейтіндісі, ерігіштік көбейтіндісі.
Мазмұны:
Электролиттер мен бейэлектролиттер
Барлық заттарды олардың ерітіндідегі өткізгіштігі бойынша екі топқа бөледі:
Электролиттік диссоциация теориясы
Электролиттердің ерітіндісі мен балқымаларында әртүрлі зарядталған (оң және теріс) иондардың бар болуы салдарынан электр тоғы өтеді. Бұл құбылысты түсіндіру үшін швед ғалымы Сванте Аррениус 1887 жылы электролиттік диссоциация теориясын (ЭДТ) ұсынды.
Диэлектрлігі жоғары ортада (су, спирт т. б. ) иондарға ыдырайтын заттарды электролиттер деп атайды. Электролиттердің молекулалары суда ерігенде зарядталған бөлшектерге − иондарға ыдырайды. Бұл құбылыстарды электролиттік диссоциация дейміз.
Қышқылдардың, гидроксидтердің сулы ерітінділерінің қасиеттері, олардың қандай иондарға анықталады. Қышқылдардың жалпы қасиеттері қышқыл ерітінділерінде бола алатын сутек иондарының, ал сілтілік қасиет гидроксил иондарының болуына тәуелді. Диссоциацияланғанда әрі сутек, әрі гидроксил иондарын түзетін электролиттер амфолиттер деп аталады. Амфолиттерді қышқылдармен және сілтілермен әрекеттесіп, тұз түзуге қабілетті келетін электролиттер деп қарастырамыз.
Көп негізді қышқылдар мен сілтілер әдетте сатыланып диссоциацияланады. Сатыланып диссоциациялану нәтижесінде қышқылдық және негіздік тұздар түзіледі.
Күшті және әлсіз электролиттер
Барлық заттардың молекулалары үшін иондарға ыдырау қабілеттілігінің бірдей болуы мүмкін емес, өйткені әртүрлі зат молекуласындағы химиялық байланыстар бірдей емес. Электролиттік диссоциация процесінің қайтымдылығы салдарынан кез келген электролит ерітіндісінде тепе-теңдік күйі орын алады: бірдей уақыт бірлігінде қанша молекула ыдыраса, сонша әртүрлі зарядталған иондар қосылып молекулалар түзіледі.
Мұндай тепе-теңдік күйдің сандық сипаттамасы диссоциация дәрежесі болмақ. Диссоциация дәрежесі α деп иондарға ыдыраған молекулалар санының (N дис ) ерітіндідегі жалпы молекулалар санына (N жалпы ) қатынасын айтады:
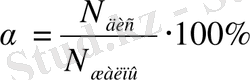
Диссоциация дәрежесі - өлшемсіз шама; оны пайызбен (%) немесе бірлік үлесімен өрнектейді. Электролиттерді α мәні бойынша былай бөледі:
а) егер α>30% болса, онда электролит күшті болады. Оларға барлық дерлік ерімтал тұздар, күшті қышқылдар (HC1, HBr, HJ, НNО 3 , Н 2 SО 4 (сұйыт. ), HClО 4 ) және сілтілер (LiОH, NaОH, Ва(ОН) 2 , КОН) жатады;
б) егер 3%<α<30% болса, онда электролиттер орташа болады. Мысалы: Н 2 SО 3 , HF, HNО 2 , H 3 PО 4 ;
в) егер 0<α<3% болса, онда электролиттер әлсіз болады. Оларға СН 3 СООН, Н 2 СО 3 , H 2 S, H 2 SiО 3 , Н 3 ВО 3 қышқылдары, суда ерімейтін негіздер, NH 4 ОH және су жатады.
Бұл арада келесі жайларды да ескеру керек, олар: диссоциация дәрежесі концентрация мен температураға (температураны жоғарылатқанда және ерітіндіні сұйылтқанда α жоғарылайды) ; электролиттің табиғатына (электролит молекуласындағы катион мен анион арасындағы байланыс күші) ; еріткіштің табиғатына (оның диэлектрлік өтімділігі және иондардың сольваттау қабілеті) тәуелді болады. Айталық, кәдімгі концентрациядағы (>10 -4 моль/л) сірке қышқылы - әлсіз электролит болса, ал концентрациясы <10 -4 моль/л сірке қышқылы күшті электролит екен.
Күшті электролиттердің диссоциация дәрежесін өлшеу үшін берілген электролит пен сол заттың шексіз сұйық ерітіндісінің электр өткізгіштіктерін салыстыру әдісін пайдаланады. Бұл шаманың мәні әрқашан да бірден кіші болады екен және оны диссоциацияның емескі (көрінетін-кажущейся) дәрежесі а каж дейді. Бұл шама диссоциацияның шын дәрежесімен бірдей келмейді, ауытқиды. Ал күшті электролит диссоциациясының шын дәрежесі әрқашан да бірге жуық.
Судың диссоциациялануы. Сутектік көрсеткіш
Су - әлсіз амфотерлік электролит. Судың диссоциациялану теңдеуі:
2Н 2 О Н 3 О + + ОН -
немесе
Н 2 О Н + + ОН -
Теңдеуден көрініп тұрғанындай, Н + және ОН - иондарының концентрациялары бірдей, сондықтан диссоциация кезіндегі судың концентрациясы [Н 2 О] іс жүзінде тұрақты қалады. Демек, диссоциация тұрақтысының мәні де тұрақты күйде қалады:
Судың диссоциация дәрежесі өте кіші болғандықтан, судың диссоциацияланбай қалған молекулаларының тепе-теңдік концентрациясы
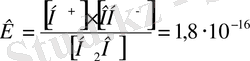
[Н
2
О] судың жалпы концентрациясына тең, яғни
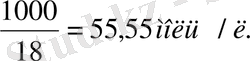
Онда К = [Н + ] [ОН - ] = К[Н 2 О] = 1, 8 · 10 -16 · 55, 55 = 1, 0 · 10 -14 = K w ,
мұндағы K w - судың иондық көбейтіндісі .
Таза судағы сутек иондары мен гидроксид-иондарының концентрациялары тең және 25°С кезінде [Н + ] = [ОН - ] = 10 -7 моль/л құрайды.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz