Газ заңдары және молекулалық-кинетикалық теорияның негізгі теңдеуі мен салдарлары


Қазақстан Республикасы
Ғылым және жоғарғы білім министірлігі
Академик Е. А. Бөкетов атындағы
Қарағанды университеті
Газ заңдары. Молекулалық-кинетикалық теориясының негізгі теңдеуі(МКТ) және одан шығатын салдары
Орындаған: Атапкеова Аяулым МиФ21-1
Қабылдаған: Гүлбақыт Төлеуғалиқызы
6В01502. 1 - Математика-физика
Білім беру бағдарламасы
Қарағанды
2024
Жоспар
Кіріспе
1. Газ заңдары
2. Газдардың кинетикалық теориясы
3. Газдардың сұйықтардың және денелердің құрылысындағы айырмашылық
4. Идеал газ күйінің теңдеуі
5. Термодинамиканың бірінші заңы
6. Термодинамиканың екінші заңы
7. Молекулалық физикалық тәсілдер
8. Молекула өлшемдері
9. Молекулярлық-Кинетикалық теориясы
10. Қорытынды
Пайдаланылған әдебиеттер
Кіріспе.
Молекулалық-кинетикалық теория (МКТ) бойынша барлық заттар ең кішкентай бөлшектерден - молекулалардан тұрады. Молекулалар үздіксіз қозғалыста болады және бір-бірімен әрекеттеседі.
МКТ көптеген тәжірибелермен және көптеген физикалық құбылыстармен дәлелденді. Оның негізгі үш нүктесін қарастырайық.
Мұнда газдардың, сұйықтықтардың және қатты денелердің құрылысы, олардың сыртқы әсерлердің (қысым, температура, электр және магнит өрістері) нәтижесінде өзгеруі, тасымалдау құбылысы
(диффузия, жылуөткізгіштік, ішкі үйкеліс), фазалық тепе-теңдік және ауысу процестері (кристалдану және балқу, булану және конденсация, т. б. ) заттардың кризистік күйі, әр түрлі фазалардың бөліну шекараларындағы беттік құбылыстар қарастырылады. 20 ғасырда молекулалық физиканың жедел қарқынмен дамуы нәтижесінде одан статистикалық физика, физ. кинетика, қатты денелер физикасы, физ. химия тәрізді ірі, өз алдына дербес салалар бөлініп шықты. Қазіргі ғылым мен техниканың жаңа заттар мен материалдарды кеңінен пайдалануының нәтижесінде заттар құрылысын зерттеудің сан алуан әдістері пайда болды. Заттардың және олардың зерттеу әдістерінің әр түрлі болуына қарамастан молекулалық физика заттар құрылысының микроскопиялық (молекулалық) сипатына негізделе отырып, олардың макроскопиялық қасиеттерін зерттейді.
1. Газ заңдары .
Параметрлерiнiң бiрiнiң шамасы өзгерiссiз өтетiн процестердi изопроцестер деп атайды. Газдың үшiншi параметрi тұрақты болған кездегi екi параметрi арасындағы мөлшерлiк байланысты (тәуелдiлiктi) газ заңдары деп атайды.
Температура тұрақты болған кезде термодинамикалық жүйе күйiнiң өзгеру процесiн изотермиялық процесс деп атайды.
2. Газдардың кинетикалық теориясы
Газдардың кинетикалық теориясы - теориялық физиканың газдардың молекулалық құрылысының және молекулалар арасындағы өзара әсерлесудің белгілі заңы туралы түсініктер негізінде газдардың қасиеттерін статистикалық әдістермен зерттейтін саласы. Әдетте газдардың кинетикалық теориясына газдардың тек тепе-теңсіздік қасиеттерінің теориясы ғана жатады, газдардың тепе-теңдік қасиеттерінің теориясы тепе-теңдік жүйелердің статистикалық физикасы аймағына тиесілі. Газдардың кинетикалық теориясының қолданылуының негізгі нысаны (объектісі) - газдар, газ қоспалары және плазма, бірақ та плазма теориялық физиканың дербес аймағына бөлініп шыққан. Газдың қалыпты жағдайдағы тығыздығы сұйықтың тығыздығынан мың еседей кем.
Сондықтан газ молекулаларының бір-бірінен қашықтығы олардың өздерінің өлшемдерінен ондаған есе үлкен. Сол себепті газды бір-бірінен алыс орналасқан молекулалардың жиыны деп есептеуге болады. Молекулалардың өзараәсерлесу күші (бір-бірімен соқтығысқан кездегіден басқа уақытта) өте аз болғандықтан, оны ескермеуге де болады. Молекулалары еркін және ретсіз қозғалатын, әрі өзараәсерлеспейтін материалдық нүктелер ретінде қарастырылатын газ - идеал газ деп аталады. Жылулық тепе-теңдік күйінде және бөгде күш әсер етпеген жағдайда, идеал газ молекулаларының кез келген бағыттағы қозғалу ықтималдығы бірдей. Мұндай газ молекулаларының жылдамдықтары Максвеллдік үлестірілу заңымен анықталады. Бұл заң бойынша әр молекуланың ілгерілемелі қозғалысының кинетикалық энергиясы ࣟ = 1/2mv2 = 3/2kT, мұндағы m - молекуланың массасы, v - оның орташа жылдамдығы, k - Больцман тұрақтысы, Т - абсолют температура. Идеал газ молекулаларының тек кинетикалық энергиясы ғана болатындықтан, мұндай газдардың ішкі энергиясы абсолют температураға тура пропорционал болады. Бұл қатынастан температура молекулалардың кинетикалық энергиясының мөлшері ретінде анықталады. Газдардың кинетикалық теориясы бойынша оның өзі тұрған ыдыс қабырғасына түсіретін қысымы ретінде, ыдыстың бірлік ауданына уақыт бірлігі ішінде соқтығысқан молекулалардың беретін қозғалыс мөлшерінің орташа мәні алынады. Идеал газдың қысымы: p = nkT, мұндағы n - көлем бірлігіндегі молекулалар саны. Газдың бір грамм-молекуласы (құрамында Авогадро санына тең NА = 6, 022045(31) ·1023 молекула бар) үшін мына теңдеу: рV = RT идеал газ күйінің негізгі теңдеуі немесе Клапейрон теңдеуі деп аталады. Мұндағы V = N/n бір моль газдың көлемі, R = k·N - әмбебап газ тұрақтысы. Бұл байланыс газдардың кинетикалық теориясы тұжырымдалмай тұрып эмпирикалық жолмен анықталған. Молекулалардың өзараәсерлесуі ескерілетін нақты газдар үшін Ван-дер-Ваальс теңдеуі тура. Газ көлеміндегі әртүрлі нүктелер арасында температураның немесе қысымның айырымы (градиенті) байқалса, газдың тепе-теңдік күйі бұзылады. Бұл жағдайда физикалық шама градиентінің бағытымен масса, энергия немесе қозғалыс мөлшері тасымалданады. Бұл үрдіс (процесс) физикалық шаманың мәні бүкіл газ көлемінде теңескенге дейін өтеді. Газдардың кинетикалық теориясы бойынша диффузия құбылысы кезінде масса, жылуөткізгіштік үрдісінде энергия, ал тұтқырлық нәтижесінде қозғалыс мөлшері тасымалданады. Тасымалдау үрдістері молекулалардың еркін жолының ұзындығына (λ) тығыз байланысты. Газ көлемінің өлшемі λ-дан үлкен болса, газдың тұтқырлығы мен жылуөткізгіштігі қысымға тәуелсіз болады. Керісінше, λ көлем өлшемінен үлкен болса (сиретілген газ), газдың жылу өткізгіштігі мен тұтқырлығы қысым төмендеген сайын кемиді. 183 Заттың ерекше күйі болып саналатын плазманың қасиеттері өзіне тән кинетикалық теңдеулер арқылы сипатталады. Бұл теңдеулерде кванттық эффектілер ескерілген.
3. Газдардың сұйықтардың және денелердің құрылысындағы айырмашылық.
Заттың әртүрлі агрегаттық күйлерінде оның молекулалары арасындағы қашықтық әртүрлі болады. Молекулалардың күштік әсерлесуіндегі айырмашылық және газдар, сұйықтар және қатты денелер молекулаларының қозғалысы табиғатындағы маңызды айырмашылық осыдан туындайды.
AT газдар молекулалар арасындағы қашықтық молекулалардың өздерінің өлшемдерінен бірнеше есе үлкен. Нәтижесінде газ молекулалары арасындағы әрекеттесу күштері аз және молекулалардың жылулық қозғалысының кинетикалық энергиясы олардың әрекеттесуінің потенциалдық энергиясынан әлдеқайда асып түседі. Әрбір молекула басқа молекулалардан үлкен жылдамдықпен (секундына жүздеген метр) еркін қозғалады, басқа молекулалармен соқтығысқан кезде бағыт пен жылдамдық модулін өзгертеді. Еркін жол ұзындығы λ газ молекулалары газдың қысымы мен температурасына байланысты. Қалыпты жағдайда λ ~ 10 -7 м.
AT қатты заттар молекулалар арасындағы әрекеттесу күштерінің үлкендігі сонша, молекулалар қозғалысының кинетикалық энергиясы олардың әрекеттесуінің потенциалдық энергиясынан әлдеқайда аз. Молекулалар белгілі бір тұрақты тепе-теңдік позициясы - кристалдық тордың түйіні айналасында шағын амплитудасы бар үздіксіз тербелістерді орындайды.
Бөлшектің бір тепе-теңдік жағдайының айналасында тербелетін уақыты, - бөлшектің «отырықшы өмірінің» уақыты - қатты денелерде өте үлкен. Сондықтан қатты заттар өздерінің пішінін сақтайды және олар қалыпты жағдайда ағып кетпейді. Молекуланың «отырықшы өмірінің» уақыты температураға байланысты. Балқу температурасына жақын жерде ол шамамен 10-1 - 10-3 с, төмен температурада сағаттар, күндер, айлар болуы мүмкін.
AT сұйықтықтар молекулалар арасындағы қашықтық газдарға қарағанда әлдеқайда аз және қатты денелердегідей шамамен бірдей. Сондықтан молекулалар арасындағы әсерлесу күштері үлкен. Сұйықтың молекулалары қатты дененің молекулалары сияқты белгілі бір тепе-теңдік орнында тербеледі. Бірақ бөлшектер қозғалысының кинетикалық энергиясы олардың өзара әрекеттесуінің потенциалдық энергиясына сәйкес келеді, ал молекулалар жаңа тепе-теңдік позицияларына жиі ауысады («отырықшы өмір» уақыты 10-10 - 10-12 с) . Бұл сұйықтықтың өтімділігін түсіндіруге көмектеседі.
АБСОЛЮТТЫ ТЕМПЕРАТУРА - термометриялық заттың қасиеттеріне тәуелсіз абсолютті термодинамикалық шкала бойынша өлшенетін температура. Абсолюттік нөлден бастап есептеледі. Бірлік А. т. SI Келвинде (К) .
АБСОЛЮТТЫ НӨЛ - температураның абсолютті анықтамалық нүктесі; судың үштік нүктесінің температурасынан 273, 16 К төмен, ол үшін 0, 01 o С мәні қабылданған. атомдар мен молекулалардың ілгерілемелі және айналмалы қозғалысы тоқтайды, бірақ олар тыныштықта емес, «нөлдік» тербеліс күйінде болады. Термодинамика заңдарынан А. н. іс жүзінде қол жетімсіз.
АВОГАДРО ЗАҢЫ - идеал газдардың негізгі заңдылықтарының бірі: бірдей температура мен қысымдағы әртүрлі газдардың бірдей көлемдерінде молекулалар саны бірдей болады. 1811 жылы итальяндықтар ашқан. физик А. Авогадро (1776-1856) .
АВОГАДРО тұрақты (сан) - заттың бірлік мөлшеріндегі бөлшектердің саны (1 мольде) : N A \u003d 6, 022. 10 23 моль -1 .
ЗАТТЫҢ АГРЕГАТТЫҚ КҮЙІ - бөлшектердің жылулық қозғалысының табиғаты бойынша ерекшеленетін бір заттың күйлері. Әдетте 3 ASW бар: газ, сұйық және қатты; кейде бұл жерде плазма күйі де айтылады. Кез келген А. С. -дағы зат. белгілі бір сыртқы жағдайларда (температура, қысым) бар, оның өзгеруі бір А. С. -дан ауысуға әкеледі. басқаға.
АДИАБАТИЯЛЫҚ (АДИАБАТАЛЫҚ) ПРОЦЕСС - қарастырылып отырған жүйе мен қоршаған орта арасында жылу алмасу болмайтын термодинамикалық процестің моделі. Нағыз термодинамикалық процесті A. деп санауға болады, егер ол не жылу оқшаулағыш қабықшада болса, не жылу алмасуға үлгермейтіндей тез жүрсе.
Кез келген термодинамикалық диаграммадағы тепе-теңдікті бейнелейтін сызық адиабаттық процесс. a теңдеуі. идеал газ үшін - адиабаталық көрсеткіш, және б және в тиісінше тұрақты қысым мен көлемдегі жылу сыйымдылығы.
АМОРФТЫ КҮЙ - молекулаларының орналасуы жоқ қатты дененің күйі. Сондықтан а. заттың изотропиясы бар, яғни. барлық бағытта бірдей физикалық қасиеттерге ие және белгілі бір балқу температурасы жоқ.
АНЕРОЙ - анероидты барометр, атмосфералық қысымды өлшеуге арналған құрылғы, оның қабылдау бөлігі металл қорап болып табылады, оның ішінде күшті вакуум жасалады. Банкомат ауыстырған кезде. қысым, қораптың деформациясы өзгереді, ол онымен байланысты серіппе және рычагтар жүйесінің көмегімен көрсеткі көрсеткішінің бұрылуын тудырады.
АНИЗОТРОПИЯ - материяның физикалық қасиеттерінің бағытқа тәуелділігі (қарсы изотропия ) . Ол орталардың ішкі реттелген құрылымымен байланысты және қатты денелерде серпімділік, жылу және электр өткізгіштік, дыбыс пен жарықтың таралуы құбылыстарында кездеседі. Ол электромагниттік, гравитациялық және басқа өрістердің қатысуымен физикалық кеңістікке де тән болуы мүмкін.
АТМОСФЕРАЛЫҚ ҚЫСЫМ Жер атмосферасының ондағы барлық заттарға түсіретін қысымы. Ол ауаның үстіңгі бағанының салмағымен анықталады және жер атмосферасының күйін сипаттайтын ең маңызды шама болып табылады. Бірліктер A. d. SI-де - Па, мм рт. ст. Қалыпты А. д. 760 мм сын. бағ. тең. немесе 1013 гПа.
БАРОМЕТР - атмосфералық қысымды өлшеуге арналған құрылғы. Ең көп таралған деформация B., ол, мысалы, B. қамтиды - анероид (1844, Л. Види) . Мұндай Б. -да атмосфералық қысым өзгерген кезде мембрана салбырап, ауа шығарылатын қорапты жауып, бұл жағдайда рычагтар жүйесі арқылы мембранаға қосылған жебе ауытқиды. Әрекет сұйықтық B. (мысалы, сынап B. E. Torricelli, 1644) сұйық бағанның салмағымен атмосфералық қысым сиалін теңестіруге негізделген.
ҚЫСҚА ТАПСЫРЫС - атом аралық жақын арақашықтықта атомдардың немесе молекулалардың реттелген орналасуы; аморфты заттар мен кейбір сұйықтықтарға тән. (қараңыз. ) .
БОЙЛ-МАРИОТТ ЗАҢЫ - заңдардың бірі идеал газ: тұрақты температурада берілген газдың берілген массасы үшін қысым мен көлемнің көбейтіндісі тұрақты болады. Формула: pV=const . Изотермиялық процесті сипаттайды.
Әмбебаптың қатынасына тең негізгі физикалық тұрақтылардың бірі газ тұрақтысы R - N A . B. p. . Статистикалық физиканың бірқатар маңызды қатынастарына кіреді: байланыстырады қараңыз. бөлшектердің кинетикалық энергиясы және температура, физикалық жүйенің энтропиясы және оның термодинамикалық ықтималдығы.
Браундық қозғалыс - молекулалардың жылулық қозғалысының әсерінен болатын сұйықта немесе газда ілінген ұсақ макроскопиялық бөлшектердің кездейсоқ қозғалысы. Молекулярлық-кинетикалық теорияны көрнекі түрде растау. 1827 жылы Р. Браун ашты. 1905 жылы А. Эйнштейн мен М. Смолуховский түсіндірді. Теория 1906-11 ж. ж. Дж. Перриннің тәжірибелерінде тексерілді.
ВАКУМ - қысымы атмосфералық қысымнан айтарлықтай төмен болатын ыдысқа салынған газдың күйі. Атомдардың немесе молекулалардың еркін жолы мен тамырдың сызықтық өлшемі арасындағы қатынасқа байланысты ультра жоғары, жоғары, орташа және төмен вакуум бөлінеді.
АУАНЫҢ ЫЛҒАЛДЫЛЫҒЫ - ауада су буының болуы. Физикалық шамалар арқылы сипатталады абсолютті және туыс AT . , олар өлшенеді гигрометрлер.
ІШКІ ЭНЕРГИЯ - дененің тек ішкі күйіне байланысты энергиясы; атомдардың, молекулалардың немесе басқа бөлшектердің кездейсоқ (жылу) қозғалысының энергиясынан және атом ішілік және молекула аралық қозғалыстар мен әсерлесулердің энергиясынан тұрады. (См. термодинамиканың бірінші заңы ) . МКТ-да атомішілік бөлшектердің энергиясы және олардың өзара әрекеттесулері есепке алынбайды.
4. Идеал газ күйінің теңдеуі. Менделеев-Клайперон теңдеуі
Идеал газ дегеніміз- молекулалары шексіз аз көлем алатын серпімді шариктер болып табылатын және өзара әрекеттесуі тек олардың бір-бірімен тікелей немесе ыдыстың қабырғасымен соқтығысуы кезінде ғана білінетін газ болып табылады.
1 2 р =3 nm0υ Идеал газдың ыдыс қабырғасына түсіретін қысымы:
1 2 р = ρυ немесе 3 - Бұл теңдеу МКТ-ның негізгі теңдеуі деп аталады.
Себебі:1) Ол макро және микродүниелерді байланыстырып тұр;
Тәжірибе арқылы алынған барлық газ заңдарын теориялық жолмен алуға мүмкіндік береді;
Ол микроәлемде өтіп жатқан процестер жайлы ақпарат береді.
m 0 υ 2
W k = 2
Мұндағы молекуланың орташа кинетикалық энергиясы :
22
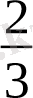 p
=
nm0υ
2=
n m
0
υ
2
nW
k
р
=
2
3
nWk
.
p
=
nm0υ
2=
n m
0
υ
2
nW
k
р
=
2
3
nWk
.
 2
= 3 . Олай болса:
2
= 3 . Олай болса:
3. МКТ-ның негізгі теңдеулерінің тағы бір түрін тәжірибе арқылы қарастыру керек.
N 2 pV 2
Молекулалар шоғыры: n= V , осыдан: 3 k → N =3 Wk . pV = NW
pV
Мұндағы молекулалар саны мен көлемінің өзгеруіне қарай N барлық газдар үшін тұрақты температурада бірдей болатынынан тәжірибе көрсетеді.
00С-да p 0 NV 0 θ 0 3 , 76∗10 −21 Дж К , ал 100 0 С-та pV N = θ 100=5 , 14∗10−21 Дж К
= =
θ = κΤ , θ-энергетикалық температура; өлшем бірлігі Джоуль.
θ₁ ₒₒ −θₒ=k(Т₂−Т₁)
k= θ Т ₁ ₂ ₒ − − Т θ ₁ ₀ = 5, 14 100 −3, 76 · 10−21 Дж̸ К =1, 38 · 10−23 Дж ̸ К
k= 1, 38 · 10 −23 Дж̸ К коэффициенті Больцман тұрақтысы деп аталады.
Больцман тұрақтысы энергетикалық температураны Кельвинмен өлшенетін абсолют температурамен байланыстырады.
pV pV 2 = κΤ = W k
N , N 3, болса
3
W
k =2 κΤ - газ молекулаларының хаосты қозғалысының
орташа кинетикалық энергиясы абсолют температураға пропорционал
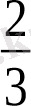 р
=
nW
k
k Т
р
=
nW
k
k Т
2
3
=3n2 =nkТ
N
р=n k Т = V kТ -бірдей температура мен қысым кезінде газдың тең көлемдеріндегі молекулалар саны бірдей болады . Бұл Авогадро заңы .
k
nW
р
3
2
МКТ-ның негізгі теңдеуі
2
3
1
р
р=nkT
Ол классикалық идеал газ және кванттық идеал газ болып ажыратылады. Классикалық идеал газдың қасиеттері классикалық физика заңдарымен - Клапейрон теңдеуімен, сондай-ақ оның дербес түрлері Бойль- Мариотт заңы және Гей-Люссак заңымен сипатталады. Классикалық идеал газ бөлшектерінің энергиясы Больцман үлестірілуіне сәйкес болып үлестіріледі. Жеткілікті дәрежеде сиретілген реал газдар классикалық идеал газдың моделімен жақсы түсіндіріледі.
Менделеев-Клайперон теңдеуі
Газдың қандай күйде тұрғанын білу үшін оның термодинамикалық параметрлерін, яғни қысымды, температураны, көлемді білу қажет. Термопараметрлердің біреуінің өзгерісі оның басқа параметрлерінің өзгеруіне әкеп соғады. Бұл параметрлерді байланыстыратын теңдеу газ күйінің теңдеуі деп аталады. Осы теңдеуді молекулалы-кинетикалық теорияның негізгі теңдеуін пайдалана отырып, шығарып көрейік. Бізге p = nkТ екені белгілі. Газ молекулаларының концентрациясын n = N/V ескеріп, p = NkT/ V аламыз. Осыдан pV = NkT шығады. Универсал газ тұрақтысы дегеніміз - заттың 1 молінің температурасын 1К-ге арттыру үшін оған қанша жылу мөлшерін беру қажет екенін көрсететін физикалық шама. Бұл универсал газ тұрақтысының физикалық мағынасы. Осы айтылғандарды ескерсек, онда идеал газ үшін мына теңдеу орындалады:Бұл идеал газ күйінің теңдеуі деп аталады. Осы түрде бұл теңдеуді тұңғыш рет ұлы орыс ғалымы Д. И. Менделеев алған, сондықтын ол Менделеев-Клайперон теңдеуі деп аталады. 10 жылдай Ресейде қызмет еткен, атақты француз физигі, Б. П. Клайперон идеал газ күйінің теңдеуін Менделеевтен бұрын ( 1834 ж. ) алды. Идеал газ күйінің теңдеуі физикадағы алғашқы тамаша жалпылау теңдеуі. Ол тәжірибеде тағайындалған бірқатар газ заңдарын жалпылайды. Қандай затты алғанымызға тәуелсіз болатын жалпыланған заңдарды ашу физика ғылымының мақсаты.
Газдың қандай күйде тұрғанын білу үшін оның термодинамикалық параметрлерін, яғни қысымды, температураны, көлемді білу қажет. Термопараметрлердің біреуінің өзгерісі оның басқа параметрлерінің өзгеруіне әкеп соғады. Бұл параметрлерді байланыстыратын теңдеу газ күйінің теңдеуі деп аталады. Осы теңдеуді молекулалы-кинетикалық теорияның негізгі теңдеуін пайдалана отырып, шығарып көрейік. Бізге p = nkТ екені белгілі. Газ молекулаларының концентрациясын n = N/V ескеріп, p = NkT/ V аламыз. Осыдан pV = NkT шығады. Газ молекулаларының санын газдың зат мөлшері арқылы табамыз: N = v . Осыны ескерсек,
pV
Екі тұрақты санның - Авагадро санының және Больцман тұрақтысының көбейтіндісіне тең шаманың өзі де тұрақты шама. Оны универсал газ тұрақтысы деп атайды:
R
R = 1, 38 ˑ 10-23 Дж/K ˑ 6, 02 ˑ 1023 1/моль = 8, 31 Дж/ K ˑ моль.
Универсал газ тұрақтысы дегеніміз - заттың 1 молінің температурасын 1К-ге арттыру үшін оған қанша жылу мөлшерін беру қажет екенін көрсететін физикалық шама. Бұл универсал газ тұрақтысының физикалық мағынасы. Осы айтылғандарды ескерсек, онда идеал газ үшін мына теңдеу орындалады:
pV RT
Бұл идеал газ күйінің теңдеуі деп аталады. Осы түрде бұл теңдеуді тұңғыш рет ұлы орыс ғалымы Д. И. Менделеев алған, сондықтын ол Менделеев-Клайперон теңдеуі деп аталады. 10 жылдай Ресейде қызмет еткен, атақты француз физигі, Б. П. Клайперон идеал газ күйінің теңдеуін Менделеевтен бұрын ( 1834 ж. ) алды. Идеал газ күйінің теңдеуі физикадағы алғашқы тамаша жалпылау теңдеуі. Ол тәжірибеде тағайындалған бірқатар газ заңдарын жалпылайды. Қандай затты алғанымызға тәуелсіз болатын жалпыланған заңдарды ашу - физика ғылымының мақсаты.
Изохоралық процесс кезiнде газдың көлемі тұрақты және iшкi энергиясының өзгерiсi оған берiлген жылу мөлшерiне тең. Газдың белгiлi бiр тұрақты көлемінде, жылу алған кездегi және жылу берген кездегi газдың жасаған жұмысы қандай болатындығын бақылаңыздар
Изохоралық процесс. Бұл процесте газ көлемi өзгермейдi: V = const . Газдың iшкi энергиясының өзгерiсi оған берiлген жылу мөлшерiне тең: ΔU = Q . Егер газ қыздырылса, онда Q > 0 және ΔU > 0 - iшкi энергия ұлғаяды. Газды суытқан кезде: Q < 0 және ΔU < 0, оның ішкі энергиясы азаяды. Изохоралық процессті көлемі өзгермейтін герметикалық (тұмшаланған) ыдыстағы газдар мен сұйықтықтарда жүзеге асыруға болады. Дене көлемінің өзгеруіне ішкі энергиясының өзгеруі жылудың жұтылуы не шығуы есебінен атқарылады. Температураның өзгеруіне байланысты газдың (сұйықтықтың) қысымы да өзгереді. Изохоралық процесс кезінде идеал газдың қысымы температураға пропорционал (Шарль заңы) болады. Нақты (идеал емес) газда Шарль заңы орындалмайды. Өйткені газға берілген жылудың белгілі бір бөлігі бөлшектердің өзара әсерлесу энергиясын арттыруға жұмсалады. Ал қатты денедегі изохоралық процессті атқару техникалық жағынан едәуір күрделі болып келеді. Сығылғыштығы өте аз қатты денедегі кез келген изотермалық процесті, бірнеше ондаған килобар қысымға дейін, изохоралық процесс деп есептеуге болады
Изотермалық процесс кезiнде газдың температурасы тұрақты және iшкi энергиясы өзгермейдi. Газға берiлген барлық жылу мөлшерi пайдалы жұмыс жасауға жұмсалады. Газдың белгiлi бiр тұрақты температурасында, жылу алған кездегi және жылу берген кездегi газдың жасаған жұмысы қандай болатындығын бақылаңыздар.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz
