Химиялық байланыстың табиғаты және комплексті қосылыстардың теориясы мен медицинадағы биологиялық маңызы



РЕФЕРАТ
Боөж-1
Тақырыбы: Химиялық байланыстың табиғаты. Комплексті қосылыстар. Комплексті қосылыстардың - биологиялық рөлі.
Орындаған: Шегебай Нұржан Балғабайұлы
Факультет: Медицина
Қабылдаған: Нугманова А. А.
Пән: Медициналық химия
Алматы қаласы, 2024 ж.
Жоспары:Кіріспе, негізгі бөлім, қорытынды
ЖОСПАР
КІРІСПЕ:
1. Химиялық байланыс. 3
НЕГІЗГІ БӨЛІМ:
2. Комплексті қосылыстар туралы түсінік. Координациялық теория . . . 4
3. Комплексті қосылыстардың номенклатурасы . . . 6
4. Комплексті қосылыстардың классификациясы. 7
5. Комплексті қосылыстардың тұрақсыздық константасы . . . 8
6. Комплексті қосылыстардағы химиялық байланыстардың табиғаты………. . 9
7. Кристалдық өріс теориясы10
8. Молекулалық орбитальдар теориясы . . . 11
9. Комплексті қосылыстардың биологиялық маңызы және медицинада қолданылуы12
ҚОРЫТЫНДЫ14
ПАЙДАЛАНЫЛҒАН ӘДЕБИЕТТЕР. . 15
КІРІСПЕ:
Химиялық байланыстар:
Химиялық байланыстар - химиялық элементтер арасындағы тұрақты тепе-тең күйдегі жүйе жасауға келіп тірелетін (молекула, ион, радикал) электромагниттік әсерлесу жиынтығы. Кванттық механика көзқарасы тұрғысынан химиялық байланыс валенттілік сұлба және молекулалық орбиталдар әдісімен түсіндіріледі. Химиялық байланыс түзілуіне қарай төртке бөлінеді:
- иондық
- коваленттік
- металдық
- сутектік
Иондық химиялық байланыс электр терістілігі бойынша айырмашылығы үлкен металл мен бейметалл атомдары арасында түзіледі. Химиялық әрекеттескенде валенттік электрондарын беріп, оң зарядты иондарға (катиондарға) : К־-е-К+ бейметалл атомдары электрондар қосып алып, теріс зарядты иондарға (аниондарға) айналады: Cl+е-Cl־. Әр аттас зарядты иондар бірін-бірі тартып молекула құрайды: K+ + Cl ־= KCl. Иондық Химиялық байланыс қарама-қарсы зарядталған иондардың электрстатикалық тартылысы нәтижесінде жүзеге асады. Иондар түзілу арқылы жүзеге асатын байланыстарды иондық байланыс, қосылыстың өзін иондық қосылыс деп атайды. Иондық қосылыстардың қайнау, балқу температурасы жоғары, қызуға тұрақты, олар полюстік еріткіштерде тез ериді, ерітінділері электр тогын жақсы өткізеді.
Коваленттік химиялық байланыста әрекеттесуші атомдарға ортақ электрондар жұбы пайда болып, олардың санына қарай бір немесе бірнеше еселенген байланыстар түзіледі. Мысалы, сутек молекуласында атомдары арасында бір (Н:Н), оттек молекуласында екі (:О::О:), азот молекуласында үш (:N:::N:) еселенген ковалентті химиялық байланыстар бар. Яғни коваленттік байланыс байланыс түзетін атомдар арасында ортақ электрон бұлтының түзілуінен пайда болады. Бұл теорияны Г. Н. Льюис 1916 ж. ұсынған. Ортақ электрон бұлтының түзілуінің екі тәсілі бар: 1. Әрбір атомның сыртқы валенттік электрондарының электрон бұлттарының қабысуы арқылы; 2. Бір атомның дайын электрон жұбы екінші атомның бос орбиталіне көшіп орналасуы арқылы. Коваленттік химиялық байланыстар электрон жұбының атомдардың арасында орналасуына қарай полюсті және полюссіз деп екіге бөлінеді.
Полюсті молекулада химиялық байланыс түзетін ортақ электрондар электр терістілігі күшті атомға қарай ығыса орналасады. Коваленттік полюсті байланыс электр терістілігінің (ЭТ) айырмашылығы бар бейметалдар арасында түзіледі. Молекула полярланады (полюстенеді) . Мысалы, судың молекуласы - диполь. Молекуланың полюстілігі диполь моменті арқылы көрсетіледі. Полюстік молекулалардың қайнау және балқу температурасы төмен, полюсті еріткіштерде үйектеліп иондарға ыдырайды. Иондық байланысты коваленттік полюстік байланыстың шегіне жеткен түрі деп қарастыруға болады.
Полюссіз ковалентті химиялық байланысты молекулада электрон жұбы атомға ауыспай, симметриялы түрде ортада орналасқан. Полюссіз ковалентті байланыс - бейметалл атомдарынан тұратын жай заттардың молекуласында кездесетін байланыс. Мысалы, оттек (О2), сутек (Н2), азот (N2), хлор (СІ2) т. б. Полюссіз химиялық байланыстағы қосылыстардың қайнау және балқу температуралары төмен, полюсті еріткіштерде иондар түзбейді, электр тоғын өткізбейді. Бөлінбеген электрон жұбы мен электронсыз бос орбиталі бар атомдардан донорлық-акцепторлық механизм бойынша коваленттік байланыс түзіледі. Мысалы, аммоний катионы мен гидроксоний ионының түзілуі. Осындай механизм бойынша түзілген химиялық байланыстар координациялық байланыс деп те аталады. Сутектік химиялық байланыс - екі молекуладағы немесе бір молекуладағы атомдар арасында сутек атомының оң заряды арқылы түзіледі. Ол молекула аралық және молекула ішілік сутектік байланыс деп жіктеледі.
Металдық химиялық байланыс - металл атомдарының сыртқы қабатындағы бос электрондар қатысуымен түзілетін байланыс. Химиялық байланыстар сыртқы валенттік электрондар арқылы жүзеге асады.
Сутектік байланыс оң зарядты полюстікке ие болған сутек атомы мен теріс полюсті, электртерістігі күшті, бөлінбеген электрон жұбы бар (көбіне F, О, N, кейде CI, S) атомдар арасында түзіледі. Сондықтан сутектік байланыстың механизмін жартылай электростатикалық, жартылай донорлы-акцепторлы деп қарастыруға болады.
НЕГІЗГІ БӨЛІМ:
Комплексті қосылыстар туралы түсінік. Координациялық теория:
Химия басталғаннан бері қосылыстарда атомдар иондық, коваленттік, металдық және донорлы-акцепторлы байланыстар арқылы қосылған. Бұл қосылыстарды бірінші ретті қосылыстар деп атайды. Осындай қосылыстар бір-бірімен өзара әрекеттескенде, комплексты қосылыстар деп аталатын жоғары ретті қосылыстар түзіледі. Кешенді қосылыстар немесе координациялық қосылыстар - жай химиялық қосылыстардың әрекеттесуі нәтижесінде түзілетін құрамы күрделі химиялық қосылыстар. Комплекстті қосылыстар деп кристалда да, ерітінді де құрамында комплексті ионы болатын жоғарғы ретті қосылыстар болып табылады. Химиядық байланыс теориясы бойынша, «Комплексті қосылыстар дегеніміз - құрамында бір немесе бірнеше донорлы-акцепторлы байланыс болатын жоғарғы ретті қосылыстар». Кешенді қосылыстарға кристаллогидраттар CuSO4·5H2O, аммиактар CaSO4·4NH3, ашутас KAl(SO4) 2·12H2O, т. б. күрделі қосылыстар жатады Кешенді қосылыстарда орталық орын алып тұрған ион немесе атом кешентүзуші деп, ал оның айналасына жиналған, яғни координацияланған иондарды немесе молекулаларды лигандалар деп атайды. Кешен түзушінің айналасына координациаланған лигандалардың жалпы саны оның координациялық саны деп аталады. Кешентүзуші ион және лиганд ішкі сфераны құрайды, оны кешенді ион немесе кешен деп атайды. Координациялық сан немесе валенттілік ол орталық кешентүзуші ионнның айналасына координацияланатын лигандтар саны. Кешенді ионның заряды сыртқы иондар зарядының қосындысына тең, бірақ мәні кері болады. Кешен түзушінің зарядын табу үшін Кешенді қосылыстардың құрамына кіретін басқа иондардың барлығының зарядының алгебралық қосындысын шығарып, оған теріс мән қояды. 1893 жылы Швейцария ғалымы Вернер комплексті қосылыстардың құрылысы мен қасиетін түсіндіретін координациялық теория ұсынды. Альфред Вернер кез келген элемент өзінің әдеттегі валенттілігін толық қанықтырған соң да, тағы да қосымша координациялық валенттілік көрсетуге қабілетті болып келеді деген пікірді білдірді. Нақ осы координациялық валенттілік есебінен кешенді қосылыс түзіледі. Ал Вернер теориясы бойынша әрбір кешенді қосылыстағы ішкі және сыртқы сфера ажыратылады. Кешенді қосылыстар туралы түсініктің негізін Швейцария химигі Альфред Вернер ұсынса, мұны тұрақтандыра отырып, сәтті дамытуға Л. А. Чугаевтің, А. А. Гринбергтің, В. В. Лебединскийдің және т. б жұмыстары үлкен рөл атқарды.
Негізгі қағидалары:
1. Комплексті қосылыстағы басты орын комплекс түзушінің үлесіне тиеді. Комплекс түзуші көбінесе оң зарядты металл иондары болады.
2. Комплекс түзушінің маңайына теріс зарядталған аниондар немесе электр нейтрал молекулалар - лигандалар жиналады.
3. Комплекс түзушінің маңайына орналасқан лигандалардың жалпы саны комплекс түзушінің координациялық саны (к. с. ) болып табылады.
4. Комплекс түзушімен лигандалар - комплекс қосылысының ішкі сферасы.
5. Ішкі сфераға сыймай қалған иондар - комплексті қосылыстың сыртқы сферасы. Мысалы: [Cu(NH3) 4] SO4
Cu2+- комплекс түзуші, NH3 - лиганда, к. с. = 4.
[Cu(NH3) 4] 2+ - ішкі сфера, SO4 2- сыртқы сфера
Негізгі комплекс түзушілерге Д. И. Менделеевтің периодтық жүйесінің d-элементтері жатады. Комплекс түзушілердің координациялық саны тотығу дәрежесіне тәуелді.
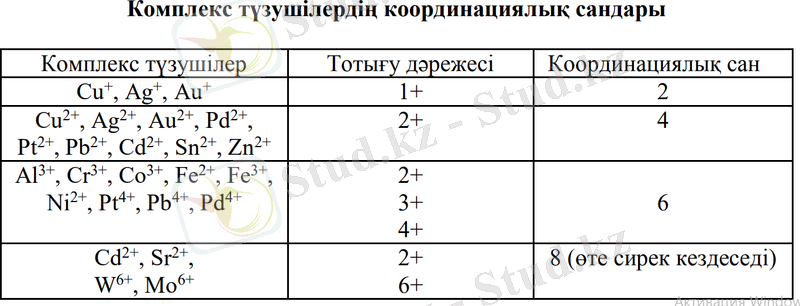
Маңызды лигандалар:
1) полюсті молекулалар: H2O, NH3, CO, NO, NH2OH
2) иондар: F-, Cl-, Br-, І-, O2-, OH-, CN-, CNS-, S2O3 2-, CO3 2-, C2O4 2-
Полюсті молекулалар Кешенді қосылыстардың сыртқы сферасында аниондар немесе катиондар болуы кешен ионының зарядына байланысты. Егер қосылыстағы кешен ионының заряды оң болса, сыртқы сферада аниондар орналасады, ал кешен ионының заряды теріс болса, сыртқы сферада катиондар орналасады. Комплексті қосылыстың формуласын құрастыру Комплексті қосылыстың формуласын құрастыру үшін комплекс түзушінің координациялық санын, оның зарядын, лигандалардың зарядтарын, сыртқы сфераның зарядын анықтау керек. Мысалы: Fe2+ - комплекс түзуші, CN- лиганда, К+ - сыртқы сфера. Fe2+- ионының координациялық саны - 6, сондықтан 69 Fe(CN) 6 деп жазамыз, (CN) - ионының заряды (-1), сондықтан комплекс ионының заряды [Fe(CN) 6] 4- . Молекула нейтрал болу керек. Cонда комплексті қосылыстың формуласы: К4[Fe(CN6) ] .
Комплексті қосылыстардың номенклатурасы:
Құрамында комплекс катионы бар қосылыстардың жүйеленген түрде аталуы
былай құрастырылады. Ең бірінші қышқылдық қалдық лигандалар аталады, олардың саны грек тілінде көрсетіледі. 2-ди, 3-три, 4-тетра, 5-пента, 6-гекса, 7-гепта, 8-окта. Қышқылдық қалдыққа «о» жұрнағы қосылады. Br-- бромо, Cl-- хлоро, F - фторо, O2- оксо, N3- нитридо, OH- гидроксо, CN- циано, CO3 2- карбонато, PO4 3- фосфато, S2O3 2- тиосульфато, C2O4 2- оксалато. Бұлардан кейін электронейтрал молекулалар айтылады: C6H6 - бензол, C2H4 - этилен, N2H4 - гидразин, H2O - аква, NH3 - аммин, NO - нитрозил, CO - карбонил, CS - тиокарбонил. Ішкі сферадағы лигандаларды атағаннан кейін, комплекс түзуші атау септігінде аталады, рим санымен заряды көрсетіледі, ең соңында сыртқы сферадағы анионға і әрпі қосылып айтылады. Мысалы, [Ag(NH3) 2] Cl - диаммин күміс (І) хлориді, [Al(H2O) 5OH] SO4 - (ІІІ) сульфаты Құрамында комплекс анионы бар қосылыс былай аталады: алдымен сыртқы сфера атау септігінде аталады. Осыдан кейін ішкі сфераны бұрынғы ретпен атап, комплекс түзушіге «аты» деген жұрнақ қосып, соңынан жақша ішінде оның тотығу дәрежесін көрсетеді. K[Ag(CN) 2] - калий дицианоаргентаты (І) Na3 [CO(NO2) 6] - натрий гексанитрокобальтаты (ІІІ) Сыртқы сфера жоқ қосылыстардың аталуының мысалы: Cr(C6H6) 2 - дибензолхром.
Комплексті қосылыстардың классификациясы:
- Лигандалар типіне қарай:
а) аквакомплекстер: бұл қосылыстарда лиганда болып су молекулалары қызмет атқарады. Мысалы, [Al(H2O) 6] Cl3, (лиганда - H2O) ; 70 б) аммиакаттар: бұл қосылыстарда лиганда болып аммиак молекулалары қызмет атқарады. Мысалы, [Сr(NH3) 6] Cl3, (лиганда - NH3) ; в) карбонилдер: бұл қосылыстарда лиганда болып көміртек оксиді молекулалары қызмет атқарады. Мысалы, [Fe(CO) 5], (лиганда - CO) ; г) ацидокомплекстер: бұл қосылыстарда лиганда болып қышқылдық қалдықтар қызмет атқарады. Мысалы, К4[Pd(CN) 6], (лиганда - НCN қышқылының анионы) . Бұлар бір ядролы комплекстер, бұл қосылыстарда лигандалар бір орын алады.
2. Циклді комплексті қосылыстар. Мұндай қосылыста лигандалар екі немесе одан да көп орын алады. Комплекс түзуші лигандамен әрі ковалентті, әрі донорлы-акцепторлы байланыс арқылы қосылады.
1905 жылы Чугаев мынадай циклді комплекс ашқан:
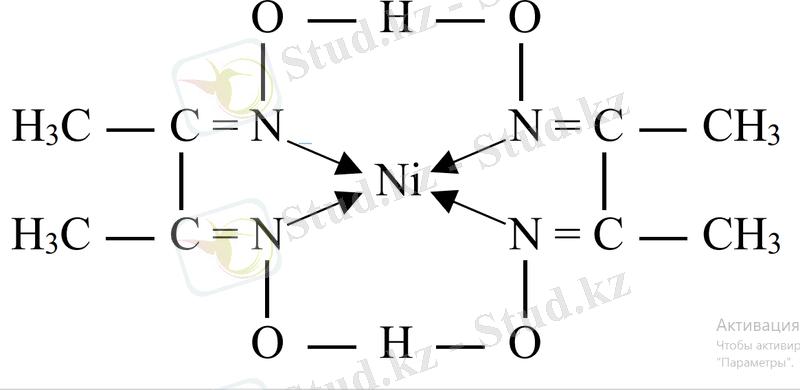
Никель (ІІ) диметилглиоксиматы - қызыл түсті төрт циклді комплекс. Бұл қосылыста екі ковалентті, екі донорлы-акцепторлы байланыс және сутекті байланыстар бар. Бұл комплекс никельді анықтауға қолданылады. Циклді комплекстер хелатты комплекстер деп те аталады. Бұлар көп дентантты комплекстер. Хелатты комплекстерге хлорофилл және гемоглобин жатады. Хлорофилде комплекс түзуші - Mg, (комплекс жасыл), ал гемоглобинде - Fe (комплекс қызыл) .
Хлорофилл
Хлорофилл гемоглобин сияқты комплекс қосылыстардың биологиялық процестерде маңызы өте зор. Гемоглобин - қан құ- 71 рамындағы негізгі қосылыс болса, хлорофилл - өсімдіктердің негізгі құрамдас бөлігі. Комплексті қосылыстардың тағы бір түрі - көп ядролы комплекстер: мысалы, H4SіO4 . 12WO3 . nH2O. Сонымен қатар изополиқышқылдар: мысалы, H2Cr2O7
Комплексті қосылыстардың тұрақсыздық константасы:
Комплексті қосылыстар сулы ерітіндіде сыртқы және ішкі сфераларға диссоциацияланады. Мысалы, [Ag(NH3) 2] Cl → → [Ag(NH3 ) 2] + + Cl- . Түзілген комплекс иондар аз мөлшерде тағы диссоциацияланады:
[Ag(NH3 ) 2] + → Ag+ + 2NH3
Бұл - қайтымды процесс, сондықтан әсер етуші массалар заңы бойынша диссоциациялану константасы былай жазылады:
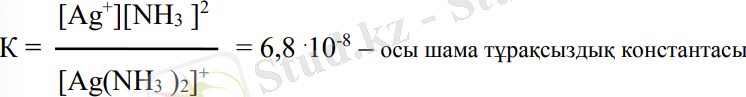
Ктұрақсыздық шамасына керісінше шаманы тұрақтылық константасы дейді. Ктұрақтылық = 1/Ктұрақсыздық. Ктұрақтылық неғұрлым үлкен болса, комплекс соғұрлым тұрақты болады.
Комплексті қосылыстардағы химиялық байланыстардың табиғаты:
Комплексті қосылыстардағы химиялық байланыстардың табиғатын, түзілу механизмдерін валенттік байланыс әдісімен, молекулалық орбитальдар теориясымен және кристалдық өріс теориясымен түсіндіреді. Осы әдістерді қарастырайық.
Валенттік байланыс әдісі.
Негізгі түсініктері:
а) комплекс түзуші мен лигандалардың арасындағы байланыс донорлы-акцепторлы болады. Байланыстың түзілуін лигандалардың электрон қосақтары, ал комплекс түзушінің орбиталі қамтамасыз етеді. Демек, лигандалар донор қызметін, ал комплекс түзуші акцептор қызметін атқарады; б) комплекс түзушінің орбитальдары алдымен гибридтенеді, содан кейін лигандалардың орбитальдарымен бүркеседі. Гибридтену типтері лигандалардың сандарына, табиғатына электрондық құрылымына байланысты; в) комплекс түзушінің геометриялық формасы орбитальдардың гибридтену типіне тікелей байланысты; г) комплекс қосылыстардың магниттік қасиеттері электрондардың бір ұяшықтағы санына тікелей байланысты. Егер комплекс қосылыстың электрондық конфигурациясындағы ұяшықтарда дара электрондар болса - қосылыс парамагнитті, яғни магнитке тартылады, ал дара электрон жоқ болса, қосылыс диамагнитті (магнит өрісінде тартылмайды) болып табылады. Мысал үшін [NH4] + - ионын қарастырайық. Бұл комплексті ионда азот атомының электрондық конфигурациясы былай өрнектеледі:
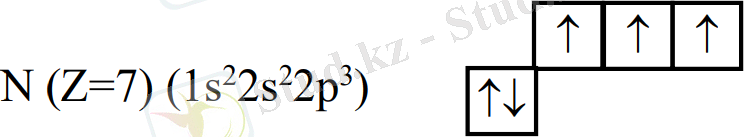
NН3молекуласында азот атомы 3 жалқы электрон арқылы сутектің 3 атомымен 3 ковалентті байланыс түзіп тұр. Ал азот атомының 1s орбиталіндегі 2 электрон тағы да 1 сутек ионымен байланысып тұр, тек бұл кезде азот 2 электрон арқылы, ал сутек бос орбиталь арқылы байланыс түзіп тұр. Демек, [NH4] + ионында 3 ковалентті байланыс, 1 донорлы-акцепторлы байланыс байқалады. Гибридтену типі - sр3 .
Кристалдық өріс теориясы:
Бұл теорияны 1929 ж. Бетэ ұсынды. Негізгі түсініктері: а) комплекс түзуші мен лигандалардың арасындағы байланыс иондық немесе ионды-дипольдік болып табылады; б) байланыс түзілгенде лигандалардың электростатикалық өрісінің әсері ескеріледі; в) бір ядролы комплекс түзуші үшін d-орбитальдар мынадай болады: dz2, dx2 -y 2, dxy, dxz, dyz; г) бос атомда немесе ионда барлық d-орбитальдар бірдей болады (энергия бірдей) . Ал осы атом лигандалардың арасына түссе, d-орбитальдардың энергиялары әртүрлі болады. д) октаэдрлік қоршауда:

dγ және dɛ орбитальдарының арасындағы энергияның айырымы ∆ - ажырау энергиясы; е) егер лигандалар күшті өріс туғызса, ∆ (ажырау энергиясының) мәні жоғары болады. Өрісінің күшіне қарай лигандалар мынадай қатарға орналасады:
СN- > NO3 - > ЭД > NH3 >NCS- >H2O > F-> CO- >OH->Cl-> Br->І
Бұл қатар - спектроскопиялық қатар болып табылады.
Төменгі және жоғары спинді комплекстер:
Кристалдық өріс теориясы комплекстердің магниттік қасиетін және түстерінің әртүрлігін түсіндіреді.
Мысалы, әлсіз өрісте: Co3+ (3d6 )
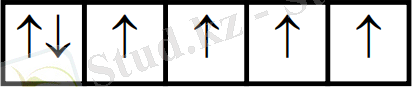
[CoF6] 3- бұл комплексті ионда ∆ (ажырау энергиясының мәні төмен), сондықтан электрондар бір-бірден орналасады

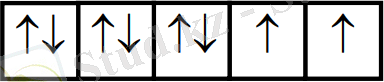
Ал келесі комплексті ионда: [Co(NH3) 6] 3+ - күшті өріс. Күшті өрісте ∆ жоғары, сондықтан электрондар төменгі орбитальдарға орналасады,

Комплекстің түсі
Егер комплексте d-электронды төменгі орбитальдан жоғары орбитальға ауыстыратын энергия жарық квантының энергиясына (E = hν) сәйкес болса, комплекс түсті болады.
Молекулалық орбитальдар теориясы:
Бұл теория комплекс түзуші мен лигандалардың электрондық құрылымын толық есепке алып, комплекс осы бөлшектердің ядролары мен электрондарынан тұратын тұтас система деп қарайды. Комплекс қосылыстардағы молекулалық орбитальдардың түзілуі және қасиеттері атомдық қосылыстардағы молекулалық орбитальдардың түзілуіне және қасиеттеріне ұқсас. Комплекс қосылыстарында энергетикалық диаграмма күрделі болып келеді. Бұларда байланыстырушы және босаң орбитальдардан басқа байланыстырмайтын орбитальдар болады.
Мысалы: [Nі(NH3) 6] 2+ Nі2+- 3d8
Комплекс түзу үшін никельдің 8 электроны, аммиактың 12 электроны қатысады (6NH3 - әрқайсысы 2 электроннан) . Осыдан басқа 4s, 4р - орбитальдар қатысады. Никельден 9 орбиталь, аммиактан 6 орбиталь барлығы 15 орбиталь, 20 электрон. Формуласы:
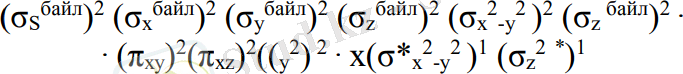
Комплексті қосылыстардың биологиялық маңызы және медицинада қолданылуы:
Комплексті қосылыстар медицинада, әсіресе фармакопиялық реакцияларда кеңінен қолданылады. Осыдан басқа олардың биологиялық маңызы өте зор. Бірнеше мысалдар келтірейік. Темір иондарының комплекс қосылыстары Темір иондары әрі катионды, әрі анионды комплекстер түзе алады. Мысалы, FeO+2H3O++3H2O = [Fe(H2O) 6] 2+ - катионды комплекс 6KCN + FeSO4 = K4 [Fe(CN) 6] + K2SO4 - анионды комплекс K4[Fe(CN) 6] - сары қан тұзы, ол Fe3+ ионын анықтау үшін аналитикалық химияда қолданылады, мынадай реакция нәтижесінде:
K4[Fe(CN) 6] + Fe3+ = KFe[Fe(CN) 6] 3 көк түсті қосылыс (берлин көгі) түзіледі, осы қосылыстың түзілуіне қарап, ерітіндіде Fe3+ - ионы бар екені дәлелденеді. K3[Fe(CN) 6] - қызыл қан тұзы, Fe2+ ионын анықтау үшін қолданылады. Fe(CN) 6] 3- + Fe2+ = Fe3+ + Fe(CN) 6] 4- (бұл тотығу-тотықсыздану реакциясы) содан кейін келесі реакция жүреді, сол кезде ерітінді көк түске боялады: Fe3+ + [Fe(CN) 6] 4-= K[Fe2(CN) 6] немесе KFe[Fe(CN) 6] турнбулл көгі. Осы көк түсті «турнбулл көгінің» түзілуіне қарап, ерітіндіде Fe2+ ионы бар екені дәлелденеді.
Гемоглобин және хлорофилл - циклді комплекс қосылыстар. Оларды хелаттар деп те атайды. Гемоглобиннің реакциялары:
ННb + O2 = HHbO2 - ауаны жұтқанда
ННb + С = HНb . СO2 (тканьде)
HНb . СO2 = HHbO2 + СO2↑ - ауаны сыртқа шығару.
Гемоглобин бұл жерде катализатор рөлін атқарып тұр. Ал хлорофилдің әсерімен жүретін реакция:
nСO2 + m H2O = Cn (H2O) m + O2
Бұл реакция жасыл өсімдіктердің көмірқышқыл газын сіңіруін көрсетеді. Олар жылына 550 млрд т. СO2 сіңіреді, ал сол кезде 400 млрд т. оттек бөлінеді. Сонда 380 млрд т. биомасса түзіледі.
Мырыштың комплекс қосылыстары. Биологиялық рөлі
Мырыштың кейбір комплексті қосылыстары келесі формулалармен өрнектеледі: Ме2[Zn(OH) 6] Ме2[Zn(OH) 4] Zn[(NH3) ] Х2. Ал кейде лигандалар ретінде органикалық қосылыстар қызмет атқарады. Мысалдар ретінде хинолин, стрихнин, этилендиаминді қарастыруға болады. Адам организмінде 0, 001 % Zn бар (тісте 0, 02 %) . Ракпен ауырғанда қандағы Zn мөлшері азаяды деген деректер бар. Ересек адамның организміне тәулігіне 15 мг Zn қажет, кәдімгі тамақпен түскен мөлшері жеткілікті. Мырыш өсімдіктің өсуіне және көбеюіне қажет. Циклді комплексті қосылыстар аналитикалық химияда титрлеу үшін кеңінен қолданылады. Бұл әдіс комплексонометрия немесе хелатометрия деп аталады, мұндай жағдайда комплексондар деп аталатын қосылыстар түзіледі. Олар катиондардың және аминополикарбон қышқылдарының туындылары болып табылады. Ең қарапайым комплексон - нитрилотрисірке қышқылы - комплексон І, аналитикалық химияда қысқартылып қабылданған аты: НТА:(H3Y)
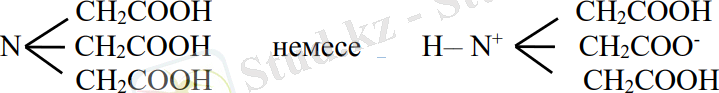
Негізгі комплексондардың бір-төртнегізді қышқылы - комплексон ІІ - ЭДТА (H және Y) :
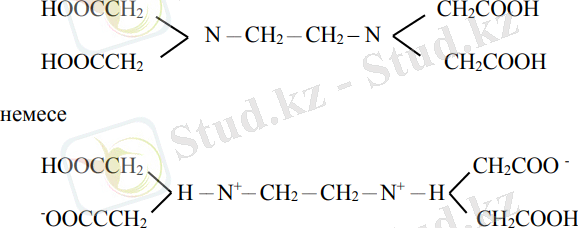
Әдетте көп қолданылатыны қышқылының қос натрий тұзы - комплексон ІІІ - трилон Б (Na2H2Y), оның құрылымы келесі формуламен өрнектеледі:
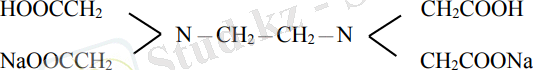
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz