d-элементтердің координациялық қосылыстары: кристалдық және лигандтар өріс теориялары мен кристалдық өрістің тұрақтану энергиясы


«d-Элементтердің координациялық қосылыстары. Кристалдық өріс теориясы. Лигандтар өрісі теориясы. Кристалдық өрістің тұрақтану энергиясы »
жоспар:
- d-Элементтердің координациялық қосылыстарына жалпы сипаттама.
- Кристалдық өріс теориясы.
- Лигандтар өрісі теориясы.
- Кристалдық өрістің тұрақтану энергиясы.
Ауыспалы элементтер химиясында комплексті қосылыстар маңызды орын алады: металл атомы (комплекс түзуші) бір немесе бірнеше лигандпен (өздігінен өмір сүретін молекула немесе ион) координацияланған. Төменде кеңінен тараған лигандтар келтіріледі:
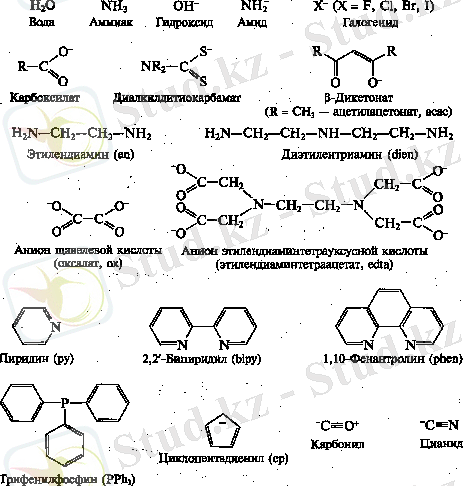
Лигандтар донорлық атомдардың (оттегі, азот, хлор, фосфор атомдары т. б. ) табиғатына және олардың санына қарай ерекшеленеді. Лигандтың металмен химиялық байланысқан донорлық атомының саны дентанттылық деп аталады. Мысалы, аммиак - монодентантты, этилендиамин - бидентантты, - гексадентантты. Бірден жоғары донорлық атомдардан тұратын көптеген лигандтар металдың бір атомына ғана координацияланып, онымен хелатты цикл түзеді. Мұндай лигандтар хелаттаушы, олармен комплекс - хелаттар деп аталады. Хелаттар монодентантты лигандтармен комплекстерге қарағанда термодинамикалық және кинетикалық тұрақты. Бұл құбылысты хелатты эффект дейді. Мысалы: аммиак және этилендиаминмен екі комплекстің К тұр қарастырамыз:
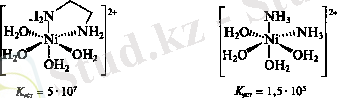
Этилендиаминмен комплекстің тұрақтылық константасының өсуінің себебі: келесі орын басу реакциясының нәтижесінде ерітіндіде бөлшектердің санының өсуіне байланысты энтропия жоғарылайды.
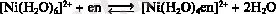
Аммиакат түзілгенде ерітіндідегі бөлшектер саны өзгермейді.
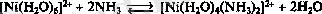
Хелатты эффекттің басқа себебі: хелатты циклдің ашылуының жылдамдығы төмен. Хелаттаушы лигандтың диссоциациясы бірнеше стадияда жүреді, бірінші стадиясында металл лигандтың донорлық атомына координацияланған. Бұл басқа донорлық атомның металдан алшақ орналасуына жол бермейді, хелатты циклдің қайта құрылуына мүмкіндік береді.
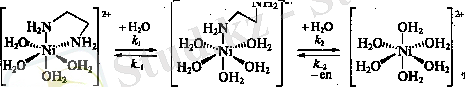
Тіке және кері реакциялардың жылдамдық константалары: k 1 =014c -1 , k 1 =1, 2. 10 5 c -1 , k 2 =15c -1 , k 2 =900c -1 .
Кейбір жай лигандтар, мысалы, ОН
-
, F
-
, Cl
-
, O
2-
, CO бір донорлық атомның көмегімен бірнеше металдарды байланыстырады. Арнайы әдебиеттерде мұндай комплекстерді лигандтың алдына µ грек әрпін және байланысқан метал санын көрсететін индекс қойып жазады. Бірнеше донорлық орталығы бар лигандтар басқа да мостиктер түзе алады, оларды
 әрпімен белгілейді.
әрпімен белгілейді.
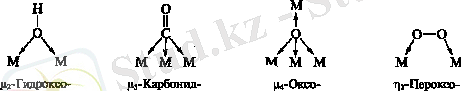
2. Кристалдық өріс теориясы. Комплексті қосылыстардың құрылысын сипаттау үшін кристалдық өріс теориясы қолданылады.
Кристалдық өріс теориясының негізгі түсініктері
1. d-элемент катионы мен лигантар байланысы электростатикалық тартылу ретінде қарастырылады, лигандтар - нүктелік теріс зарядтар - аниондар немесе полярлы молекуланың теріс жағы. Лигандтардың электрондық құрылымы қарастырылмайды. Байланыс коваленттік табиғат көрсетеді.
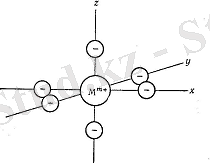
2. Лигандтардың электростатикалық өрісінің әсерінен d-деңгейше бөлінеді (жарылады) . Сыртқы өріс болмағанда бес d-орбиталь бірдей энергияда болады, ал лигандтар өрісінде олардағы энергия бірдей болмайды. Кейбір орбитальда энергия төмендеп, кейбірінде энергия жоғарылайды, бірақ олардың ауырлық орталығы энергия шкаласында сақталады, яғни орбитальдардың орташа энергиясы бұрынғы деңгейде болады. Бөліну схемасы (қай орбитальдар энергиясын төмендетті, қайсысы жоғарылатты) орбитальдардың қоршалу формасына және симметриясына тәуелді.
3. Бөлінген деңгейшеге электрондардың орналасуы үш жалпы принципке бағынады - Паули тыйымына, орбиталь энергиясының минимумге ұмтылуына және Хунд ережесіне-электрондардың максимальді толық спинге ұмтылуына. Бірақ көп жағдайда кейінгі екі принципке бағынбайды, ∆ бөліну параметрінің қатынасы мен жұптасу энергиясына Р тәуелді болады. Жұптасу энергиясы - жұптаспаған электронның электроны бар орбитальға орналасқанда электронаралық тебісу күшіне қарсы тұруға жұмсалатын энергия.
Егер ∆ < P болса, онда Хунд ережесі бойынша орналасу энергетикалық тиімді. Егер ∆ > Р болса, онда төменгі деңгейшеге орналасу, электрондарды жұптастырған жағдайда да тиімді. Сонымен катиондар электрондарының екі түрлі спиндік жағдайлары (күйлері) болады: Жоғары спинді (ЖС) (әлсіз өрістегі күй ∆ < P) және төменгі спинді (ТС) (күшті өрістегі күй ∆ > Р) . Олар иондық радиустармен, байланыс беріктігімен және магниттік қасиеттермен ерекшеленеді. ЖС күйге үлкен магниттік момент сәйкес келеді, бұл күйдегі иондар парамагнитті (зат магнит өрісіне тартылады) . ТС күйде магниттік момент азаяды, ал егер барлық электрондар жұптасқан болса, онда магниттік момент нольге тең және зат диамагнитті (магнит өрісінен тебіледі) .
Әр түрлі қоршаудағы d-деңгейшенің бөлінуі
d-Деңгейшенің бөліну себебін түсіну үшін электронды бұлттардың кеңістіктегі пішінін қарастырған жөн.
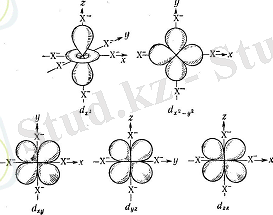
Алты теріс зарядталған октаэдрлік өрістегі орталық ионның бес d-орбитальдарындағы электрон тығыздығының таралу схемасы
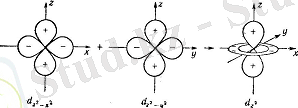
d z 2 -x 2 және d z 2 -y 2 орбитальдарының қосылып, d z 2 орбитальінің түзілу схемасы
d x ²- y ² және d z ² орбитальдары координат осьтерімен сәйкес келіп, ал қалған үшеуі ( d xy , d xz , d yz ) сәйкес координат осьтерінің бұрыштары биссектрисаларының бойымен өтеді. Лигандтар болмаған жағдайда барлық бес орбиталь энергиясы бірдей болды. Октаэдр төбелерінде лигандтар пайда болғанда d x ²- y ² және d z ² орбитальдарындағы электрон теріс зарядталған лигандтармен күшті тебіледі. Басқа үш орбиталь теріс потенциалдың аз мәндері бар жерлерге түседі. Сондықтан электронның d xy , d xz , d yz орбитальдарында болу ықтималдығы көбірек. Бұл лигандар әсерінен d-орбитальдары екі топқа бөлінгенін көрсетеді.
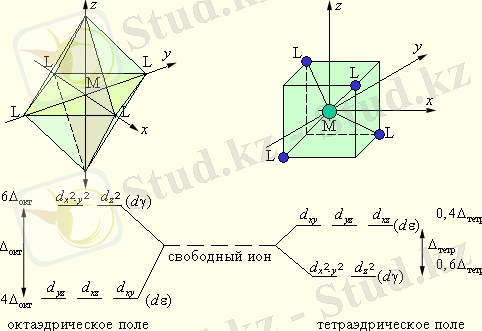
Алдымен октаэдрлік комплексті қарастырамыз.
 1
1
Алты бірдей лиганд катион төңірегінде үш перпендикулярлы координат осьтерінде: сол жақтан, оң жақтан, алдынан, артынан, жоғарыдан, төменнен орналасқан. Бес d-орбитальдар екі топқа бөлінеді: d γ -орбитальдар (d z 2 және d x 2 -y 2 ) лигандтар бойымен тіке орналасқан, олардан тебіледі де, энергиясы жоғарылайды, aл d ε -орбитали (d xy , d xz , d yz ) лигандтар жанынан - координат бұрыштарының биссектрисалары бойымен орналасады, бірақ олар аз тебіледі де, энергиялары төмендейді. Орташа энергия өзгермес үшін, үш d ε -орбитальдардың біреуі бір электронмен толса, онда октаэдрлік комплекс энергиясы 0, 4 Δ окт төмендейді де, оны бос ионға қарағанда тұрақтандырады. Ал екі d γ -орбитальдардың біреуіне электрон орналасса, онда бұл комплекс 0, 6Δ окт дестабилизацияланады (энергиясы жоғарылайды) .
Тетраэдрлік комплексте d-орбитальдар бөліну реті керісінше.
d-электрондарының d ε - және d γ орбитальдеріне таралу нәтижесінде комплексті қосылыстың энергиясының төмендеу шамасы кристалдық өріспен тұрақтану энергиясы деп аталады. Бұл энергия d ε - және d γ орбитальдеріндегі электрондар санына тәуелді және төмендегі формула бойынша анықталады:
- Еокт= (0, 4n - 0, 6m) Δокт,
- Ететр= (0, 6n - 0, 4m) Δтетр,
- n - төменгі деңгейшедегі электрондар саны, m - жоғары деңгейшедегі электрондар саны.
- Бірдей лигандтардан тұратын октаэдрлік өрістегі бөліну параметрі тетраэдрлік өрістегі бөліну параметрінен үлкен Δокт= 9/4 Δтетр
- Бөліну параметрі Δ орталық атомның өлшеміне, оның зарядына, электрондық конфигурациясына және лигандтар табиғатына байланысты. Тәжірибе жүзінде оны комплексті қосылыстардың сіңіру спектрлері арқылы анықтауға болады. Электронның қозып, төменгі деңгейден жоғарғы деңгейге орналасуы энергия сіңіру және спектрде сызық пайда болуымен іске асады, сіңіру спектрінің максимумы Δ бөліну энергиясына сай келеді. Δ мәнін толқын санымен ν = 1/λ см-1*. Көбінесе Δ саны 1-нан 3 см-1дейінгі шектерде болады.
- 3d-, 4d-, 5d-элементтер қатарында Δ периодтан периодқа 30-35 % ке өсіп отырады. Мысалы, [Co(NH3) 6] 3+үшін Δ = 23000 см-1, [Rh(NH3) 6] 3+үшін Δ = 34000 см-1, [Ir(NH3) 6] 3+үшін Δ = 41000 см-1.
- Δ шамасы екі зарядты иондар комплекстерінен үшзарядты иондар комплекстеріне ауысқанда өседі: [Fe(H2O) 6] 2+және [Fe(H2O) 6] 3+үшін Δ мәндері сәйкесінше 10400 см-1және 13700 см-1.
- Спектроскопиялық өлшеулерден кейін лигандтардың бөліну параметріне әсерінің өсу қатары (спектрохимиялық қатар) табылды:
- d4, d5, d6, d7конфигурациядағы иондармен түзілетін октаэдрлік комплекстерде электрондардың орналасуы әртүрлі болып келеді: Δ және P шамаларына байланысты жоғары спинді немесе төменгі спинді. Р мәні ТС және ЖС электрондардың энергияларының айырымын жұптасқан электрондар санына бөлгенге тең. P < Δ - төменгі спинді, P > Δ жоғары спинді.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz