Гетерогенді катализдің ғылыми негіздері және полиэдрлермен катализ теориясы


ГЕТЕРОГЕНДІК КАТАЛИЗДІҢ ҒЫЛЫМИ НЕГІЗДЕРІ
ЖОСПАР
4. 1. Қатты катализаторлар катализінің ерекшеліктері
4. 2. Полиэдрлермен катализ теориясы
4. 2. 1. Қатты катализаторлардағы белсенді орталық моделдері
4. 2. 2. Полиэдр құрамындағы катионның координациялық санының шамасы мен қатты катализатордың белсенділігі арасындағы байланыс
4. 2. 3. Құрамындағы катионның тотығу санының полиэдрлер белсенділігіне тәуелділігі
4. 2. 4. Полиэдрдегі иондардың зарядтылығы мен белсенділігі
4. 2. 5. Бірдей құрылысты полиэдлердегі байланыс ұзындығы және белсенділігі
4. 2. 6. Біртекті катиондармен тетраэдрлердің белсенділігі
4. 2. 7. Галогенді лигандасы бар тетраэдрлердің белсенділігі
4. 2. 8. Тетраэдрлердің ассиметриясы және қатты катализаторлардың белсенділігі
4. 2. 9. Полиэдрлерлің катализатордың беттік қабатына орналасуы және белсенділігі
4. 2. 17. Тетраэдр мен октаэдрдің электрлік өрісін есептеу.
4. 2. 11. Полиэдрдің электростатикалық өрісінің энергиясы мен белсенділігі
4. 2. 12. Аралас лигандты полиэдрлердің белсенділігі
4. 2. 13. Нанокатализ
4. 5. 4. Полимолекулалық адсорбция изотермасы. БЭТ теориясы
4. 1. Қатты катализаторлар катализінің ерекшеліктері
Қатты катализаторларды келесі типтерге бөлуге болады: оқшауланған, жартылай өткізгіш және өткізгіштер. Тор құрылысы бойынша оларды кристалдық және аморфты, химиялық табиғаты бойынша органикалық, бейорганикалық және органобейорганикалық. Қатты катализаторлардың бетінде сорбция энергиясы бойынша ажыратылатын белсенді орталықтар орналасады. Сорбция энергия шамасы бойынша энергетикалық біртекті және біртексіз катализаторлар деп бөлінеді. Қатты денелердің әр түрлі типіне және каталитикалық механизмінің елсенді орталықтарының құрылысын, күйін және құрамын түсіндіру үшін химия, физика, физикалық химия, кристаллохимия, термодинамика (тепе - тең, тепе - теңсіз, өзіндік және өзіндік емес процестер), кванттық химия және химиялық кинетика және макрохимия, коллоидтық химия және басқа да көршілес пәндерді қолдану негізінде түсіндіруге болады.
Қатты катализаторлар гетерогенді катализ жағдайында гомогенделген катализаторлардан бірнеше ерекшеліктерімен ажыратылады. Қатты катализаторлардың өзінің көлемі мен беттігі бар. Қатты катализатордың көлемі физика - химиялық қасиетін, үйілген тығыздығын, шынайы тығыздығын, бедерін анықтайды, өз кезегінде, тордың полиэдрлік құрылысына, табиғатына тәуелді болады.
Беттік қатты катализаторлардың белсенді орталықтағы адсорбция мен хемосорбция заттарын, катализаторлар мен сорбенттерді дайындау процесінде құрылатын беттік көлемді қалыптастырады. Белсенді орталықтар каталитикалық процестер үшін органикалық және бейорганикалық айналуларын анықтайды.
Қатты катализаторлар гомогенделген ерекшеліктері бар:
Олар кристалдық және аморфтық торға ие болады. полиэдрмен құралады, кристалдық тор элеметарлы торды трансляция жолымен құрылады, ал аморфты - полярдың бағытталған ансамбльі өз еркімен тізбектердің транчляциялануымен жүреді.
Каталитикалық процестерді өткізу үшін тұтас дене формасында қолданылуы мүмкін (металдар, асыл металдар Pt және Pd немесе бөлшектердің басқа формасында) немесе таблетка, шар, микросфера, сақина, жұлдызша және кеуекпен басқа да формалары.
Катализаторлар бөлшектерінің кеуекті құрылысы нақты жағдайда ішкі диффузиялық аумақтағы процестің өтуін сипаттайды.
- Катализатордың бетінде белосенді орталықтар орналасады, біртекті немесе біртекті емес энегретикалық күйі бойынша, ал, мұндай орталықтар адсорбциялық және каталитикалық белсенділік бойынша ажыратылады. Гомогенді катализ катализаторларында (молекула немесе иондар) барлық бөлшектер каталитикалық процесте бірдей белсенділікті көрсетеді;
- Қатты катализаторлар реакциялық орта немесе сыртқы жағдайға байланысты полиэдрлер құрылысын өзгерте алады, гомогенді катализ катализаторлары өз құрамын өзгертпейді (мысалы, NO катализторы SO2және SO3тотықтыру үшін) ; дегенмен, комплексті қосылыстар мысалы, тетраэдрден октаэдрге аусықанда құрылысын өзгертуі мүмкін ([CoCL4] 2-→ [CoCL4] 4-) .
- Қатты катализаторлардың бетінде катализатордың белсенділігі мен селективтілігін төмендететін химиялық процестің қосымша өнімдері жиналуы мүмкін. Мұндай құбылыс цеолит алюмосиликатының кокспен және ванадий мен никель оксидімен улануы өнеркәсіп саласында мұнай фракцияларын крекинглегенде кеңінен қолданылады.
- Қатты катализатордардың бөлшектері реакторда бөлшектердің қозғалатын қабатында бөлшектердің реакциялық қоспа қатысында катализатормен бұзылуы эрозиясына ұшырайды.
Қатты катализаторлардың белсенді орталықтарының және гомогенделетін катализаторларлық молекула (ион) ұқсас әрекеті каталитикалық процестің элементарлы сатысына қатысуына келесілері жатады: реагенттердің диффузиядан кейін белсенді орталыққа немесе гомогенделетін молекула (ион) немесе қатты катализаторға жақындап бірінші сатыда молекулалардың белсенді орталық пен молекуланың электромагнитті өрісінде қолайлы бағытталуы, қозуы, электрондар мен байланыстар басқа сатыларда жүреді.
Қатты алюмосиликат немесе комплексті ион [PtCL 4 ] 2- белсенді орталықтарында бірінші сатысында вакантты Al немесе Pt 3d 0 - AO иондары бірдей симметриялы, зарядтың фазалық белгілері және белсенді орталығы бар энергиясы бар олефин молекуласының вакантты төмен орбиталымен π 0 pxdx әрекеттеседі (сур. 4. 1. қараңыз)
Талаптарға сәйкес, белсенді орталық жүйесінің НВМО этилен молекуласымен әрекеттесуін квантты - химиялық принциппен жүзеге асады, сол сияқты топ теориясымен (электрондардың жылжытуынсыз) . Бұл келесі әдіспен жүзеге асады. Бұл әсерлесу электромагниттік өріспен жүреді.
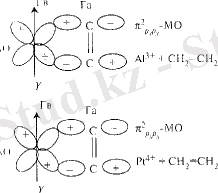
Сур. 4. 1. НВМО олефин молекуласының белсенді орталықтар [AlO 4 ] 1- немесе [PtCL 4 ] 2- электромагниттік өрісімен әрекеттесуінің сызбасы
Топ теориясы бойынша, келтірілмеген симметрия Г в 3d 0 - AO π 0 pxdx үшін Г а көрінісіне толық симметриялық болады. Ол бөлшектердің рұқсат етілген әрекеттесулері анықтайды:
Бұл сатыда этилен молекуласының белсенді орталыққа электромагниттік өріс арқылы тартылуы жүреді, процесте белсенді орталықта молекуланың сорбциясы немесе гомогенді немесе гетерогенді катализ жағдайындағы тұрақсыз каталитикалық комплекстің түзілуін аяқтайды.
Келесі сатыларда π 2 pxdx электрондарының π 0 pxdx НВМО ауысуы жүреді, осы кезде осы түрдегі жұр молекулалық орбиталь түзіледі:

Қозған
 этилен молекуласының молекулалық орбиталы протон 3d
0
- AO Al
3+
ионына ауысады және катион радикалдарының жұбы түзіледі.
этилен молекуласының молекулалық орбиталы протон 3d
0
- AO Al
3+
ионына ауысады және катион радикалдарының жұбы түзіледі.
Құрамында катион - анион радикалдары бар каталитикалық комплекстің шектерінде электрондар мен байланыстардың сандық байланысты сақтау арқылы қайта таралауы жүреді (қайта таралуға дейін және одан кейін) .
Келесі элементарлы сатыда белсенді орталығы бар әрекеттесетін симметриясының бұзылу есебінен каталитикалық орталықтан өнім молекулаларының ажыратылуы жүреді. Өнімнің бір молекуласы (немесе өнім молекуласындағы байланыс) негізінен түзіледі, ал екіншісі - қозған күйде түзіледі. Қозған молекула басында белсенді орталықта қалады.
Сәулелендіру формасында энергияның артық мөлшерін бөліп алғаннан кейін қозған молекула бастапқы күйге ауысады және орбиталды симметриясының бұзылуынан белсенді орталықтан ажыратылады. Себебі, молекула бастапқы жағдайда келтірілмеген көрініспен сипатталады (КК) Г а , ал белсенді орталық КК Г в . Бұл КК көбейту толық симметриялық Г а күйін алуға қамтамасыз етпейді, ал КК Г в алынады:
Г а ⋅Г в = Г в⋅
Бұл КК каталитикалық компекстің тұрақсыз күйін көрсетеді (4 . 2 . сур) .
Жоғарыда келтірілген каталитикалық процестің элементарлы сатыларын талдау қатты және гомогенделген катализаторлар үшін мұндай бірдей процес механизмінің өтуін көрсетеді.
Қатты катализаторлар үшін катализ теориясы екі бағыт бойынша дамиды: бірінші бағыт бойынша қатты катализаторлардың құрамын, құрылысын және қасиеттерін ғылыми зерттеу, ал екінші бағыты катализатордардың құрылысын, қасиетін оның әрекет ету механизмімен байланыстыратын катализ теориясы бағытында дамиды.
Бұл екі бағыт зерттеушілер өңдеп шығарған катализ теориясы бойынша келесідей атаулар қолданылады:
- Лэнгмюрдің адсорбциялық теориясы, энергетикалық біртекті беттегі адсорбция;
- Энергетикалық біртексіз беттегі адсорбция;
- Тейлордың белсенді орталық теориясы;
- Аралық қосылыстардың теориясы.
- А. А. Баландиннің мультиплеттік катализ теориясы
- Ф. Ф. Волькенштейннің электрондық катализ теориясы
- Кристалдық өріс пен лиганда өрісі теориясы
- С. З. Рогинский қанықтыру теориясы.
- И. М. Колесниковтың полиэдрлермен катализі теориясы
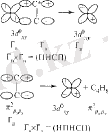
Сур. 4. 2. Каталитикалық комплекстің ыдырау сызбасы. ТСКК - толық симметриялық келтірілмейтін көрініс, ТЕСКК - толық емес симметриялық келтірілмейтін көрініс.
Теориялардың көбі тек бір типті катализатордың сипатын ғана болжайды: катализаторлардың беттік энергиясы бойынша өте тегіс немесе біртексіз болуы, аралық тұрақты каталитикалық комплекс түзуге қабілетті оксидті катализаторлар (азот құрамды және күкірт құрамды қосылыстар), кристалдық металдық қатты заттар, металдық тасымалдаушылардағы атомдардың үйлесімі, комплексті қосылыстар, дефектілі торы бар қатты денелер. Тек полиэдрлермен катализ теориясы кез келген қатты және гомогенделетін органикалық және бейорганикалық қосылыстарының каталитикалық айналу механизмі мен катализ құбылысы үшін қолданылады және катализаторларды дайындаудың теориялық негіздерін, сол сияқты құрылысы арқылы қасиеттерін зерттеуді қамтиды.
Катализ теориясын түрлі қатты және гомогенделетін катализатордар үшін өнеркәсіптік өндіру мен эксплуатациялауды өңдеу каталитикалық процестердің механизмін түсіндіру үшін, катализаторлардың белсенділігі мен селективтілігін құрастыру, мұнай фракцияларының каталитикалық крекинг процестерінде қолданылатын жаңа катализаторларды өндіру мен эксплуатациялау жағдайларын қолайлы жағдайы үшін (төмен, орташа, жоғары глиноземды алюмосиликатты катализаторларды жасау), мұнай фракцияларының гидрокрекинг процестері үшін (алюмо - никель - молибден немесе алюмо - кобальт - молибден, циолит катализатордарды қосу), төмен октанды бензиндерді жоғары октанды бензиндерге айналдыратын платформинг катализаторлары (Pt, Al 2 O 3 , асыл металдары бар жоғары кремнийлі циолиттер және гидрлеу, дегидрлеу, хлорлау сияқты өнеркәсіптік процестер үшін арналған катализаторлар) үшін маңызды болады.
Жоғары эффективті катализаторлар әсіресе өнімділігі жоғары қондырғылар үшін өңдеуге және қолдануға және анағұрлым жоғары сапалы мақсатты өнімдерді алуда (бензин, дизельдік отын, олефин және т. б. ) қажет, себебі, мақсатты өнімдердің шығыны жоғарылаған сайын, қондырғы эксплуатациясының эффективтілігін жоғарылатады. Мұнай химия процестеріне жататын процестер диендердің синтезі, парафиндер мен олефиндердің дегидрленуі, полиэтилен мен полипропиленді қолдану арқылы этилен мен пропиленнің полимерлену, каучук синтезі, этиленнің тотығу, СО және Н 2 синтездер және т. т өнімділігі жоғары келеді. Бұл процестер катализ теориясы бойынша алуға болатын немесе әдістермен жетілдіру, сол секілді синтез бен катализаторларды таңдауда жоғары эффективті катализаторларды қолдануды талап етеді.
4. 2. Полиэдрлермен катализ теориясы
Полиэдрлермен катализ теориясы 1964 жылы И. М. Колесниковтың табиғи алюмосиликаттардың белсенділіктерін анықтау: силлиманит, андалузит және кианит докторлық диссертациясының зерттеу негізінде пайда болды.
Бұл минералдар Al 2 SiO 5 формуласымен көрсетілетін бірдей химиялық құрамға ие болады, бірақ берілген модификация торға кіретін полиэдрлердің құрылысымен ажыратылады. Қатты катализаторлардың түрлі модификация және белсенділігін анықтау жолында кеңінен тәжірибелік зерттеулер жүргізілді, сол сияқты полиэдрлердің құрамы мен құрылысы және қасиетінің оның каталитикалық белсенділігінің селективтілігі мен эксплуатациялық қасиеттері арасындағы байланысты анықтау үшін кинетика және термодинамика, кванттық химия, түрлі аспаптық әдістер қолданылды.
4. 2. 1. Қатты катализаторлардағы белсенді орталық моделдері
Полиэдрлермен катализ теориясына белсенді орталық моделі ретінде қатты дене торында «бірінші кірпіш» тәрізді полиэдр таңдалды. Полиэдр термині Л. Полинг жұмысында ұсынылды, және ол кристаллохимияды кеңінен қолданыс тапты. Полиэдр аспаптық әдіспен қатты катализатор торында ұқсастырылған шынайы құрылыс болып саналады. Лоуренс, Беркли атындағы лабораторияда, Калифорниялық университетінде цирконий диоксидінің бейнефотасы алынды.
Тордың бейнесінде бұл тордың құрылысының келісті суретін түзетін тетраэдр контуры анық көрініп тұр. Полиэдрлердің теориялық құрылысы кристаллохимия көмегімен анықталуы мүмкін және аспаптық әдіспен дәлелденеді, ал полиэдрлердің күйі кванттық - химиялық әдістермен есептеледі және тәжірибелік - спектралды, радиожиілік және басқа да әдістермен анықталады. Полиэдрлер үшін, қатты денедегі шынайы құрылыс үшін термодинамикалық есептеулермен энергетикалық күйін және құрылысының сыртқы параметрлерінің өзгеруі бойынша өзгеру бағытын анықтайды.

Термодинамикалық әдістермен катализатордың оптималды құрамын есептеуге болады және полиэдрлер арасында электрондарды қайта таралуын есептеуге болады. Кинетикалық әдістермен қалыптасу процестерінің кинетикасын және қатты катализаторлардың қартаюын, «электрондық» тынысалу кинетикасын және т. б. процестерді зерттейді. Мұндай есептеулерді тек аморфты және кристалды катализаторларға ғана өткізу керек. Полиэдрлердің катализ теориясы органикалық және бейорганикалық заттардың айналу катализін түсіндіру үшін шексіз қолданылады, сулы және сусыз, гомогенді және гетерогенді жүйелерде өткізілетін процестер үшін пайдаланылады. Полиэдрлермен катализ теориясын өзіндік және өзіндік емес процестердің термодинамикасымен және квантты - химиялық принциптермен каталитикалық процестердің механизмін қорыту арқылы талдап көрсету жолымен толықтырылды.
4. 2. 2. Полиэдр құрамындағы катионның координациялық санының шамасы мен қатты катализатордың белсенділігі арасындағы байланыс
Аморфты немесе кристалдық дене катионы құрамында координациялық саны 4, 5 және 6. Бұл анағұрлым кең таралған поляр типтері - тетреэдр, тригоналды бипирамикада немесе квадратты пирамида және октаэдр. Қатты денелердің белсенділігі аморфты немесе кристалдық торға кіретін полиэдрлер типіне тәуелді. Полиэдр катализіндегі анағұрлым белсенді құрылысты анықтау үшін, эксперименталды тәжірибелер үшін қатты заттардың белсенділігін тексеруде катализаторлардың модификациясын таңдайды. Модификация дегеніміз бір тордың химиялық құрылысымен ажыратылатын, түрлі координациялық сандары бар полиэдр құрамды фаза.
Профессор И. М. Колесников 1964 жылы анағұрлым белсенді полиэдр құрылысын анықтау үшін үш модификация таңдады - силлиманит, андаллузит және кианит. Бұл модификациялар Al 2 SiO 5 формуласымен анықталатыт бірдей химиялық құрамға ие болады. Дегенмен, модификация торында (табиғи кристалдық минералдар) келесі полиэдрлер бар: [AlO 4 ], [SiO 4 ] және [AlO 4 ] және [AlO 6 ] ; [AlO 6 ], [SiO 4 ], және [AlO 6 ], сәйкесінше.

Сур. 4. 4. Кумол крекингі силиманитте - С, андалузитте - А және кианитте К Т = 623 К температурасында
Бұл минералдарда полиэдр құрылысы бойынша ажыратылатын Al 3+ ионы бар, [AlO 4 ] - тетраэдр, [AlO 5 ] - тригоналды бипирамида және [AlO 6 ] - октаэдр, ал қалған полиэдрлер торда ұқсас. Бұл модификацияларда кумол крекингі мен спирттердің дегидратациясы зерттелді, ал алынған нәтижелер 4. 4 және 4. 5 суреттерде келтірілген.
Тәжірибеден изопропилбензолды крекингілеу және изопропил спиртун дегидратациялау модификацияның каталитикалық белсенділігі мына қатарда анық көрсетілген:
Силлиманит > андалузит > кианит
Жоғарыда көрсетілгендей, силлиманит торында [AlO 4 ] - тетраэдр, андалузитте - [AlO 5 ] - тригоналды бипирамида және кианитте [AlO 6 ] - октаэдр. Жоғарыда келтірілген мәліметтер бойынша, 4 ке тең аз к. ч. катионы болатын полиэдр анағұрлым жоғары каталитикалық белсенділік кумол мен изопропил спиртінің айналуы көрсетеді, ал андалузит пен кианитте Al 3+ ионы к. ч. 5 және 6 көрсетеді. Полиэдр құрамындағы катионның к. ч. шамасының байланысы қатты катализатор белсенділігімен басқа да модификациялар үшін анықтауға болады. Алюминий оксиді екі модификацияда болуы мүмкін (жалпы жағдайда екіден көп), ɤ - Al 2 O 3 және α - Al 2 O 3 . Алюминий оксидінің гамма - модификациясы торында тетраэдрі бар, ол октаэдр шыңдарымен байланысқан, ал альфа - модификация октаэдр қабырғаларының байланысынан тұрады. Алюминийдің гамма - оксиді көмірсутектерді изомерлеудің, спирттердің дегидратациясы және басқа да реакциялар үшін шынайы катализаторы болып табылады. Оны риформинг катализаторы тасымалдағыш ретінде қолданылады. Бұл тасымалдағышта Pt, Re/ ɤ - Al 2 O 3 , Pt, Sn/ ɤ - Al 2 O 3 және басқа да катализаторлар қолданылады. ɤ - Al 2 O 3 қатысынла гидротазарту, гидрокрекинг (алюмо - кобальт - молибден немесе алюмо - никель - молибден оксиді катализаторлары) катализаторлары синтезделеді.
Кесте 4. 1. Этилен спиртінің адсорбциялану және дегидратациялау реакцияларындағы оксидтердің салыстырмалы белсенділіктері
Активтелу энергиясы,
кДж/моль
α - Al 2 O 3
ɤ - Al 2 O 3
27. 0⋅10 -12
1. 1⋅10 -15
121. 4
163. 2
139
18
52. 7
5. 99
Осы кезде альфа алюминий оксиді берілген реакцияларда белсенді емес және оны риформинг катализаторларыны тасымалдауышы ретінде қолданылмайды, дегенмен, крекин катализаторларының инертті ауырлатқыш ретінде қолданылады.
Алюминйдің гамма оксидінің торында тетраэдр мен октаэдр байланысы болады, алюминий альфа оксидінде тек октаэдр болады, ол мәліметте көрсетілгендей көмірсутектер мен спирттердің айналу реакцияларында белсенді емес және аз белсенді (4. 1. кестені қараңыз) . Октаэдрлер тетраэдлерге қарағанда спирт молекуласына әсері анағұрлым әлсіз. Бұл мәліметтерге сүйенсек, гамма алюминий оксиді альфа алюминий оксидіне қарағанда 10 4 есе артық екені көрінеді. Бұл айырмашылық гамма және альфа алюминий оксидінің қасиеттерінде спирт адсорбциясының аз жылу шамасы көрінеді. Гамма алюминий оксидінде спирт молекуласының сорбция процесін хемосорбцияға жатқызамыз.
Қорытындылай келе, аз к. ч. катализаторлары жоғары к. ч. катионы болатын катализаторларға қарағанда үлкен каталитикалық және адсорбциялық белсенділік көрсетеді, бұл төменде көрсетілетін болады.
4. 2. 3. Құрамындағы катионның тотығу санының полиэдрлер белсенділігіне тәуелділігі
Тотығу саны формальды түрде катионның оң валенттілігімен немесе анионның теріс валенттілігімен анықталады. Полиэдр құрылысының тор құрамында катиондар мен аниондардың үйлесімінен құралады, Ме - L (лиганда) байланысның иондылығы мен коваленттілігі катиондар мен аниондардың табиғатына байланысты болады.
Катион мен анионның тотығу саны бүтін сан болып табылады. Кванттық - химиялық есептеулер көрсеткендей, катион мен анионда бөлшектік заряд болады, ол электрондардың ионның бір жағына толы емес жылжуымен анықталады. Иондардағы мұндай бөлшектік заряд зарядтылық деп аталады. Катиондар мен аниондарсыртқы параметрлер - температура, тотықсыздандырғыш, реакциялық қоспа т. б. параметрлер әсерінен өздерінің зарядтарын өзгертуі мүмкін.
Тотығу санының анағұрлым оңай өзгеруі Д. И. Менделеевтің периодтық кестесіндегі металдардың 4, 5, 6, 7 топтарының катиондары жатады. Мысалы, хром иондары тотығу сандарын +6 дейін, молибден иондары - +2 - ден +6 дейін, темір ионы - +2 - ден +3 дейін өзгеруі мүмкін. Катионның тотығу санының өзгеруі кезінде осы ионның радиус өлшемі де өзгереді, Ме - Л байланыс ұзындығы өзгереді, полиэдрдің энергетикалық күйі өзгереді. Бұл полиэдрдің акцепторлық және донорлық қабілетінің, каталиикалық белсенділік пен селективтілігінің өзгеруіне әкеледі. Мұндай өзгерісті алюмохром катализатор құрамына кіретін, парафин көмірсутектерді дегидрлеу және диэтилсульфидтің ыдырау процестерінде қолданылатын тетраэдр [Cr n+ O 4 ] m- мысалында қарастыруға болады.
Жоғарыда айтылғандай, хром ионы +2, +3, +4, +5 және +6 тотығу дәрежелеріне ие болады. Осы тотығу дәрежелеріне ион хромның келесі радиус шамалары сәйкес келеді, нм: 0. 081; 0. 064; 0. 051; 0. 041; 0. 035. О 2- ионының радиусы 0. 136 нм. Сол кезде Cr - O байланыс ұзындығы формалды түрде сәйкес болады, нм: 0. 217; 0. 200; 0. 187; 0. 179; 0. 171.
Сәйкес байланыс ұзындықтарымен тетраэдрлердің формасы 4. 6. суретте келтірілген.
Тетраэдрлерді жорамалдап құрастырды, Cr - O байланыстары арасындағы бұрыш 120° құрайды. 4. 6. суреттен көріп отырғанымыздай, тетраэдрде хром ионының тотығу саны артқан сайын реагенттер молекуласының хром ионына қол жеткізу мүмкіндігін азайтады. Бұл орталық - симметриялық катионмен әрекеттесетін реагент молекуласының стерикалық кедергісін ұлғайтады. Дегенмен, ион мөлшерінің өзгеруімен оның акцепторлық күші арта түседі. Оны мына формуламен анықтауға болады:
A = k (z/r 2 )
Мұндағы, z - катион заряды; r - байланыс ұзындығы; к - масштабты коэффициент. Осылайша, хром ионының тотығу саны артқан сайын, бір жағынан, оның акцепторлық күші артады, екінші жағынан, реагент молекуласы үшін тетраэдр жағынан стерикалыө кедергіні арттырады.
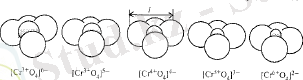
Сур. 4. 6. Тетраэдрдің [Cr n+ O 4 ] m- өлшемінің хром ионының түрлі сандарымен тотығуы.
Максималды белсенділікке тетраэдр хром ионының аралық санымен және реагент молекуласына катионның максималды қол жеткізуіне ие болады.
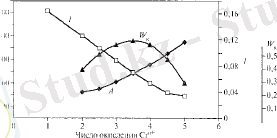
Сур. 4. 7. Ыдырау реакциясындағы алюмохром катализаторының қол жетуі L, акцепторлық күші А және белсенділігіне тәуелділігі W
[Cr n+ O 4 ] m- әр түрлі тотығу саны бар тетраэдрлері бар алюмохром катализаторының бетінде диэтилсульфидтің ыдырауында, ыдырау жылдамдығын есепке ала отырып өткізіледі. Диэтилсульфидтің ыдырау жылдамдығы бойынша мәліметтер 4. 7 суретте келтірілген. 4. 7 суреттен көріп отырғанымыздай, хром ионының тотығуының +2 - ден +6 - ға жоғарылауы акцепторлық күш, қол жету дәрежесі төмендейді, ал диэтилсульфидтің ыдырау жылдамдығы +3. 5 және +4 хром ионы тотығу саны бар тетраэдр құрамы катализатор үшін максимумнан өтеді. Бұл катализатордағы хром ионы санының оптималды шамасы болып табылады.
4. 2. 4. Полиэдрдегі иондардың зарядтылығы мен белсенділігі
Кванттық - химиялық есептеулермен полиэдрлердің күйі (тетраэдр және октаэдр) анықталды, катиондар мен аниондардағы таралған зарядтар шамасы бүтін сан емес. Олар бөлшек мәндерді қабылдауда валент шегінде өзгереді. Мұндай шамалар катион немесе анионның зарядтылығы деп аталады.
Полиэдрдегі берілген катион үшін зарядтылық шамасы берілген полиэдрді қоршаған басқа да полиэдрлердің табиғатына, лиганда табиғатына, полиэдр симметриясына, адсорбциялық заттар мен басқа да факторға тәуелді болады.
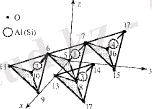
Сур. 4. 8. Шыңдары бір - бірімен байланысқан және сыртына бағытталған тетраэдрлердің ансамблі
Полиэдрдергі ион зарядтарының шамасы полиэдрдің электрондық тыныс алуын қамтамасыз ететін температура, УК немесе ИҚ сәулелену, реагент молекуласының әсерімен каталитикалық процестің өту барасында өзгеруі мүмкін.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz