Алкендердің қосылу реакциялары: түрлері мен механизмдері


ІІ. Негізгі бөлім
- Еселі көміртек - көміртек байланыстарына қосылу
- Реакция түрлері
- Классификациясы
ІІІ. Қорытынды
Пайдаланылған әдебиеттер тізімі
Кіріспе
Алкендердің химиясы - бұл еселі көміртек - көміртек байланыстарының химиясы. Қос байланыс үшін қандай реакциялар тән? Еселі байланыс берік σ - байланыстары мен беріктігі біршама аз π - байланыстарынан тұрады. Олай болса, осы реакцияларда π - байланыстарының үзілуін қарастыратын боламыз. Дәлірек айтқанда, π - байланыстарының үзіліп, орнына екі берік σ - байланыстың пайда болуы қос байланысты типті ракциялар болып келеді.
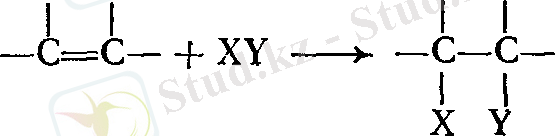 қосылу
қосылу
Екі молекуланың қосылып, жаңа бір молекула түзу реакциясы қосылу реакциясы деп аталады.
Негізгі бөлім
Қосылу реакциялары құрамында бір жұп электрондарынан көп атомды байланысқан заттармен шектеледі, демек, қосылыс еселі байланысқа ие болады. Қандай реагенттер еселі көміртек - көміртек байланыстарына қосылуы мүмкін? 1 - суреттен көріп отырғанымыздай, қос байланыстың π - электрон бұлты атом орналасқан жазықтың үстінде де, төменгі бөлігінде де орналасқан. π ‒ электрондар аз деңгейде көміртектің екі ядросын байланыстыруға қатысады. Нәтижесінде олар көміртектің ядросымен аз беріктікте ұстап тұрады. Бұл электрондар әсіресе электрондары жетіспейтін реагент үшін қол жетімді. Көптеген реакцияларда еселі көміртек - көміртек байланысы электрон доноры ретінде, нақтырақ айтқанда, өзін негіз ретінде көрсетеді. Олар электроны аз қосылыстармен, яғни қышқылдармен реакцияға түседі.
Жұп электроны жоқ қышқыл реагенттер электрофильді агент деп аталады ( грек тілінен аударғанда: электронды сүйетін ) . Алкендердің типті реакциялары электрофильді қосылу немесе басқаша айтқанда қышқыл агенттердің қосылу реакциялары деп аталады. Сонымен қатар реагенттердің басқа да типі, электроны аз немесе дәлірек айтқанда тек бір электронға ие - бос радикалдар агенті бар. Алкендер сол сияқты бос радикалды қосылу реакциясына түседі.
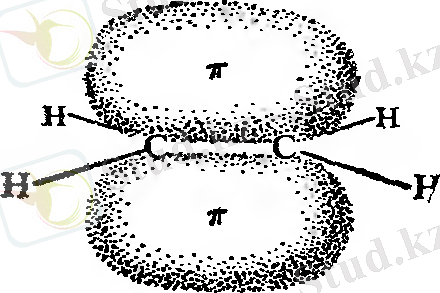
1 - сурет. Еселі көміртек - көміртек байланысы: π ‒ байланысы электрон доноры болып табылады.
Алкендердің көбі тек еселі көміртек - көміртек байланыстарын ғана емес, сол сияқты маңызды алкандардың қалдығы болып табылатын алкил топтарын да құрайды. Алкендер еселі көміртек - көміртек байланыстарына тән қосылу реакцияларынан басқа, алкандарға тән бос радикалды орынбасу реакциясына түсуі де мүмкін. Қосылу және орынбасу реакцияларының неғұрлым маңызды реакциялары төменде келтірілген.
Бір реагент қышқыл және бос радикал сияқты қосылып, нәтижесінде түрлі өнімдер түзетіні белгілі. Еселі байланыс арқылы қосылуға, сол сияқты орынбасу реакциясына түсуге қабілеті бар реагенттер де бар. Шартты өзгерте отырып, бұл реагенттерді анықталған тип бойынша - электрофильді немесе бос радикалды қосылу немесе орынбасу реакцияларына түсетіндей етуге болады.
Көміртек атомымен еселі байланысқан алкил тобы оның қасиетіне тікелей тәуелді болады. Қос байланыс та өз кезегінде алкил тобының қасиетіне әсер етеді.
Қосылу реакциялары

- Сутекті қосып алу. Каталитикалық гидрлеу.
Мысал:
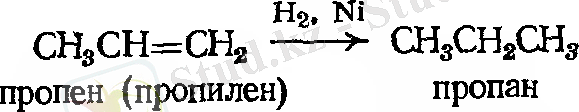
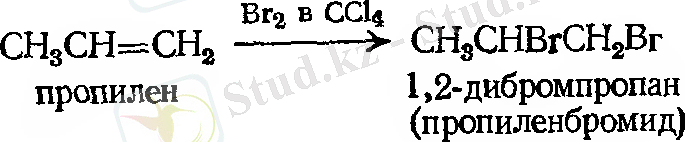
- Галогенді қосып алу.

Мысал:
- Галогенсутекті қосып алу.
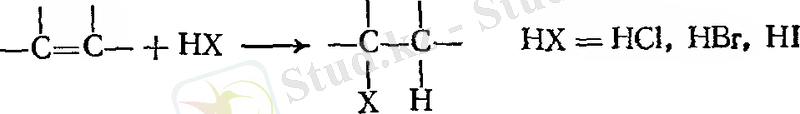
Мысал:
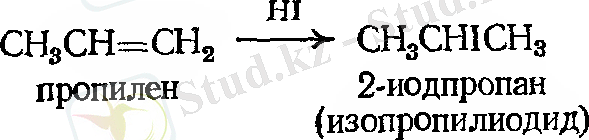
- Күкірт қышқылын қосып алу
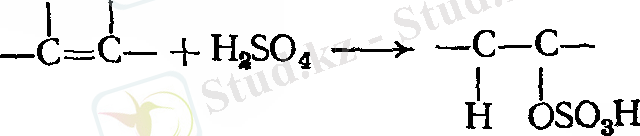
Мысал:
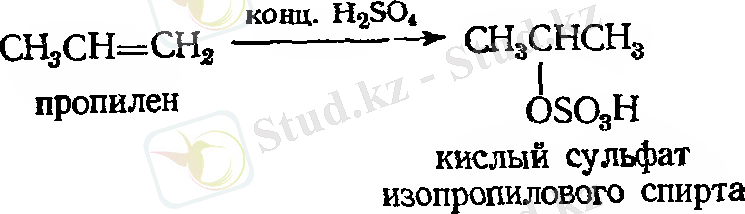
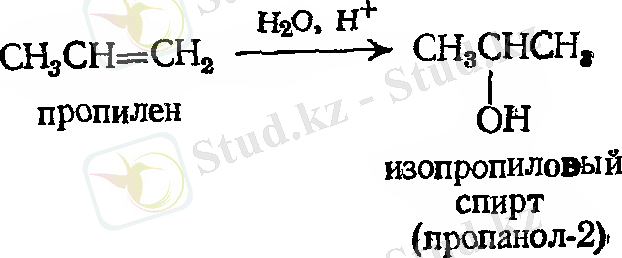
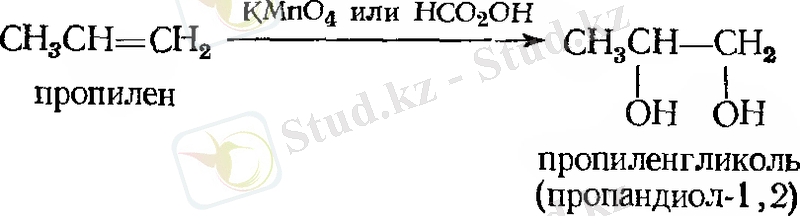
- Суды қосып алу. Гидратация
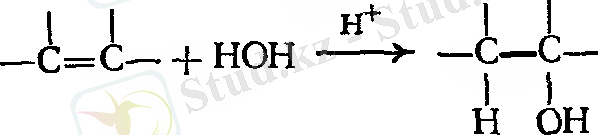
Мысал:
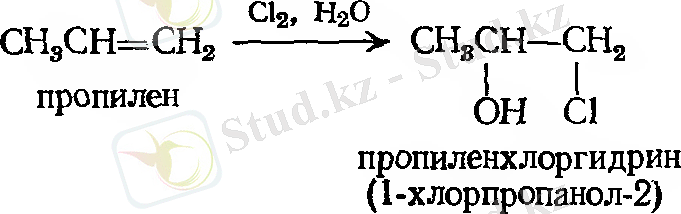
- Галогенгидриннің түзілуі

Мысал:
- Димерлену
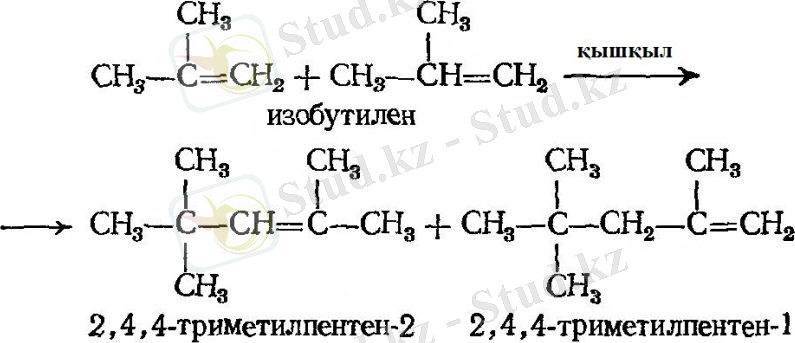
- Алкилдену
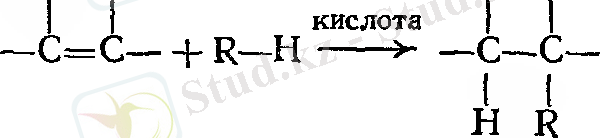
Мысал:
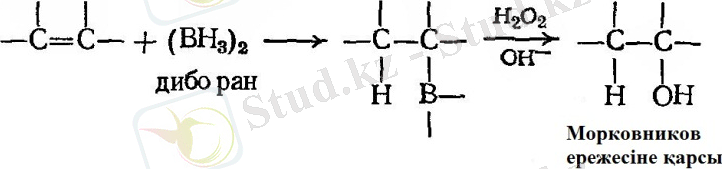
- Гидроборлау - тотықтыру.
- Бос радикалдарды қосып алу

Мысал:

- Метиленді қосып алу
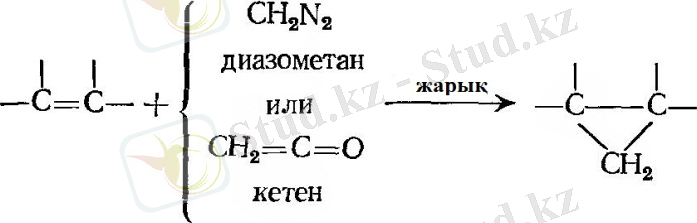
- Гидроксилдеу.
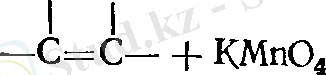 немесе
немесе

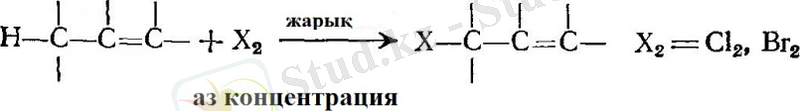
- Галогендеу. Аллильді орынбасу
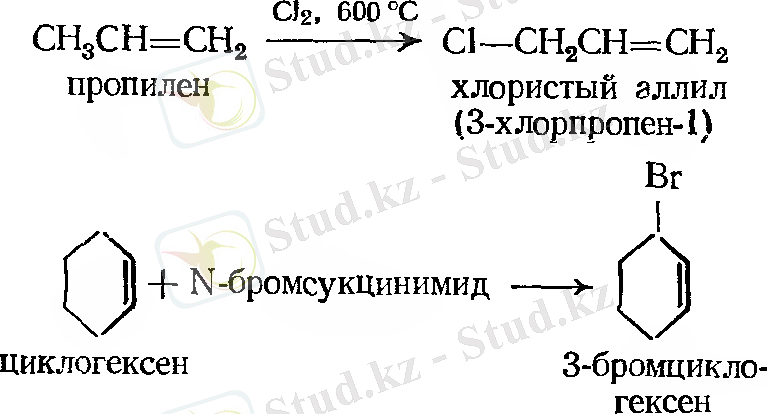
- Озонолиз
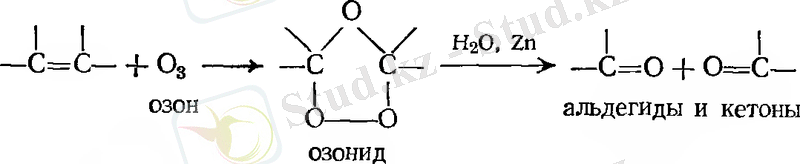
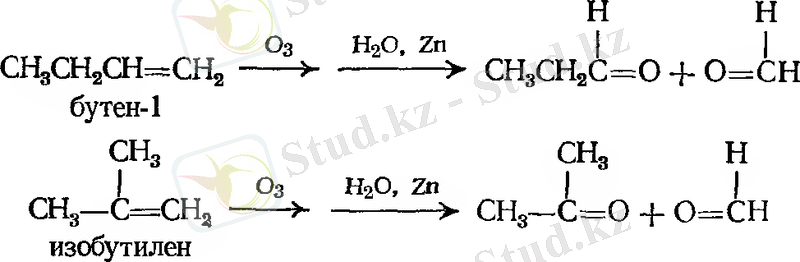
Мысалдар:
Галогендерді қосып алу
Құрамында екі галоген атомы көрші көміртек атомымен алкендер хлор және броммен оңай реакцияға түсіп, қаныққан қосылыстар түзеді. Йод негізі реакцияға қатыспайды.
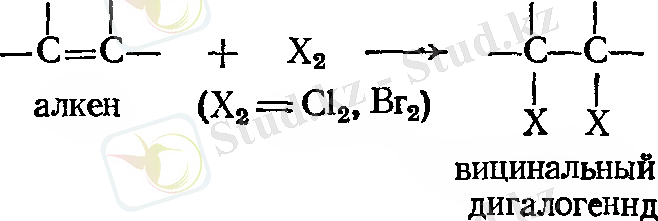
Қосылу процесі тез және бөлме температурасында немесе тіпті төмен температурада УК сәулесін қажет етпейді. Тек жоғары температура мен күшті жарық сәулесінен аулақ болған жөн. Себебі, бұл жағдайда галогеннің артық мөлшері белгілі бір дәрежеде қосымша орынбасуға әкелуі мүмкін.
Бұл реакция осы уақытқа дейін вициналь дигалогенидті алудың жақсы әдісі болып табылады.

Бромды қосып алу негізінен еселі көміртек - көміртек байланысын көрсету үшін қолданылады. Бромның төртхлорлы көміртектегі ерітіндісі қызыл түс, ал дигалогенид ерітіндісі түссіз келеді. Бром ерітіндісінің жылдам түссізденуі, құрамындағаы еселі көміртек - көміртек байланыстың барын анықтайды.
Галогенсутекті қосып алу. Марковников ережесі.
Алкендер сәйкесінше хлорлы, бромды немесе йодты галогендермен әрекеттесе отырып, алкилгалогенид түзеді.
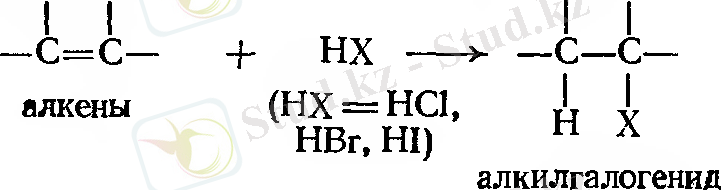
Реакцияны негізінен газ тәрізді галогенсутекті тікелей алкенге енгізу арқылы жүреді. Кейде орташа полярлы еріткіш, мысал ретінде, сірке қышқылын қолданады. Ол полярлы галогенсутекті де, полярлы емес алкенді де ерітуге мүмкіндік береді.
Осылайша этилен этилгалогенидке айналады, сутек көміртек атомының қос байланысына барып қосылса, ал галоген басқасына қосылады.
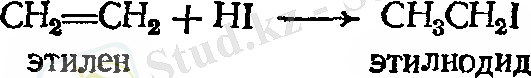
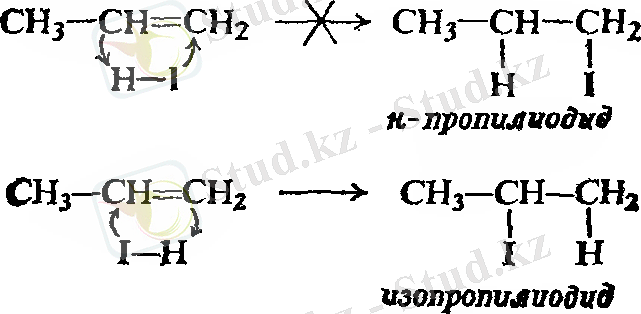
Пропилен екі өнім түзуі мүмкін - н - пропил немесе изопропилгалогенид - қосылыстың бағытына тәуелді бола отырып, демек, қайсысы сутек атомына, қайсысы галоген атомына қосылатынына байланысты. Изопроилгалогенид анағұрлым басымдылыққа ие.
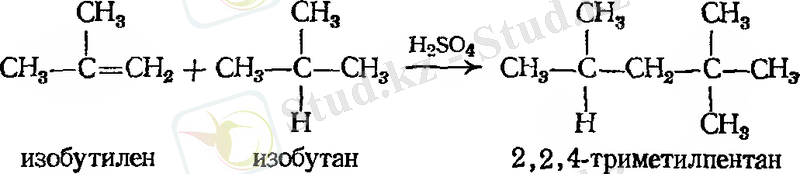
Осы орайда изобутилен де екі өнім түзуі мүмкін - изобутил немесе үшіншілік - бутилгалогенид.
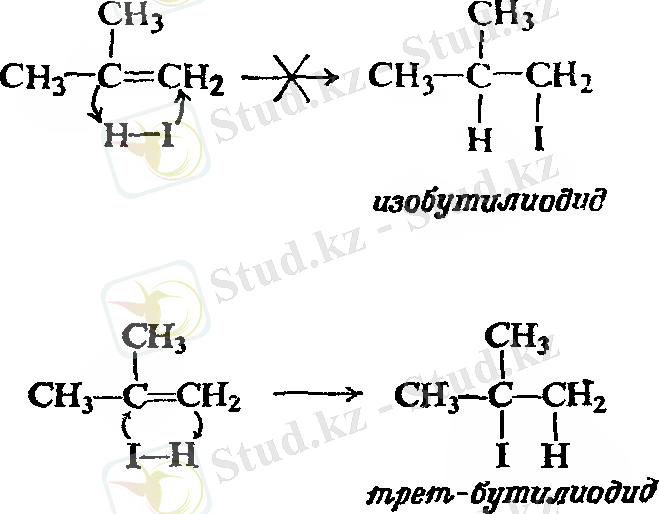
Қосылыстардың осындай жоғары санын зерттеу барысында, орыс химигі Владимир Морковников (Қазан университеті), егер екі изомерлі өнім түзілетін болса, онда оның бір өнімі басымдырақ келеді деген. 1869 жылы Марковников келесі ережені қалыптастырды: ионды қосылуда қышқыл еселі көміртек - көміртек байланысында, сутек көміртек атомына қосылып, көбірек сутек санына ие болады деген.
Марковников ережесіне сүйене отырып, көп реакциялардың нәтижесінде қандай қосылыс түзілетінін нақты айтуға болады. Мысалы:
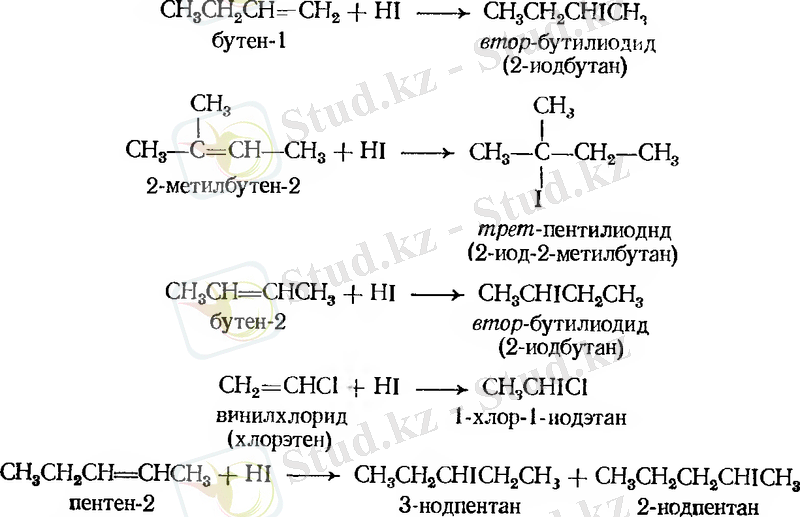
Галогенсутектердің алкенге қосып, алкилгалогенид алуға болады. Қосылу сәйкесінше Марковников ережесімен жүреді.
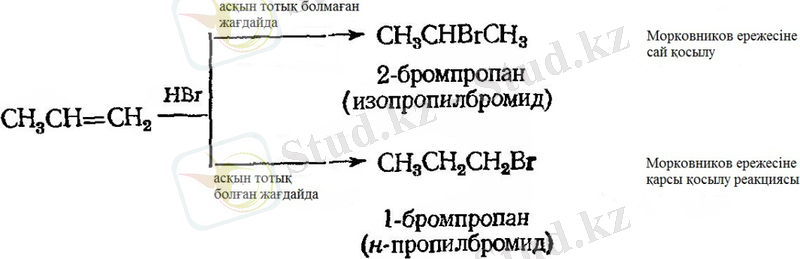
Бромды сутекті қосып алу
Хлорлы және йодты сутектің алкендерге қосылуы Морковников ережесі бойынша жүрсе, 1933 жылға дейін бромды сутектің көріснісі шым - шытырық болды. Бір авторлар бромды сутектің кейбір алкендерге қосылуы Марковников ережесімен жүреді десе, кейбіреулері - бұл ережеге қарсы десе, ал үшіншілері - тіптен осы екеуін де қоса жақтайды. Тіптен реакцияның бағыты жарық сәулесіне тәуелді, судың болуы немесе кейбір металл галогенидтердің болуына тәуелді ме деген пікірлер айтылды. Сонымен қатар реакция бағыты еріткіш немесе реакцияның беттік табиғатына байналысты болады деген де хабар берілген болатын.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz