Молекулалардың электрондық күйлері мен УҚ-ИҚ спектроскопиясының теориясы және қолданылуы


2. 1. Молекулалардың электрондық күйі мен спектрлері
Молекулалардың электрондық күйін сипаттау үшін энергия, толқындық функция, дәреженің төмендеуі, өмірдің мультиплеттілігі мен уақыты қолданылады. Көпатомды молекулалардың электронды спектрлерін тәжірибе жүзінде қарастыру анағұрлым қиын, себебі мұндай молекулалардың еркін тербеліс дәрежесі үлкен мәнге ие болып келеді (жалпы жағдайда 3n - 6) . Жалпы айтканда көп атомды молекуланын электронды энергиясы барлық қалыпты тербелістерге байланысты және оның потенциалды функциясы 3n - 6 кеңістікте көпөлшемді күрделі потенциал беті болып табылады. Әр түрлі класстарға қолдануға болатын, көпатомды молекулалардың электронды спектроскопия теориялары али жок, дегенмен көп жағдайда электронды сызықтардың қанағаттанарлықтай дәлдикпен бағалауға мүмкіндік беретін әр түрлі әдістер ұсынылды (электронды ауысулардың жиілігі, осциллятор күші және т. б) . Көбіне бос электрон моделі, молекулалық орбитальдар әдісінің түрлі нұсқалары мен лигандтар өрісі теориясы сияқты әдістер туралы айтылады. Толқындық функция Ѱ е электрондардың кеңістіктік және спиндік координаттарының фунциясы бола отырып оның электрондық тығыздығының таралуын сипаттайды. Электрондық энергияның мәніне молекуланың нақты электрондық күйіндегі физикалық және химиялық қасиетін көрсететін бірқатар электрондық толқын функциялары сәйкес келеді.
Егер бір электрон күйіне бірнеше толқындық функция сәйкес келсе, онда ондай күйді құлдырау күйі деп атайды, ал құлдырау нәтижесі осындай функциялар санына тең болады.
Молекуланың электрон қабығының әрбір күйі толық орбиталь L және қозғалыс санының спиндік моментімен S сипатталады. Проекция моментінің белгіленген бағыттағы өлшемі сәйкес келетін квант саны Λ маңызды мәнге ие . . . РИМАНЫН НОУТЫНДА
(2. 1)
Мұндағы А n - спонтанды түсу ықтималдығы. Негізінен молекуланың күйі τ 0 = ∞, көп өмір сүретіндер үшін τ n > 10 -4 c, ал қысқа өмір сүретіндер үшін τ n ~ 10 -7 - 10 -9 с.
Молекулалардың электрон күйлерінің ауысулары сәйкес іріктеу ережесін сақтаған кезде ғана орындалады:
∆ Λ = 0, ±1 (2. 2)
Мультиплеттілігі әр түрлі әр түрлі деңгейлер арасындағы ауысуларға тиым салынады:
∆S = 0. (2. 3)
Электронның квантты ауысуы кезінде спиндерінің бағытталуы күмәнді екені айдан анық. Дегенмен молекулаға ауыр атомдарды енгізгенде бұл ереже немесе басқа дәрежеде бұзылады, бұндай бұзылу молекуланың спин - орбиталды әрекеттесуіне қарағанда әлдеқайда күштірек.
2. 2. Молекуладағы электрон ауысуларының классификациясы
Электрон ауысуларын әр түрлі қасиеттеріне байланысты классификациялауға болады. Бұлардың ішіндегі кеңінен таралғаны молекуланың электрон құрылысының оның кванттық сәулені жұту немесе шағылыстыру кезіндегі өзгерісін есепке алатын классификация түрі болып табылады. Осы классификация негізінде оптикалық электрондардың кванттық ауысуға дейінгі және одан кейінгі күйі көрсетіледі, ал бұл спектроскопиялық және квантты - химиялық сәйкестілікті оңай түсінуге мүмкіндік береді.
Молекуланың спектрлі қасиеті құрамындағы валент электрондарының типіне сәйкес жүйеленеді. Жай байланыс түзетін электрондар σ - электрондар, ал қос байланыс түзетіндерді π - электрондар деп атаймыз. Бұдан басқа, молекула құрамында азот, оттегі және т. б. элементтер атомы кездесетін болса, ондай электрондарды буланбаған немесе n - электрондар дейміз. Валент электрондарының барлық үш типін формальдегид мысалында көрсете аламыз:
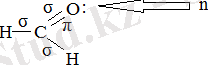
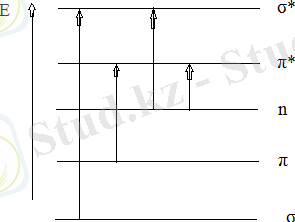
Органикалық қосылыстардағы электрон ауысулары ондағы қатысатын электрон типтеріне байланысты классификацияланады (сур. 2. 1) .
Сур. 2. 1. Әр түрлі молекулалық орбитальдардың энергия деңгейлерінде орналасуы
Негізгі күйдегі байланыстыратын орбитальдардың энергиясы одан жоғары қопсытқыш орбитальға ауысулары мүмкін. Бұл әдетте σ - орбиталь - σ - σ* - ауысулары арасында және π - орбиталь - π - π* - ауысулары арасында болады. σ - σ* - ауысулары УК вакуумды аймағында байқалады. π - π* - ауысулары 180нм және одан жоғары аумақта, бұл жолақта жұтудың жоғары қарқындылығы байқалады.
Әлсіз жұту УК жақын аймағында (200нм жоғары) n - электронның π* қозған күйіне ауысуына сәйкес келеді.
УК сәулесін жұтуға қабілетті электрондардың бірнеше топтарының әрекеттесуі электрон спектрлерінің біршама өзгерісіне әкелуі мүмкін. Мұндай әрекеттесу екі типтің құрылысы арасында үлкен рөл атқарады: π - π - құрылысы құрамында π электрондары бар екі топ қосарланған және n - электроны бар атомда n - π - құрылысында π - электронды топпен көршілес тұрады.
Әдетте π - электрондары барлық қосарланған жүйеде осы және басқа дәрежеде делокализацияланған. Бутадиен сияқты π - π - қосарланған жүйеде жұтылу ұзынтолқынды аумаққа дейін созылған және өте қарқынды.
n - π - қосарланған жүйелер құрамында n - электронының қанықпаған топ - хромофорға қосылуынан пайда болады. Көптеген изолирленген аусохромды топтар алыс УК аймағында қарқынды жұтылса, жақын аумақта жұтылмайды.
Аусохромның хромофорға қосылуы батахромның қозғалысы нәтижесінде жүзеге асады және жұтылу қарқындылығы жоғарылайды.
Қосылыстардың көбі жұтылуы λ>200нм болғанда, π - π не n - π - қосарланған жүйеге ие болады.
Электрон спектрлерінде кем дегенде төрт жолақты ажырата білу керек: К, R, B және Е.
Қосарланған хромофор жүйесіндегі ауысу К жолағымен байланысады. Бұл жолақтар жоғары қарқындылығымен ерекшеленеді(ε > 1) . Әдетте К - жолақтар жалпақ контурға ие болады, бірақ арасында нәзік құрылысты жолақтар да кездеседі.
n - π* - ауысуы изолирленген хромофордағы карбонильді тобы R - жолақтарын байланыстырады. n - π* - ауысуы іріктеу ережесіне тиым салынғандықтан, R - жолақтар аз қарқындылығымен (ε<100) ерекшеленеді. Кейде R - жолақтар нәзік құрылысты болып келеді.
Тағы бір тиым салынған π - π* - ауысулары ароматты сақинада «бензолды» деп аталатын В - жолақпен байланысады. Жолақ нәзік құрылысқа ие бола отырып, орташа қарқындылықпен (ε~100 - 1000) сипатталады.
В - жолағындағы ароматты жүйелер үшін Е (Е 1 және Е 2 ) жолақтары тән. Е 1 - жолағы рұқсат етілген бензолды хромофор π - π* - ауысуларында ультракүлгіннің жақын аймағына тек полиядролы ароматты жүйеде ғана түседі. Бұл жолақтар жоғары қарқындылығымен (ε>1) өзгешеленеді. Е 2 - жолағы әрдайым ароматты жүйелердің спектрлерінде көрінеді, қарқындылығы (ε>2000) тәртіп бойынша неғұрлым ұзынтолқынды К - жолағына орын береді, бірақ кейбір полиорынбасушы бензолдарда Е - және К - жолақтарының қарқындылықтары айналуы мүмкін.
В - және Е - жолақтары бензол ядросының жергілікті қозуына әкеледі және сондықтан әрдайым ароматты қосылыстардың спектрлерінде кездеседі. Спектрде орынбасушы бензол мен К - жолақтарының пайда болуы, онда бензолды ядросы бар қосарланған хромофордың барын көрсетеді.
Молекуланың химиялық құрылысы, әсіресе хромофорлы топтардың қосарлануы жолақтардың толқын ұзындықтары және жұту қарқындылығын өзгертеді. Ал бұл алынған спектрлерден молекуланың құрылысы жайлы бағалы ақпарат алуға мүмкіндік бар.
Электронды спектрлердің қолданылуы
Құрамында еселі қосарланған байланыстар бар қосылыстар УК аймақта жұтылуы, қосылыс құрылысы туралы басқа физикалық зерттеу әдістеріне белгісіз мәліметті алуға мүмкіндік береді.
П. 1 - П. 8 кестелерінде маңызды ауксохромдар, хромофорлар мен ауксохромды және хромофорлы топтар қосындысы болып табылатын структуралық элементтер туралы сипаттамалар көрсетілген.
Құрамында ауксохромды тобы бар қанныққан көмірсутектер гетероатом табиғатына байланысты жұтылу жолақтарымен ерекшеленеді. Спирттер, жай эфирлер мен алкилхлоридтер жақын УК-де мөлдір. Аминдер, алкилбромидтер, меркаптандар мен сульфидтер жақын УК-да жұтылады (200-20нм) . Алкилиодидтер спектрде салыстырмалы түрде орташа интенсивті ұзынтолқынды аймақтағы жолаққа ие.
Барлық изоляцияланған хромофорлар π - π * ауысу нәтижесінде жұтылады, ал құрамында гетероатомы бар хромофорлар n - π * қозған күйіне ауысу есебінен де жұтады. π - π* ауысу жолақтары жоғары интенсивтілікке ие Е (4000-12000), бірақ алыс УК аймақта (180-200нм) орналасқан, сондықтан құрылыстық кореляцияға қолдану ойлап табылмады.
Құрамында кем дегенде бір гетероатомы бар жекеленген хромофорлар жақын УК аймақта аз интенсивті R - жолақтарының пайда болуымен сипатталады. Карбонил құрамды қосылыстар қатарында альдегидтер мен кетондар карбон және туынды қышқылдарға қарағанда ұзынтолқынды аймақта жұтады. Мысалы, λ мах (ε) қатарда: ацетальдегид - 290 (17), ацетон - 211 (58) . Алифатты азометиндер сәйкес альдегидтер мен кетондарға қарағанда толқын ұзындығы аз және ε шамасының жоғары мәнінде жұтады.
Диендер мен полиендердің аллилді және ауксохромды орынбасуға спектральді параметрлердің тәуелділігі Физер-Вудворд ережісімен жалпыланған. Қосарланған полиендер қатарында қосарлану байланысының бір олефинді байланысқа жоғарылауы жолақтардың күшті батохромды ығысуы мен интенсивтіліктің жоғарылауына әкеледі. Триеннан бастап полиендердің жұтылу жолағы жұқа тербелмелі құрылысты табады.
Қосарланған альдегидтер мен кетондар жақын УК аймақта екі жұтылу жолағымен сипатталады: К мен R - жолақтары. Қосарланған альдегидтер мен кетондардың ауксохромды орынбасу нәтижесінде К - жолақтарының ығысу заңдылықтары П2. кестесінде көрсетілген.
Бензол үш жұтылу жолақтарына ие: Е 1 -, Е 2 -, және В - жолақтары, λ мах нм және (ε) спектральді сипаттамалары сәйкесінше 184 (68000), 204 (8800), 254 (250) .
Бензолдың туындыларына өту барысында осы жолақтардың батохромды ығысуы байқалады, сонымен қатар оларға Е - жолағының интенсивтілігің жоғарылауытән, біршама ығысулар көпядролы ароматты жүйелер қатарында болады. (кесте П. 7. )
Ароматты ядроға тікелей қосылған, құрамында хромофорлы және күшті ауксохромды орынбасушылар бар, орынбасқан бензол спектрлерінде қосымша интенсивті К - жолақтары бар. (кесте п. 8)
Фуран мен пирролда таңдаулы жұтылу 207-338 нм-де болса, ал тоифенде 23 нм-ге дейін ығысқан. Бензолға карағанда бесмүшелі ароматты гетероциклдарда, бензол сақинасының В жолағы пайда болады, ұзынтолқынды аймақта таңдаулы жұтылу байқалмайды.
Пиридин мен оның туындыларының УК спектрлері бензоидті ароматика спектріне ұқсайды. Пиридиннің өзі УК жақн аймағында бензолдың Е және В - жолақтарына сәйкес екі жолақтардың интенсивтілігі бензолға қарағанда көбірек. Сонымен қатар пиридин спектрінде осы гетероциклге тән n - π* ауысу жолағы бар.
Полиендердің λ мах болжаудың қарапайым әдістері Физер мен Вудвордпен ұсынылды (кесте П. 1)
Физер-Вудворд ережелері негізінде орынбасушы табиғаты мен орынбасу дәрежесімен айырылатын, құрамында бір қосарланған хромофорлары бар, альтернативті құрылыстың ішінен дұрысын таңдау мысалдары көп. Мысалы, изофорон мен 1-ацетил-2-метил-1-циклогексан сияқты изомерлері карбонилді қосылыстың λ мах айырмашылықтары жақсы болжамады.
Сондай ережелер карбонилді қосылыстар үшін және ароматты карбонилді қосылыстар үшін Скотт ережесі бар.
Келесі ароматты кетондардың К-жолақтарының λ мах айырмашылығын айқындаудың эмпирикалық ережелердің күші сенімді.
Молекуланың құрылысы жайлы мәліметтерді Ук спектрден алу қиындықтар қатарынан тұрады. Ерітіндідегі молекулалар үшін УК аймақтағы жұтылудың шыңдары кең (шыңдар кеңдігі бірнеше ондық нм), және сондықтан сол аймақта жұтылатын қоспалар спектрді бұрмалайды. Ук аймақта жұтылу спецификасы төмен, яғни көптеген хромофорлардың жұтылу жолақтары жабылады, сондықтан УК спектрлерді органикалық қосылыстың құрылымын анықтау кезінде қосымша зат туралы мәліметті қолдану қажет.
Қосымша мәлімет сипаттамасына байланысты барлық шарттар үш топқа бөлінуі мүмкін:
- Брутто-формуласы ғана белгілі, құрылысы біржақты анықтау тек салыстырмалы қарапайым молекулалар, және бағаланған құрылысты таңдаумен шектелу қажет.
- Пайда болуы, синтезі мен қосылыстың айналуы жайлы мәлімет белгілі (әдетте брутто-формулаға қосымша) . Осы қорытындыдан УК спектр негізінде қосылыстың құрылысы, қосымша химиялық мәліметтер интерпритациясы жеткілікті түрде нақты болуы мүмкін,
- Қосымша мәлімет көлемі мен мағынасы ауқымды, сондықтан тек бірнеше альтернативті құрылыстың біреуін таңдау қажет.
Қосымша мәліметтің болмауы салдарынан хромофорлы топтар мен табиғаты жайлы тек жалпы мәлімет беріледі.
УК спектр заттың құрылы туралы маңызды мәлімет бергенімен, бұл мәлімет әрқашан нақты бола бермейді.
Инфрақызыл спектроскопия
Қазіргі замаңғы ИҚ спектроскопия маңызды және ең кең таралған физикалық зерттеу әдістеріне жатады. Жоғары спецификалығымен ерекшеленетін ИҚ спектрлер қосылыстарды идентификациялау, заттың сандық, сапалық анализін, химиялық реакцияның кинетикасы мен механизмін зерттеу, жаңа қосылыстардың құрылысын анықтау үшін қолданылады.
- ИҚ спектрлердің пайда болуы
Молекулалардың ИҚ спектрлері - тербелмелі, айналмалы деңгейдің арасындағы электромагнитті сәулелену салдарынан энергетикалық ауысулар нәтижесі болып табылады. Бұл ауысулар энергиясы бойынша 0, 4 -тен 140 КДж/мольге дейін айырылады. ИҚ аймақта жақын 0, 8-ден 2, 5 мкм (12500-4000см -1 ) , диапазонда электронды және тебелмелі ауысулар болады; негізгі немесе орташа ИҚ аймақ 2, 5-тен 10 мкм-ге дейін (4000-625см -1 ), негізінен молекулалар тербелісімен байланысты, 16-дан 210мкм (625-50см -1 ) ИҚ аймақ айналмалы ауысулар, ауыр молекулалар тербелістері, күрделі молекулалада қаңқалы-деформациялық тербелістер, мысалға, биополимерлерде болады. Қазіргі кезде сериялы құралдар жұмыс істейтін орташа ИҚ аймақ спектроскопиясы жақсы дамыған.
Молекула қасиеті мен ИҚ спектрін байланыстыру үшін, ядро орталықтарын қосатын тепе-теңдік атомдар ядролары сызық тұсындағы тербелетін, екіатомды молекуланы қарастырайық. Молекуланың тербелісі оның айналуымен қатар жүреді, дегенмен бұл қозғалыстарды бөлек қарастыруға болады, себебі бір тербеліс уақытында молекула толық айналып бітпейді. Егер ядролардың тепе-тендік күйден ығысуы аз болса, онда олар Гукк заңына бағынып, гармоникалық тербелістер деп аталады. Бұл уақытта Е молекулаларының потенциалды энергиясының тербелісінің энергиясымен болуына ғана рұқсат етіледі:
E = hcν (υ + 1/2) (3. 1)
Мұндағы h - Планк тұраақтысы; с - жарық жылдамдығы; ν=1\λ - толқын саны; ν - квант саны (ν=0, 1, 2, 3 . . . ) .
ν=0 сәйкес келетін екіатомды молекуланың тербеліс жиілігі келесі теңдеумен беріледі:
(3. 2. )
мұндағы ʄ - байланыстың күш тұрақтысы; μ - келтірілген молекула массасы; осыдан атомдар массасының м 1 мен м 2 өсуі немесе арасындағы байланыстың әлсіреуі тербеліс жиілігін төмендетеді.
Кванттық ИҚ сәулеленуді жұтуынан Е ν күйден Е ν+1 күйге ауысады. Гармоникалық осцилятор үшін іріктеу ережесі тек Δν=1 ауысуда жағдайында ғана рұқсат етіледі. Жылулық тепе-теңдікте тербелмелі деңгейлердің әрқайсысында болатын біршама молекулалар саны Больцман заңымен анықталып, шамаға пропорционал болады.
(3. 3. )
Мұндағы: к - Больцман тұрақтысы. Бөлме температурасында және энергиясы 12 кДж/моль молекулалық тербеліске тән ν=1 деңгейінде молекулалардың 1% болса, ал ν=2 деңгейінде 0, 01% дан көп емес. Сондықтан, қарапайым жағдайда барлық молекулалар ең төмеңгі тербеліс деңгейінде ν=0 орналасады, және ИҚ сәулені жұтуда тек бір ауысу ν 0 →ν 1 мүмкін.
Шын мәнінде, екіатомды молекуладығы ИҚ спектрлерде осы негізгі сызықтан басқа, тағы басқа жиіліктері төмен сызықтар пайда болады. Яғни, реалды молекула тербелістері қатаң гармоникалық емес, Е ν өсуі бойынша ангармоникалық өседі, жне энергия потенциялдың қисығы күрделі тәуелділікпен сипатталады (сурет 3. 1. ) . Бұл тәуелділік Морзе функциясымен нақты сипатталады:
2 (3. 4. )
Мұндағы: r e - тербелетін атомдардың арасындағы тепе-теңдік; D 0 - молекуланың екі атомға диссоциясына сәйкес потенциал энергиясы болып табылады.
Ангармоникалық осциляторда энергетикалық деңгейлер квантталады, бірақ олардың арақашықтығы тұрақты емес, және ν өсуімен төмендейді, ал іріктеу ережелері бұзылады. Сондықтан реалды екіатомды молекулаларда 2ν, 3ν және т. с. с. жиілікті жолақтардың пайда болады, олар ν 0 →ν 2 , ν 0 →ν 3 ауысуларына сәйкес келеді, оларды абертондар деп атайды.
Энергиялары 4, 18кДж/мольден төмен емес төмеңгі тербелмелі жиіліктер үшін (мысалы, ауыр металдар атомдарының қатысуымен тербелу) жоғарғы энергетикалық деңгейлердің толуы бөлме температурасына сәйкес келеді. Осылайша, ν=200см -1 мен Т=300К жоғары тербелмелі деңгейдегі молекула саны төмеңгі деңгейдегі молекулалар санының 40% құрайды. Сондықтан алыс ИҚ аймақта жоғары тербеліс деңгейдегі ауысулар нәтижесінде туындайтын «ыстық жолақтардың» пайда болады. Мұндай жолақтардың интенсивтілігі зерттелетін заттың температурасы төмендегенде төмендеу керек.
Кинетикалық энергия квантталмаса, энергия жұтылумен Е > D 0 ауысуларда, энергия кез-келген мәнге ие бола алады. ИҚ спектрде оған сызықты жұтылудан тұтас жұтылуға ауысу сәйкес келеді.
Тұтас жұтылуға сәйкес жиіліктен молекулалық диссоциацияның энергиясын анықтау оңайға түседі. ИҚ сәулеленуді жұтуда тербелмелі деңгейлер арасындағы ауысуларға рұқсат ету ИҚ спектроскопияның маңызды іріктеу ережесі болып табылады. ИҚ спектрде тек молекуланың электр зарядының орталығының ығысуы, яғни диполь моментінің өзгеруі жүретін тербелістер ғана белсенді. Сондықтан СО, NО, НСl молекулаларының ИҚ спектрлері көренеді, ал симметриялық Н 2 , N 2 , Сl 2 молекуласының ИҚ спектрлері көрінбейді.
Жоғары тербелмелі деңгейлерге ауысу салдарынан пайда болатын молекула энергиясы, қозған молекуланың айналадағы молекулалармен соқтығысу салдарынан айналатын, барлық зат бойынша таралады. Төмеңгі тербелмелі деңгейлердің сәулеленуі кезінде толуы болмайды, және ИҚ спектрлерде қанығу байқалмайды.
Берілген тербелмелі ауысуға тұрақты анықталатын энергия емес, тек энергия интервалы сәйкес келеді. Бұл тербелмелі күймен қатар айналмалы ауысулар да өзгеруі мүмкін болғандықтан айналмалы деңгейлер де квантталады, бірақ арақашықтық тербелмелі деңгейлерге қарағанда төмен; соған сәйкес тербелмелі спектрде жіңішке жолақ емес, жіңішке айналмалы құрылымды, газды заттар спектрлерінде айқын көрінетін, жалпақ жолақтар болады.
Қарастырылған екіатомды молекуланың тербеліс заңдары көпатомды молекулалар үшін де қолданылады. Көпатомды молекулаларда, атомның центрлерін қосатын ось тұсындағы тербелістерінен басқа, байланыстар арасындағы бұрыштың өзгеруі де жүреді. Бірінші тербелістер - валентті, екіншісі - деформациялық деп аталады. Негізінен, реалды молекулалар күрделі тербелмелі қозғалыстар жасай алады, дегенмен оларды қарапайым тербелістердің қабаттасуы деп қарастыруға болады. Сызықты емес п-атомды молекуладағы тербелістердің жалпы саны 3п-6 - ға тең және молекуланың күрделенуімен өседі. Салыстырмалы түрде қарапайым бензол молекуласы 30рет тербеледі. Жалпы жағдайда, әр тербеліске тербелмелі спектрде өз жолағы жауап береді. Дегенмен, барлық тербелістер көріне қоймағандықтан, спектрді күрделендірмейді. Мысалы СО 2 сызықты молекуласы үшін 3п-5=4 тербелмелі дәреже бар. Бірақ екі деформациялық тербеліс айқындалатын, яғни жалпы жағдайда олар бірдей, тек кеңістікте бағытталуы ғана (олар бір-біріне перпендикуляр екі жазықтықта туындайды) . Сонымен қатар симметриялық валентті тербелісте 1345 см -1 жиіліктегі бұл молекуланың тербелуі диполь моментін өзгертпейді, яғни ИҚ спектрде тербеліс белсеңді емес. Сонымен СО 2 молекуласының спектрінде тек екі негізгі тербеліс жиіліктері байқалады. Сондықтан бұдан да күрделі молекулалар спектрлері қарапайым болады. 3. 2. суретте метилен тобының барлық типтері көрсетілген.
3. 2. ИҚ - спектроскопиясының қолданылуы
ИҚ - спектр әр заттың өзіндік сипаттамасы болып саналады және заттарды анықтауда қолданылады. Екі зат ИҚ - спектрлерінің дәлме - дәл келуі, осы екі заттың бірдей екенін көрсетеді.
Көптеген жиіліктер молекула күрделі ішкі тербелістерінің әрекеттесуінің нәтижесінде үлкен арақашықтық аралығында өзгеріп отырады. Бірақ кейбір сіңірулер қарапайым тербелістерді де көрсете алады. Мысалы: ОН, ОN және СО топтарының валенттік тербелістері спектрдің белгілі бір шектелген аумақтарында ғана көрінеді. Молекула құрылысындағы маңызды бөлшектерді осындай шектелген аумақтардан табу оңайға түседі. Сіңіру жолақтарының аумақтарының ауысуы немесе оның контурының өзгеруі молекула маңайындағы өзгерістерді де көрсетеді, сонымен бірге құрылысы туралы да маңызды мәлімет бере алады.
Алғашқы зерттеулер барысында ең маңызды 2 аумақты білу қажет: 1300 - 4000, 550 - 900 см -1 . Спектрдің жоғары жиілікті бөлігі функционалдық топшалар аумағы деп аталады. Спектрлердің бұл аумақтарында ОН, NH, CO функционалдық топтардың валенттік тербеліс жиіліктерінің сипаттамасы болып табылады.
Қандай да бір функционалдық топ сіңіру жолағының байқалмауы - молекулада осы топшаның жоқ екендігінің дәлелі болып саналады. Бірақ бұндай талдауларды кейбір құрылыстық ерекшеліктер сіңіру жолағын әлсіз немесе жалпақ қылып жіберетіндіктен көрінбей қалуы да мүмкін болғандықтан мұқият қараған жөн.
Мысалы, басқа жақтармен жасырынған ацетилацетонның енольдық формасындағы ішкімолекулалалық сутектік байланысы әлсіз жалпақ ОН жолағын көрсетеді.
1540 - 1800 см -1 аумағында жолақтар болмауы карбониль тобы бар құрылысты молекулаларды алып тастайды. S - H және СО функционалдық топтарының негізгі тербелістері құрылыстық анализ кезіндегі маңызды жоғары жиілікті аумақта әлсіз жолақтар береді. Ароматты және гетероароматты қосылыстар.
Көміртегі қаңқасының күшті тербеліс жолақтарын 1100 - 1500см -1 аумағында көрсетеді.
550 - 900см -1 аумағында сіңіру жолағының болмауы ароматты емес құрылысты көрсетеді. Бірақ ароматты және гетероароматты қосылыстарда бұл аумақта күшті сіңіру жолақтары көрінеді, олар С - Н жалпақ емес деформациялық тербелістерімен және циклдің деформациялық тербелістерімен байланысты.
Жалпақ нақты қарқындылығымен сіңіру жолақтары төменгі жиілікті аумақтағы карбоксил тобындағы димерлері, аминді және амидті топшалардың бар екендігін дәлелдейді.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz