Пента- және гексациклофосфаттардың синтезі, идентификациясы және d-элементтер (Mn, Fe, Co, Ni, Cu, Zn) қатысындағы судағы комплекстік түзілуі мен тұрақтылық константалары


Мазмұны
- Циклофосфаттардың құрылысы, құрылымы, кұрамы және касиеттері
Кіріспе
Зерттеудің өзектілігі. Қазіргі таңда ғылыми зерттеулерде конденсирленген фосфаттар химиясына аса қызығушылық бөлінуде. Тізбекті, циклді және тармақталған фосфаттардың құрамында Р-О-Р байланысының болуы оларды жоғарғы физико-химиялық касиетімен камтамсыз етеді. Өзінің құрамында шеткі, орталық РО 4 -тетраэдр және тармақталу нүктесінің арқасында алдын ала болжау касиеті бар косылыстарды синтездеу және көптеген бейорганикалық химия бөлімінде бұдан бұрын жауабы табалмаған сұрақтарды шешуге фосфаттардың молекулалары перспективті объект болып табылады. Р-О-Р байланысының болуына қатысты конденсирленген фосфаттардың үш классын біріктірсек, ал олардың ортақ салыстырмалы қасиеті - гидролитикалық ыдырау кабілеті. Конденсирленген фосфаттардың казіргі уақытта пайдалы жақтары өте көп (ингибитрлік, комплекс түзу қабілеті т. б) және өнеркәсіпте қолдауға перспективті болып табылады (синтетикалық жуғыш заттар), су, сулы-мұнай жүйесінде және басқа да салаларда маңыздылығы зор. Сонымен қатар, олардың құрылымы мен құрылысының әртүрлілігі оларды бейорганикалық полимер ретінде байланыстырушы фосфаттар, ыссыға төзімді материалдар, люминофорлар, арнайы дайындалатын әйнектер, катализаторлар, тыңайтқыштар сияқты кең аумақта пайдалануымызға мүмкіндік береді. Конденсирленген фосфаттардың әрі қарай дамуы жаңа заттарды синтездеумен, олардың физико-химиялық қасиеттерін зерттеумен және соның ішінде құрылымын, құрылысын зерттеп практикада қолдануға ұсынылуымен байланысты. Циклді фосфаттар мен ауыспалы металдардың комплекс түзілуі толық зерттелмеген. Сондықтанда модифицерленген циклді фосфаттарға d- элементтендің әсері, комплекске түзілу заңдылықтары осы жұмыстың өзекті мәселесі. Осы салада жүргізілген зерттеулерден фосфаттар туралы мәліметтер соның ішінде катион модификаторларға (радиус, ионизация потенциалы, полямиризациялану потенциалы, гидратация жылуы, акцепторлі қасиеттер), және фосфат анионының структураларына фундаментальды сипттамалар жоқтығын көруге болады. Бұл жұмыс конденсирленген фосфаттардың су ертіндісінде жоғарыда белгіленген қасиеттері бар қосылыстарды алуға және комплекс түзу процессі заңылықтарын қарастыруға негізделген.
Зерттеудің мақсаты. Циклофосфат косылыстарының модифицирлену процессін және Mn, Ni, Fe, Cu, Co, Zn иондарымен комплекс түзу заңдылықтарын қарастыру.
Міндеті:
- циклофосфаттарды синтезу және анықтау;
- Циклофосфаттардың тұз ерітінділерінің d-элементтердің қатысында комплекс түзілу процесін әр түрлі әдістермен зерттеу: мольдік қатынасты әдісі және изомолярлық қатынас әдісімен зерттеу;
- Пента-, су ертінділерінде Mn, Fe, Co, Ni, Cu, Zn тұздарының иондық күшке, фосфат анионнының және металл- модификатор табиғатына, компоненттердің катынасына байланысты тәуелді әрекеттесуін зерттеу;
- циклофосфатты комплекстердің құрамы мен тұрақтылығын анықтау;
- ИК- спектроскопиялық және спектрофотометриялық анализін өткізу;
1. Әдебиетке шолу
- Циклофосфаттардың құрылысы, құрылымы, кұрамы және касиеттері
Э. Тило мен Ван Везердің ұсынылған еңбектерінде конденсирленген фосфаттарға РО 4 тетраэдрлерінің шыңыларының өзара байланысуынан пайда болған Р-О-Р байланысы бар фосфор оксиді (V) жатады. Фосфат тетраэдрінің орналасуы бойынша конденсирленген фосфаттар келесі топшаларға бөлінеді:
Шеткі (тетраэдр көршілес ортақ щыңды тетраэдрмен байланысқан) екі теріс заряды бар
O
║
- O ─ P ─ O ─
│
O -
Ортаңғы (тетраэдр екі көршілес ортақ шыңмен байланысқан) бір ғана теріс заряды бар;
O
║
─ O ─ P ─ O ─
│
O -
Тармақталу нүктесі (үш тетраэдр шыңдары РО 4 көршілес тетраэдрлермен байланысқан) зарядталмаған.
O
║
─ O ─ P ─ O ─
│
O
│
Осы үш топшаға сәйкес конденсирленген фосфаттардың үш гомологтық қатарын алуға болады:
1. Полифосфаттар ортаңғы топшалардың екі шеткісімен топтасу нәтижесінде пайда болады. Құрамындағы анион тізбек түрінде кездеседі. Ортақ формуласы
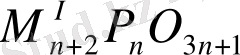 , ал егер n → ∞ болса, онда полифосфаттар циклдік фосфаттарға сай келеді.
, ал егер n → ∞ болса, онда полифосфаттар циклдік фосфаттарға сай келеді.
2. Циклдік фосфаттар немесе метафосфаттар, олардың анион сақина түрінде кездеседі және бірнеше ортаңғы топшалардың топтасуы нәтижесінде пайда болады. Жалпы формуласы
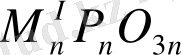
3. Тармақталған полимерлер (ультрафосфаттар), оған тармақталу нуктесі жатады. Кристаллдық күйге айналған ультрафосфаттардың жалпы формуласы
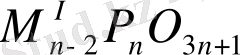
Конденсирленген фосфаттардың кез келген құрылымдық топшасының құрамдық жалпы формуласы
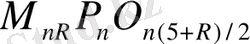 . мұндағы М-катион эквиваленті (металл немесе сутек) ; n - берілген қосылыстағы фосфор атомының саны; R-мольдік қатынас M
2
O/P
2
O
5
.
. мұндағы М-катион эквиваленті (металл немесе сутек) ; n - берілген қосылыстағы фосфор атомының саны; R-мольдік қатынас M
2
O/P
2
O
5
.
Металл мен фосфат оксидтерінің мольдік катынасы фосфаттардың жалпы сипаттамасы болып табылады. Осы сипаттама олардың кандай топқа жататындығын формальді түрде анықтауға мүмкіндік береді.
Егер R=0 болса, онда формула P
n
O
5n/2
немесе (P
2
O
5
)
n/2
айналады, яғни кез келген полимер пентаоксидінің формуласына. Егер R=1 болса, онда жалпы формула циклофосфаттардың формуласына M
n
P
n
O
3n
айналады. Ал R = (n+2) /n болған жағдайда, онда сызықтық полифосфаттарды сипаттайтын түрге ауысады
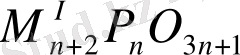 .
.
Циклдiк фосфаттар - барлық сақиналы аниондардың құрамы циклофосфаттарға сай келеді P n O 3n , яғни мұндағы n кез келген мәнде бола алады. Моноциклофосфат ионы (n = 1 ) қысқа уақыт аралығында жоғары температуралық ауысуларда немесе фосфорландыру реакцияларында бола алғанымен, ұзақ уақыт өмір сүре алмайды. Дициклофосфат ионда тетраэдрлардың ортақ қабырғасы өте қозыған күйде орналасуы мүмкін, бірақ оның бар жоғы әлі күнге дейін белгісіз. Кейбір әдебиеттерде моноциклофосфаттар мен дициклофосфаттарды алудың талпыныстарының қатары сипатталған [1-2] . PO 4 - тетраэдрлердің n мәнi 3 пен 8-дің аралығындағы циклдiк аниондар теңестiрiліп және тұздары ерекшеленген болатын. Кейбiр циклофосфаттардың түрлерiнiң қоспаларының құрамында үлкен сақиналар болатындығы белгілі.
Циклофосфаттардың сақиналарының кұрылымдық формалары тұз кристалдарының рентген анализ әдісімен айқын дәлелденген [3] . Циклофосфаттарды ерiтiндiде сызықтық полифосфаттардан бірнеше әдістермен ажыратуға болады:
а) Қағаз бетінде екi өлшемдi хроматография әдісімен. Тиiстi қабылдаулар екi топтамалардың төменгi мүшелерiн бөлуге мүмкiндiк бередi;
б) ЯМР - спектроскопиямен әдісімен. Циклдiк фосфаттар бiр-ақ сипаттамалық ең жоғарғы нүктесін көрсетеді 31 P. Сызықты полифосфаттардың екі түрлі қоршалады: шеткі және циклді РО4 группаға сәйкес олар кем дегенде екi резонанстық жоғарғы нүкте бередi;
в) Қышқылдардың күшiмен. Ашытылған циклофосфаттар гидролитикалық ыдырау процесс кезінде бір негізді күшті қышқылдық касиет көрсетеді, ал полифосфаттар бірнеше негізді қышқылдар сияқты үш сатылы диссосацияға түседі.
г) Төменгі циклофосфаттар полифосфаттардан ерекшелігі олардың тұздарының жоғарғы ергіштігі, комплекстүзуге жарамсыздығы және сілтілік гидролиз процессіне тұрақсыздығы.
1. 2 Конденсирленген фосфаттардың химиялық қасиеттері
Қышқылдық негіздік қасиеттері. Сілтілік құрамды фосфор қышқылдарының құрамында екі түрлі сутек атомы бар екендігі барімізге мәлім. Әр бір соңғы топшаның бір протоны әлсіз қышқыл ретінде (K ≈ 10 -7 - 10 -9 ), ал қалғаны күшті кышқыл ретінде (K > 10 -3 ) диссоцацияланады. Осыған сәйкес тізбекті қышқылдардың потенциометрлік титрлеу қисығында екі потенциал секірісі суреттеледі, осы потенциометрлік титрлеу нәтижесінің мәліметтерінен полифосфаттардың молекулалық массасын немесе тізбектің орташа ұзындығын табуға болады.
Тізбекті полифосфор қышқылдарының - дифосфор қышқылы екі түрлі сусыз кристалдық формада бола алады, ал оның балқу температурасы 54, 3 және 71, 5 0 С сәйкес келеді. Әдетте дифосфор қышқылының таза ертіндісін натрий тұзының ион алмасу әдісі немесе ергіштігі төмен қорғасын тұзына күкірт сутек ерітінісімен әсер ету нәтижесінде алуға болады:
Pb 2 P 2 O 7 +2H 2 S → H 4 P 2 O 7 +2PbS (1)
Балқытылған қышқыл орто-, ди- және одан да жоғарғы фосфор қышқылдарына тез ауысады [4] . Дифосфор қышқылы екі күшті қышқылы және екі әллсіз қышқылының сутек атомы секілді константа диссоцацияға ие, сонымен қатар күшті қышқыл түзуге бейім (таблица 2) .
Гомологтық қатардың келесі мүшесі- трифосфор қышқылы H 5 P 3 O 10 , ал бұдан жоғарғы полифосфор қышқылдары жеке кристалдық күйде бөлінбеген, бірақ жақсы сипатқа ие тұздары бар. Тепе теңдік аралас тізбекті полифосфор қышқылының 18% трифосфор қышқылы, ал таза өнімнің ерітіндісі натрий тұзының 0 o C катионды алмасу әдісмен алынады.
Р 2 О 5 тің концентрациясы жоғары болған кезде көп көлемде алынатын оксиқышқылы созылғыш болады, ал Р 2 О 5 тің концентрациясы 90% жоғары болса онда өнім әйнек тәрізді күйге айналады.
Кесте 1- Фосфор қышқылдарының диссоциация константасы [4]
Негізінен циклдік фосфаттар күшті қышқылдардың тұздары болып саналады. Салыстырмалы түрде жоғарғы молекуласын, мысалға циклогексафосфор қышқылын сілтімен потенциометрлік титрлеу нәтижесінде титрлеу қисығында бір ғана секіріс белгіленеді, рН≈ 7, 0.
Циклді фосфор қышқылының молекуласы Н n P n O 3n (H 2 O/P 2 O 5 = 1, Р 2 О 5 = 88, 7%) шексіз тізбекті. Құрамында Р 2 О 5 > > 88, 7% бар қышқылды тіпті аралас ерітінді түрінде бөліп алу қиынға соғады, өйткені оның құрылысы жай тізбекке қарағанда күрделірек, сонымен қатар оның құрамында ультрафосфаттар да болуы мүмкін.
Суйытылған барлық конденсирленген оксиқышқылдарының гидролизінің соңғы формасы ортофосфор қышқылы болып табылады, бірақ гидролиз жылдамдығы температураға және қосалқы заттарға тікелей тәуелді. 25 о С та конденсирленген өнімдерден оксиқышқылдардың түзілуне бірнеше күн немесе ай кажет, ал 100 о С гидролиз бірнеше минутқа созылады.
Суйытылған ерітінділерде полифосфат тізбегіндегі әр бір РО 4 топшасына бір ғана күшті қышқылды сутек атомы сәйкес келеді. Іс жүзінде қышқылдың құрылымын Н n+2 Р n O 3n+1 белгілейді, сондықтан әрбір тізбектің соңында салыстырмалы түрде әлсіз ионданған сутек атомы болады.
Хелатты қабілеті. Полифосфаттардың хелатты қабілетін поливалентті катиондардың ергіштігі төмен қосылыстарды түзуге жол бермейтіндігінен, сонымен қатар поливалентті катионы бар тұңбалардың пептизациланыуна алып келуінен көруге болады. Сонымен, натрий трифосфаты кальций ионының 10-11 % және магний ионының 6, 4 % біріктіре алады (oлардың ортақ құрамынан) . Әйнек тәрізді фосфаттар кальцийдің 12-18 % немесе 2, 9-3, 8 % магнийдің біріктіре алады. [5] .
Әйнек тәрізді фосфаттар калций ионына, трифосфат магний ионына, ал дифосфат темір ионына хелатты қабілеті жоғары. Егер ерітіндіде фтор ионы болса, онда бұл фосфаттар комплекстүзуші қабілет бірдей. [6] .
Барлық полифосфаттар металл катиондарын ерітіндіде ұстап және оларды тығыз байланыстыратын өте күшті комплекстүзушілер, сонымен катар кристалдардың бетіне адсорбирлену арқылы олардың өсуін тежейді. Полифосфаттардың осы қасиеті таттану процессіне қарсы тұратын қару ретінде қолданылады. Осы салада полифосфаттардың ішінде ең көп қолданылатыны натрий триполифосфаты және Грэм тұзы.
Сулы ерітіндіде полфосфаттар ерітілген ионалмасу смоласы секілді қасиет көрсетеді. Сонымен Грэм тұзы шамамен 30 % қа диссоцииоланады, ал қалған анионның теріс заряды жоғары болғандықтан, ол натрий ионын ұстап тұрады. Поливалентті металл катиондары натрий ионнын жеңіл бөліп шығарып ион алмасу смоласы секілді макроанионмен сорбирленеді. Ал ди трифосфаттарға келсек олар электостатикалық әрекеттесумен қатар аз диссоцирленген шеткі топша аниондарымен комплекске түседі.
Кейбір металдар полифосфаттардың гидролитикалық ыдырау процессін тездетіп комплекс түзеді. Осыған орай, каталитикалық әрекеттесу дәрежесі түзілген комплекстің кұрылысы мен құрамына тәуелді әр түрлі болатындығын болжауға болады.
Әр түрлі металлдар қатарының тізбекті және сақиналы фосфаттармен комплекстүзу процессі түрлі әдістермен зерттелген [7], олардың ішінде көшілігі сапалы нәтижелер береді. Ауыспалы металдар күшті комплекс түзушілер болып табылады, жалпы алғанда металл ионының заряды өскен сайын комплекстүзу дәрежесі да өседі. Сақиналы фосфаттардың құрамындағы фосфор атомының саны тізбекті фосфаттардікімен бірдей болса да, олар тізбекті фосфаттармен салыстырғанда комплекс түзу процессіне бейімшілдігі аз.
Комплексті қосылыстардың мықтылығы жоғарыда айтылғандай көптеген факторларға тәуелді: катион табиғатына, модификаторға, лигандтың өзінің табиғатына, температураға, ерткішке, диполь моментіне және т. б. . Темір ионымен трифосфатқа қарағанда дифосфат аниондарының комплекс түзу қабілеті жоғары [8] .
Темірдің дифосфат ионымен ергіштігі төмен өте мықты комплекс түзу қабілеті тұрмыстық және өнеркәсіптік металл су құбырларының коррозияға ұшырауына қарсы колданылады.
Циклдік фосфаттардың аниондарының өлшемі кішкентай болғанымен, олардың заряды жоғары болады, мысалға P
 O
O
 , ал металдармен комплексі әлсіз, бұдан, комплекс түзу реакциясына сақинадағы функционалды топшаларының қозғалғыштығы төмен болатындығын көруге болады. Зарядтың өсуі және бөлек анион фрагменттерінің қозғалғыштығының нәтижесінде циклофосфаттардың ірі циклге ауысуы - P
, ал металдармен комплексі әлсіз, бұдан, комплекс түзу реакциясына сақинадағы функционалды топшаларының қозғалғыштығы төмен болатындығын көруге болады. Зарядтың өсуі және бөлек анион фрагменттерінің қозғалғыштығының нәтижесінде циклофосфаттардың ірі циклге ауысуы - P
 O
O
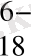 и P
и P
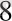 O
O
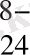 , оның комплекстүзу қабілетін лезде жоғарлатады.
, оның комплекстүзу қабілетін лезде жоғарлатады.
Циклофосфаттардың полифосфаттардан ерекшелігі - циклофосфаттардың молекуласындағы фосфор атомының саны көп болса олардың тұрақтылығы да жоғары болады. Сонымен, P
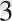 O
O
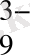 анионынан P
анионынан P
 O
O
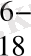 анионына ауысуындағы сақинаның жартылай ыдырау уақыты 4, 5 дан 1000 дейін өседі ( 60
0
C, 0, 1н. NaOH) . Сілтілік гидролиз нәтижесінде сақина бұзылып, полифосфат түзіледі.
анионына ауысуындағы сақинаның жартылай ыдырау уақыты 4, 5 дан 1000 дейін өседі ( 60
0
C, 0, 1н. NaOH) . Сілтілік гидролиз нәтижесінде сақина бұзылып, полифосфат түзіледі.
Барлық циклді фосфаттарға көпсатылылы реакциямен сипатталады, яғни ең алдымен цикл ыдыраған кезде тізбек пайда болады, содан соң осы тізбек бірнеше сатыдан өтіп монофосфатқа айналады. Мысалы, қышқылдық ортада трициклофосфат анионы три және дифосфаттан өтіп ыдырайды [9] :
(P
3
O
9
)
3-
 (H
2
P
3
O
10
)
3-
(H
2
P
3
O
10
)
3-
 (H
2
P
2
O
7
)
2-
+ H
2
PO
(H
2
P
2
O
7
)
2-
+ H
2
PO
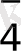
 3 H
2
PO
3 H
2
PO
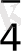 (2)
(2)
Кейбір зерттеулерге сүйенсек [10; 11] рН мәні 3, 0 тен 8, 5дейін және 20 0 С тан төмен температурада фосфаттар жоғарғы тұрақтылығымен ерекшеленеді. Полифосфаттардың тұрақтылығы полимериленизациялану дәрежесіне кері қатынаста болады, яғни тізбектің ұзындығының узаруына сәйкес олардың тұрақтылығы кемиді [12 - 13] .
Циклофосфаттардың (n < 6) полифосфаттардан тағы да бір ерекшелігі оның тұздарының ергіштігі, комплекс түзуге қабілетінің төмендігі және сілтілік гидролиз процессіне тұрақсыздығы.
Барлық циклді фосфаттар сілтілік гидролиз нәтижесінде тізбекті полифосфаттарға ыдырайды, ал полифосфаттың өзі соңғы өнім - ортофосфат ионына дейін ыдырайды. Сілтілік металдардың три тетрафосфаттары осы әдіс арқылы алынуы мүмкін, ал циклооктафосфат гидролиз процессіне тұрақты және түзілген тізбекті октафосфат тез арада ыдырап кетеді.
Ерітіндіде металдың катионның (комплекс және модифицирленген ионның негізгі катиондары ) бірге кездесуі, сонымен қатар жақсы комплекстенетін лигандалар, дифосфатты аниондар секілді, комплекс түзетін процестер жүруі ықтимал.
Ядрoлық магнитті резонанс әдісі бойынша рН = 8 - 4, 5 болғанда комплекс РО 4 тетраэдрдің соңында түзіледі, ал рН = 4, 5 - 0 төмендеткен кезде РО 4 тетраэдрдің тобының 80 % комплекс түзеді. Ал рН=3, 0 - 0, 0 болған кезде тетраэдрлер сақина болады, одан орташа қалыпта, одан тарамдалатын нүкте секілді болады. [6]
Комбинацияланған шашырау спектроскопия әдісі бойынша әртүрлі тұздарды мысал ретінде (Zn 2+ , Cd 2+ , Hg 2+ ) және күшті қышқылдардың аниондары (NО 3 - , С1 - ) комплекс түзуге қышқылдың әсері зерттелген. рН мәні жоғарылатқан кезде гидрооксокомплекс түзіледі және ацидогидрокомплекс түзіледі. Ал көп конденсирленген ерітінділерде (См > 0, 01моль/л) полимерлі формалар пайда болады және құрылымдық бейнес күрделенеді.
Е. А. Продан три және циклотрифосфаттардың сулы ерітінділеріндегі қасиетін зерттеген кезде сақинаға қарағанда, Р - О - Р байланысты сатыларда жоғары қозғалыс болады, олар айырылуға бейім болып келеді. рН ортаның жоғарылауы немесе комплекс түзуші катиондармен сақиналы лиганттар қосқан кезде қатты сфера ішілік комплекс түзеді, ал циклді трифосфатты лиганд түзбейді.
М. Бобтельский поликомплексті қосылыстардың трифосфат және иондармен магний, кальций, стронций, барий, никель, кобальт, марганец және мыс түзілуін зерттеген. Натрий трифосфат және көп валентті катиондардың ерітіндімен араластырған кезде рН төмендеуі нәтижесінде комплекс түзіледі; бұл эффект магний, кальций, марганец және алюминий тұздарында көрінеді.
Комплекстін түзулуі келесі нұсқа бойынша жүреді:
М 2+ + НР 3 О 10 4- + Н + (3)
Комплекс құрамы басқаша да болуы мүмкін - М(Р 3 О 10 ) 2 8- , МОНР 3 О 2 8- , рН төмендеу мүмкіндігі ерітінділердің араласуы комплекс түзуіне тұрақты болады және тұрақсыздық константасын есептеуге қолданылады. Беливанцев тұрақтылық константасын Бьеррумның әдісі бойынша есептеді, бұл жүйеге Сu 2+ - HPO 4 2- - H 2 O pH< 6, 0 H + ортадан төменгі түзетулермен, lgβ= 9, 4 + 0, 2; pH< 6, 0 болған кезде lgβ= 13, 2 + 0, 2;
CuHPO 4 * H 2 O судың кристалогидраты координацияланбаған күйде болады және гидрафосфат анионымен, сутектік байланыспен байланысқан CuHPO 4 * H 2 O бұл жоғары термиялық тұрақты екенін ескеріп, оның құрылысы «жай қабатты» болуы мүмкін деп жорамалданған, бұнда қабаттың бір жағы мыс иондарынан тұрады, ол гидроксилді ион түрінде орналасқан, ал екіншісі фосфатты иондар түрінде орналасқан. Бұл фосфаттардың ерігіштіктері негізден қышқылдық тұзға қарай артады: πP СuOH4 = 2, 1 * 10 -22 , πP Cu3(PO4) 2 * 10 -25 , πP СuOH4* H2O = 4*10 -10 ;
Осы алынған комплекстердің константасын есептеу және құрамын анықтау үшін комплексті ионның, полифосфат ионның концентрациясының өзгерісін, олардың қатынасын, ерітінділердің рН білу қажет.
Ерітінділердің ортасының өзгеру мәндері 4-пен 7 аралығында болады, яғни бұнда Ғе 3+ - комплекстері полифосфорлы қышқылдың әртүрлі сатыда диссоциацияланатынын анықтайды.
Ғе 3+ -Р 3 О 10 5- - Н 2 О жүйесі үшін рН 7, 0-8, 0 кезінде оптикалық тығыздығы максималды мәніне тең және тұрақты болып қалады, яғни тұрақты химиялық комплекстің жарық өткізуі басқа әдіс бойынша - Е = 4226, 98 моль -1 см -1 және графиктік түрде оның құрамы анықталған: C=2, 7 * 10 -4 - 3, 7 * 10 -4 жүйесі негізінде - Ғе : Р 2 О 10 5- қатынаста жай комплекс түзеді. Kелесі концентрацияның өсуі кезінде - Ғе : Р 2 О 10 5- = 1 : 2 ; Fe 3+ - P 2 O 7 4- - H 2 O жүйесі үшін комплекс құрамы анықталған 1:1 және константа молярлы жұту коэфиценті; К обр = (4, 8 + 0, 5) * 10 -9 ; E = 4973, 75 моль -1 см -1 . Бұл комплекс түзетін жүйеде 1 протон қатысады, яғни комплексті ион түзеді [FeHP 2 O 7 ] - , Fe 3+ - P 3 O 10 5- - H 2 O жүйесінде 2 комплекс ионы бар [FeP 3 O 10 ] 2- және [Fe(P 3 O 10 ) 2 ] 7- ; Кахановский K 4 P 2 O 7 - Mr(NO 3 ) 2 - H 2 O жүйесінде 1 моль/л изомолярлық кесіндіде тұнбаның түзілуін зерттеген. Бұнда төрт кристалдық қосылыстар анықталды. P 2 O 7 4- : Me 2+ = 1, 22 ; 0, 67; 0, 54; 0, 48 қатынастары кезінде тұнба түрінде келесі қосылыстар түзіледі: Мп 2 Р 2 О 7 * 5 H 2 O; K 2 MnP 2 O 7 * 3 H 2 O; K 2 Mn 3 (P 2 O 7 ) 2 ; K 2 Mn(P 2 O 7 ) 4 * 26 H 2 O.
Келтірілген кинетикалық мінездеме гидролитикалық айырылу кезінде келтірілген катиондар қатысында дифосфаттардың айырылу жылдамдығы жеке тұздардың гидролизінің жылдамдығына қарағанда артады. Осы жұмыста тағы модифицирленген қоспаны дифосфатқа магний, кальций және стронций қосқан кезде алынған өнімнің қасиеті белгілі, потенциометриялық титрлеу өткізілді. Жүргізілген анализдер нәтижесінде ерітіндінің рН өзгерген сайын әртүрлі құрамды аниондар алынды, олар модифицирленген катиондармен протондалған және протондалмаған дифосфатты кешен береді.
Әдебиеттерден алынған мәліметтер бойынша бұрыннан бастап жүргізілген зерттеулер моно-, ди- және три- фосфатты тұздардың әртүрлі сулы жүйесіндегі синтезіне қатысты.
Қазіргі уақытқа дейін бейорганикалық полимерлік фосфаттың қорғаныш әсерінің механизмі туралы бірдей пікір қалыптасқан жоқ.
Розенфельд өз қызметкерлерімен бейорганикалық мономерлік фосфаттың қорғаныш әсерінің механизмін қорғаныш қабаттың түзілуімен металдың беткі қабатын жартылай немесе толығымен қаптауымен түсіндірді, оттегінің келуін кедергі жасау коррозия процесін тоқтатуына жағдай жасады. Қабықтың зерттелуіне бұл гипотезаның анодтағы 0, 1 М монофосфаттың ерітіндісінде темірдің тотығуы қалыптасады, лазерлік спектроскопиялық, комбинациондық шашырауы, рентген сәулелерінің дифракциялану әдісінің қатысуымен жүргізіледі.
1. 3 Қолданылуы
Жер бетінде фосфордың сандың үлесі 0, 08% құрайды. Бірақ, салыстырмалы түрде фосфаттардың шикізат көзі өте аз және бытыраңқы тараған. Ал СНГ де фосфордың қайнар көзі Қазақстан, Эстония және Кольск те орналасқан. [14] .
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz