Ақуыздардың ашылуы, стандартты аминқышқылдар және құрылымдық деңгейлері


Я. Беккори 1736 жылы тұңғыш рет бидай ұнынан желімтіктелген ақуыз алды. Бірақ ақуыздың құрамы тек жүз жылдан кейін ғана басқа ғалымдардың тәжірибелері негізінде анықталды. Оны анықтау үшін жасалған алғашқы қадам ақуызды ыдырату анықталды. Егер ақуызды күшті қышқылмен (тұз қышқылымен) араластыра отырып қыздырса, ол өте кішкене бөлшектерге ыдырайды. Бұл бөлшектерді мұқият зерттегенде олардың құрамында карбоксил (СООН) тобының қышқылдық және амин (NH 2 ) тобының негіздік қасиет көрсететіндігі дәлелденді. Кейіннен осы топтарды аминқышқылдары деп атады. Ақуыз молекуласының құрамына кіретін аминқышқылдарының саны - 20, олар молекуласының құрылымы жөнінен әр текті болып келеді. Осы 20 түрлі аминқышқылын ашуда қажымас қайрат, көп уақыт қажет болды. Мәселен, 1806 жылы Р. Воклен мен К. Робике ақуыздың ыдырауынан пайда болған аминқышқылын аспарагус өсімдігінің сөлінен бөліп алып, аспарагин деген ат берді.
1820 жылы француз ғалымы А. Браконно ақуызды ыдырату арқылы аминқышқылы - глицинді алды, осыдан кейін аминқышқылдарын жүйелі түрде зерттеу басталды. Ең соңғы жиырмасыншы аминқышқылы - треонин 1935 жылы фибрин ақуызының құрамынан алынған болатын. Сөйтіп, ақуыз құрамына кіретін 20 түрлі аминқышқылын ашуға 130 жыл уақыт кетті.
Биополимерлердің ішіндегі мөлшері мен маңызы жөнінен ерекше орын алатыны ақуыз молекуласы. Ақуыз макромолекулаға жатады.
Ақуыз молекуласы органикалық заттардың ішіндегі алыбы екенін мына сандардан көруге болады. Мысалы, органикалық зат этил спиртінің молекулалық массасы - 60, ал жұмыртқа ақуызы - альбуминдікі - 36000, гемоглобиндікі (қанның қызыл түйіршіктері) - 152000. Ақуыз молекуласының алып болуы заңды да, себебі оны құруға мыңдаған атомдардан тұратын мономерлер қатысады. Ақуыз полимері мономерлерінің рөлін аминқышқылдары атқарады.
Ақуыз химиялық құрамы жөнінен гетерополимерлерге (грекше «hetezos» - әр түрлі) жатады.
Табиғатта 200-ден астам аминқышқылдарының түрлері бар. Ақуыз молекуласының құрамына кірмейтіндері зат алмасудың нәтижесінде реакция аралық қосылыстар түрінде пайда болып, кейбір ерекше бактериялар үшін қоректік зат ретінде жұмсалады.
Ақуыз молекуласының құрамына кіретін аминқышқылда-
рының ерекшелігі неде? Басқа аминқышқылдары неліктен ақуыз молекуласының құрамына кірмейді деген заңды сұрақ еріксіз туады. Бұл сұрақтардың жауабы мынадай мағлұматтар негізінде түсіндіріледі.
Жоғарыда айтып кеткендей, табиғатта 200-ден астам аминқышқылдары болады, бірақ, ақуыз молекуласының құрамына соның 20 түрлі аминқышқылы ғана кіреді. Себебі бұл аминқышқылдарының амин тобы да, карбоксил тобы да бір көміртегі атомымен байланысқан және ол көміртегі атомы аминқышқылының молекуласындағы бірінші тұрған көміртегі болып саналады. Ол көміртегі атомы α- жағдайдағы деп аталады. Аминқышқылы молекуласындағы тізбектің құрамына кіретін екінші көміртегі - β, үшіншісі - γ, төртіншісі - δ, т. б болып белгіленеді. .
Ақуыз молекуласының құрамына тек α - жағдайындағы аминқышқылы кіреді, ал қалғандары жасушаның басқа қызметтері үшін жұмсалады. α - жағдайындағы аминқышқылдары өзара қалай байланысады? Мұны түсіндіру үшін, α - көміртегі аминқышқылының «иіні» делік те, ол «иіннен» шығып тұрған амин және карбоксил топтарын аминқышқылдарының оң және сол қолдары делік. Міне, осы қолдарымен аминқышқылдары бір - бірімен ұстасып, ақуыз молекуласының тізбегін құрайтындығын полпептидтік байланыстан көруге болады. Сонда аминқышқылының иінін α - көміртегі, ал қолдарының рөлін барлығында бірдей NH 2 мен СООН топтары атқарады. Ендеше аминқышқылдарының бір - бірінен айырмашылығы неде?
Мұнда «иін» қызметін атқаратын α -көміртегі аминқышқылдарының денесі болып табылады да, құрамы жөнінен сәйкес келеді. Молекуласының құрамы жөнінен сәйкес келмейтін бөлігі R - тізбегін құрайды. Мұны түсіну үшін
төменде үш амин қышқылы берілді.
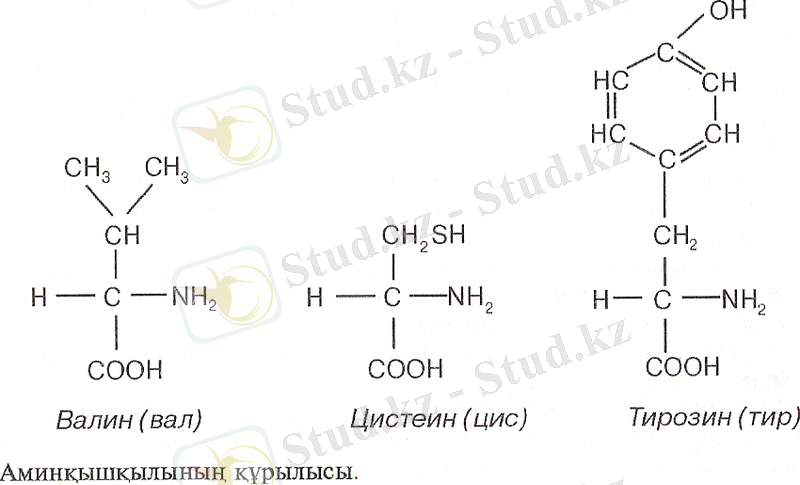
Ақуыз молекуласы аминқышқылдарынан тұратыны дәлелденгеннен кейін ғалымдар олардың бір - бірімен қалай байланысатынын зерттей бастады. Әсіресе, ХХ ғасырдың басында ақуыз құрылысын зерттеумен неміс ғалымы - Э. Фишер айналысты. Э. Фишер сол кездегі белгілі пенсин мен трипсин ферменттерінің ақуызды пептондарға ыдырата алмайтынын, ал қышқылмен қосып қыздырғанда ақуыз жеке аминқышқылдарына ыдырайтындығын химиялық жолмен зерттеп, терең талдай білді. Ол ақуыз аминқышқылдарынан тұрады және амидтік байланысқа түседі деген пікірдің дұрыстығын дәлелдеді. Э. Фишер амидтік байланыс түрін пептидтік байланыс деп, ал ақуыздың ең кіші бөлшегін пептид деп атады. Екі пептид байланысса «дипептид», үш пептид байланысса «трипептид», ал бірнешеуі «полипептид» деп аталады. Сонда, пептид молекуласы полимерлі молекулаға жатады, ал оның мономерлерінің рөлін аминқышқылдары атқаратыны өздеріңе мәлім. Э. Фишер ақуыз құрамындағы аминқышқылдары бір - бірімен аминдік немесе пептидтік байланыс жасап орналасатынын ашты.
ХХ ғасырдың бас кезінде ақуыздың қасиеті физикалық тұрғыдан зерттеле бастады. Нобель сыйлығының лауреаты, швед химигі Г. Сведберг жердің тартылыс күшінен 250 мың есе күшті үдеу беретін центрифуга ойлап тапты. Қою сұйықтықтың үстіне ақуыз ерітіндісін құйып, центрифугада айналдырғанда, ақуыз молекулалары ыдыстың түбіне қарай ығысқан. Сведберг ақуыздың қою сұйықтықта ығысу аралығын есептеп, осы әдіспен оның молекулалық массасын табуға болатынын және центрифугада айналдыру кезінде шар тәрізді молекулалар көбірек ығысатынын айқындап, ең алғаш ақуыз молекулаларының шар тәрізді екенін анықтады.
Полипептидтердің құрылымын рентген құрылымды әдіспен зерттеу 30- жылдары басталып, Л. Полинг 1951 жылы зор жаңалық ашты. Медицинада «орақ пішінді жасушалық анемия» дейтін ауру белгілі. Бұл аурумен ауырған адамдардың қанындағы эритроциттер орақ пішінді болады. Орақ пішінді эритроциттер оттегін тасу қасиетінен айырылады немесе өте нашар тасиды. Л. Полингауру ауру жасуша мен сау жасушаның гемоглобиндерінің бірінші деңгейіндегі құрылымын зерттегенде мынадай жайға тап болған. Ауру гемоглобиннің аминқышқылдары тізбегінде алтыншы орында әдеттегі глутамин қышқылының орнында валин тұрғанын анықтады:
Вал-Гис -Лей - Тре - Про - Глу - Глу - Лиз -сау гемоглобин.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz