Молекулалық физика: молекула-кинетикалық теория, идеал газ, фазалық өтулер және сұйықтардың қасиеттері


ҚАЗАҚСТАН РЕСПУБЛИКАСЫ ҒЫЛЫМ ЖӘНЕ БІЛІМ МИНИСТРЛІГІ
МАТЕМАТИКА, ФИЗИКА ЖӘНЕ ТЕХНОЛОГИЯ ФАКУЛЬТЕТІ
Физика кафедрасы
РЕФЕРАТ
«Молекулалық физика»
Мазмұны
Кіріспе
- Молекула-кинетикалық теорияның негіздері
- МКТ-ның негізгі теңдеуі. Температура
- Идеал газ күйінің теңдеуі. Изопроцестер.
- Булану, конденсация, қайнау. Қаныққан және қанықпаған булар
- Сұйықтардың қасиеттері. Беттік керілу.
- Кристаллдық және аморфтық денелер.
- Деформация
Қолданылған әдебиеттер тізімі
Кіріспе
- Молекула-кинетикалық теорияның негіздері
Заттың құрылысы молекула-кинетикалық теория бойынша молекулалардан тұрады (латынның «молес» - масса, «молекула» - кішкентай масса) . Молекула деп заттың химиялық қасиеттерін сақтайтын ең кішкентай бөлшегін айтады.
Молекула-кинетикалық теория (МКТ) - заттардың молекулалық құрылысына негізделген жылу құбылыстару туралы ілім.
МКТ-ның үш негізі бар:
1) Барлық заттар - сұйық, қатты және газ күйіндегі - кішкентай бөлшектерден - молекулалардан, ал олар атомдардан құралады. Химиялық заттың молекулалары күрделі және жай болып, бір немесе бірнеше атомдардан құралады.
2) Атомдар және молекулалар бейберекет қозғалыста болады.
3) Молекулалар бір-бірімен өзара әсерлеседі. Бөлшектер арасындағы гравитациялық әсерлесу өте аз
МКТ-ның атомдардың бейберекет қозғалуының айқын экспериментальды көрінісі - броундық қозғалыс болып табылады. Броундық бөлшектер молекулалардың бейберекет соғылысуларынан қозғалады. Хаостық қозғалысынан оның соғылысулары модулі және бағыты жағынан ешқашан теңгерілмейді, сондықтан броундық бөлшектің жылдамдығы модулі және бағыты жағынан бейберекет өзгереді.
Броундық қозғалыстың теориясын А. Эйнштейн жасады. Екі молекуланың арасындағы күштер олардың ара қарақашықтығына байланысты. Молекулалар оң және теріс кеңістіктік күрделі структураларға ие болады. Егер молекулалардың арасындағы қашықтық үлкен болса, онда молекула арасындағы тартылыс күштері жеңеді, кішкентай арақашықтықта итеру күштері жеңеді.
Қандай да бір r = r 0 арақашықтықта әрекеттесу күші 0-ге айналады. Бұл қашықтықты молекуланың диаметріне алуға болады. r = r 0 болғандағы әрекеттесудің потенциалдық энергиясы минималды. r = r 0 қашықтығындағы екі молекуланы бір-бірінен ажырату үшін, оларға қосымша E 0 энергиясын беру қажет. Бұл E 0 саны байланыс энергиясы деп аталады.
Молекулалардың өлшемдері өте кішкентай. Қарапайым бір атомды молекулалардың өлшемі 10 -10 м. Молекулалардың бейберекет қозғалысы жылулық қозғалыс деп аталады. Жылулық қозғалыстың кинетикалық энергиясы температураның өсуінен өседі.
Қатты денелерде молекулалар тағайындалған центрлер маңайында бейберекет қозғалыстар жасайды. Бұл центрлер кеңістікте ретсіз (аморфты денелерде) немесе реттелген структураларды құрады (кристалдық денелер) .
Ауа молекулаларының орташа қашықтығы 10 -8 м, яғни молекулалардың өлшемдерінен үлкен болады. МКТ-да зат мөлшерін бөлшектер санына пропорционал деп санайды. Зат мөлшерінің бірлігі моль деп аталады. Моль - көміртегінің 0, 012 кг-да бар молекула санына тең зат мөлшері.
Сонымен, кез келген заттың 1 молінде бірдей бөлшектер саны болады. Бұл санды Авогадро тұрақтысы N A деп атайды.
N A = 6, 02·10 23 моль -1 .
Зат мөлшері бөлшектердің санын N Авогадро санына N A :қатынасымен анықталатын шама:
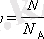
Бір моль заттың массасын мольдік масса деп атау ұйғарылған. Мольдік масса берілген заттың бір молекуласының массасын Авогадро санына көбейтіндісіне тең.
M = N A · m 0 .
Мольдік масса кг/моль өлшенеді. Бір атомнан құралған заттар үшін атомдық масса термині қолданылады. Атомдар мен молекулалардың бірлігі ретінде көміртегінің 1/12 массасы алынады. Ол массаның атомдық бірлігі деп аталады.
1 м. а. б. = 1, 66·10 -27 кг.
Бұл шама протонның немесе нейтронның массасымен сәйкес келеді. Берілген заттың атомының массасының көміртегі атомы массасының 1/12 бөлігіне қатынасын салыстырмалы масса деп атайды.
2. МКТ-ның негізгі теңдеуі. Температура
МКТ қарапайым моделі- идеал газ моделі б. т. МКТ-ның мақсаты - микроскопиялық (масса, жылдамдық, молекулалардың кинетикалық энергиясы) және макроскопиялық параметрлерінің (қысым, газ, температура) арасындағы байланысты анықтау.
Идеал газ моделін қолданып, газдың ыдыстың қабырғасына қысымын есептейік. Молекуланың ыдыстың қабырғасымен әсерлесу процесінде олардың арасында Ньютонның үшінші заңына бағынатын күштер пайда болады. Нәтижесінде ыдысқа перпендикуляр молекула жылдамдығының υ x проекциясы таңбасын кері таңбаға ауыстырады, ал қабырғаға параллель жылдамдықтың υ y проекциясы өзгеріссіз қалады.
Сондықтан молекула импульсінің өзгеруі 2 m 0 υ x тең болады, мұндағы m 0 - молекула массасы. Қабырғада S ауданын бөліп алайық. Δ t уақыт ішінде осы қабырғамен қабырғаға бағытталған υ x жылдамдық проекциясы бар және табанының ауданы S, биіктігі υ x Δ t цилиндрде болатын барлық молекулалар соғылысады.
Ыдыстың бірлігінде
n
молекула бар болсын. Онда цилиндрдегі көлемде
nS
υ
x
Δ
t
молекула бар болады. Бірақ осы санның тек жартысы ғана қабырға жаққа, ал қалған жартысы - қарама-қарсы бағытта қозғалып, қабырғамен соғылыспайды. Сондықтан,
S
қабырғасы арқылы Δ
t
уақыт ішінде
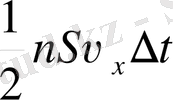 молекула соғылысады. Соғылысқан кезде әрбір молекуланың импульсі 2
m
0
υ
x
, -ға өзгертеді. Ньютонның үшінші заңына сәйкес:
молекула соғылысады. Соғылысқан кезде әрбір молекуланың импульсі 2
m
0
υ
x
, -ға өзгертеді. Ньютонның үшінші заңына сәйкес:
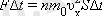
Осы теңдік
тің екі жағын
S
Δ
t
бөлсек:
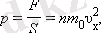 аламыз, мұндағы
p
- газдың ыдыс қабырғасына қысымы.
аламыз, мұндағы
p
- газдың ыдыс қабырғасына қысымы.
Газ молекулаларының жылдамдықтар модулі бойынша үлестірілуі Максвелл үлестірілуі деп аталады.
Максвелл үлестіруіне тән параметрлер - қисықтың максимумына сәйкес келетін ықтимал жылдамдық υ в , орташа квадраттық жылдамдық.
Барлық молекулалар жылдамдықтары сәйкес υ
x1
, υ
x2
, υ
x3
болатын
n
1
,
n
2
,
n
3
молекуласы бар бірнеше топқа бөлінсін. Молекулалардың әрқайсы тобы газдың қысымына
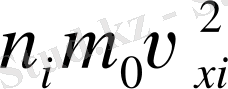 үлес қосады. Нәтижесінде молекулалардың ыдыс қабырғасына соғылысуы:
үлес қосады. Нәтижесінде молекулалардың ыдыс қабырғасына соғылысуы:
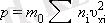
Осы өрнектегі қосындыны n -ге бөлсек, онда біз молекулалардың орташа квадраттың жылдамдығын табамыз:
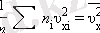
Енді газ қысымының формуласын жазуымызға болады:
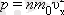
Жылдамдықтар векторлары үшін барлық бағыттар тең құқылы болғандықтан, координаттық осьтерге проекциялары квадраттардың орташа мәндері өзара тең болады:
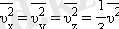
Газ қысымының ыдыс қабырғасына түсіретін орташа қысым формуласы:
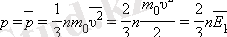
Бұл теңдеуді МКТ-ның негізгі теңдеуі деп атайды. Сонымен, газ қысымы көлімнің бір бірлігіндегі молекулалардың ілгерімелі қозғалысының орташа кинетикалық энергиясының үштен екі бөлігіне тең.
Жылулық контакт кезінде бір дененің екіншісіне берген энергиясы жылу мөлшері деп аталады.
Жылулық тепе-теңдік - бұл бір денеден екіншісіне жылу берілмей, барлық макроскопиялық параметрлер тұрақты болатын денелер жүйесінің күйі.
Температура - бұл жылулық тепе-теңдікте болатын барлық денелер үшін бірдей физикалық параметр. Температураны өлшеу үшін термометрлер қолданылады.
Ағылшын ғалымы Кельвин 1848 жылы жаңа температуралық шкаланы енгізуді ұсынды. Цельсий шкаласына қарағанда, бұл шкалада нөлдік нүкте жылжыған: T К = T С + 273, 15.
Кельвиннің температуралық шкаласы температураның абсолют шкаласы деп аталады.
мұндағы k - Больцман тұрақтысы , k = 1, 38·10 -23 Дж/К.
МКТ орташа кинетикалық энергиясы
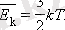
3. Идеал газ күйінің теңдеуі. Изопроцестер.
Молекулалары бір бірімен және ыдыстың қабырғасымен өзара әрекеттесетін идеал газ моделі үшін алынған газдың қысымын оның температурасымен және молекулалар концентрациясымен байланыстыратын
p
=
nkT
, формуласын аламыз. Бұл теңдеуді
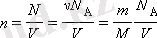 теңдіктерді қолдана отырып
теңдіктерді қолдана отырып
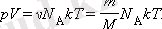 түрінде жазуға болады. Мұндағы
N
- ыдыстағы молекулалар саны,
N
A
- Авогадро тұрақтысы,
m
- ыдыстағы газдың массасы,
M
- газдың мольдік массасы.
түрінде жазуға болады. Мұндағы
N
- ыдыстағы молекулалар саны,
N
A
- Авогадро тұрақтысы,
m
- ыдыстағы газдың массасы,
M
- газдың мольдік массасы.
Авогадро тұрақтысының Больцман тұрақтысына көбейтіндісін универсал газ тұрақтысы деп атап, R деп белгілейді: R = 8, 31 Дж/моль·К.
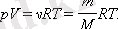
қатынасы идеал газ күйінің теңдеуі деп аталады.
1 моль кез келген газ үшін бұл қатынас:
түріне келеді.
Егер температура T н = 273, 15 К (0 °С), ал қысым p н = 1 атм = 1, 013·10 5 Па тең болса, онда газ қалыпты жағдайда тұр деп атайды.
Қалыпты жағдайдағы 1 моль кез келген газдың көлемі: V 0 = 0, 0224 м 3 /моль = 22, 4 дм 3 /моль.
Бұл тұжырым Авогадро заңы деп аталады.
Өзара әсерлеспейтін газдар қоспасы үшін газ күйінің теңдеуі:
мұндағы ν 1 , ν 2 , ν 3 , т. с. с. - қоспадағы газдардың әрқайсысының зат мөлшері.
Газдың қысымы, көлемі және температурасының арасындағы байланысты орнататын теңдеуді ХІХ ғасырдың ортасында француз физигі Б. Клапейрон алған, және оны алғаш рет Д. И. Менделеев жазған. Сондықтан газ күйінің теңдеуі Клапейрон-Менделеев теңдеуі деп аталады. Газ оның күйін сипаттайтын ( p , V және T ) параметрлері өзгеруі мүмкін. Егер бұл процесс жеткілікті ақырын жүрсе, онда бұл процесс квазистатикалық деп аталады. Квазистатикалық процестер күй диаграммасында қандай да бір траектория түрінде суреттелуі мүмкін. ( p , V немесе T ) параметрлерінің біреуі өзгеріссіз болған жағдай әсіресе қызықтырады. Мұндай процестер изопроцестер деп аталады.
Изотермиялық процесс (T = const)
Изотермиялық процесс деп тұрақты температурада өтетін квазистатикалық процесті айтады. Идеал газ күйінің теңдеуінен: тұрақты температурада газдың қысымының оның көлеміне көбейтіндісі тұрақты қалатыны шығады:
( p , V ) жазықтығында изотермиялық процестер изотермалар деп аталатын p ~ 1 / V түріндегі гиперболалар тобымен кескінделеді. Изотермиялық процестің теңдеуін ағылшын физигі Р. Бойль (1662) және француз физигі Э. Мариотт (1676) алды. Сондықтан теңдеуді Бойль-Мариотт заңы деп атайды.
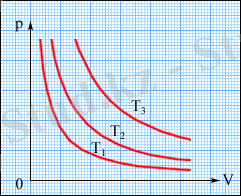
3. 1-сурет. ( p , V ) жазықтығындағы изотермалар тобы. T 3 > T 2 > T 1 .
Изохорлық процесс (V = const)
Изохорлық процесс - бұл тұрақты көлемде және ыдыстағы зат мөлшері тұрақты болған жағдайдағы газдың квазистатикалық процесін айтады. Газ күйінің теңдеуінен:
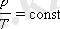
( p , T ) жазықтығында изохорлық процестер изохорлар деп аталатын түзу сызықтар тобымен кескінделеді (3. 2-сурет) .
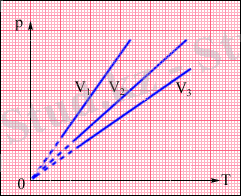
3. 2-сурет. ( p , T ) жазықтығындағы изохорлардың тобы. V 3 > V 2 > V 1 .
Газ қысымының температурадан тәуелділігін тәжірибелік жолмен француз физигі Ж. Шарль (1787) анықтаған. Сондықтан изохорлық процестік теңдеуі Шарль заңы деп аталады. Изохорлық процестің теңдеуі
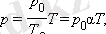
түрінде жазылуы мүмкін. мұндағы p 0 - газдың T = T 0 = 273, 15 К температурасындағы қысымы, сандық мәні (1/273, 15) К -1 тең α коэффициенті қысымның температуралық коэффициенті деп аталады.
Изобарлық процесс ( p = const)
Изобарлық процесс деп p қысымы тұрақты болған жағдайдағы квазистатикалық процесс. ν өзгермеген зат мөлшері үшін изобарлық процестің теңдеуі:
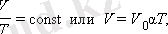
мұндағы V 0 - 0 °С температура кезіндегі газ көлемі. α коэффициенті (1/273, 15) К -1 тең. Оны газдың көлемдік ұлғаюының температуралық коэффициенті. ( V , T ) жазықтығында изобарлық процестер p қысымының әр түрлі мәндерінде изобара деп аталатын түзу сызықтар тобын береді.
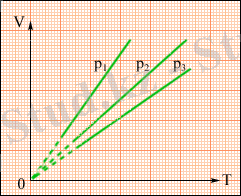
3. 3. -сурет. ( V , T ) жазықтығындағы изобаралар тобы p 3 > p 2 > p 1 .
Газ көлемінің температурадан тәуелділігін тәжірибе жүзінде француз физигі Ж. Гей-Люссак ашты. Сондықтан изобарлық процесс теңдеуі Гей-Люссак заңы деп аталады.
4. Булану, конденсация, қайнау. Қаныққан және қанықпаған булар
Кез келген зат белгілі жағдайда әр түрлі агрегаттық күйде - қатты, сұйық және газ түрінде болады. Бір күйден екінші күйге өту фазалық өту деп аталады. Булану және конденсация фазалық өтудің мысалы болып табылады. Барлық нақты газдар белгілі жағдайда сұйыққа айналады. Алайда газдың сұйыққа айналуы күдікті температура деп аталатын T күд төмен температурада ғана болады.
Булану деп сұйық күйден газ түріне фазалық өтуін айтады. МКТ тұрғысынан булану - кинетикалық энергиясы қалған молекулалардан жоғары болатын сұйықтың бетіндегі молекулалардың ұшып шығу процесі. Бұл қалған молекулалардың орташа кинетикалық энергиялаларының азаюына, яғни сұйықтың сууына әкеледі.
Конденсация - булануға кері процесс. Конденсация кезінде бу молекулалары сұйыққа қайта оралады. Жабық ыдыста сұйық және оның буы ұшып шыққан молекула санының будан сұйыққа оралған молекулалар санына тең болатын динамикалық тепе-теңдік қалпында бола алады, яғни булану және конденсация жылдамдықтары бірдей болады. Мұндай жүйені екі фазалы деп атайды. Өзінің сұйығымен тепе-теңдікте болатын буды қаныққан бу деп атайды. Будан сұйықтыққа оралған молекулалар саны бу температурасымен анықталатын жылулық қозғалысының орташа жылдамдығы мен бу молекулаларының концентрациясынан тәуелді.
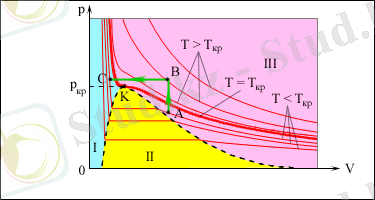
4. 1-сурет. нақты газдың изотермалары. 1 облысы - сұйық,
II облыс - екі фазалы «сұйық + қаныққан бу» жүйесі, ІІІ - газ тәріздес зат, К - күдікті нүкте
Газдың (будың) қысымы оның концентрациясы мен температурасымен анықталатындықтан, берілген заттың қаныққан буының p 0 қысымы оның температурасына ғана тәуелді, ал көлемінен тәуелсіз болады . Сондықтан ( p , V ) жазықтығындағы нақты газдың изотермалары, екі фазалы жүйеге сәйкес келетін горизонталь бөліктері болады (4. 1-сурет) . Қаныққан будың температурасы жоғарылаған кезде, оның қысымы және тығыздығы үлкейеді, ал сұйықтың тығыздығы жылулық ұлғаю салдарынан азаяды. Берілген дене үшін күдікті температурасына тең T күд температурада будың және сұйықтың тығыздықтары теңеседі. T > T күд болғанда сұйық пен оның қаныққан будың арасындағы физикалық өзгешеліктері жойылады. Егер қанықпаған буды T < T күд кезінде изотермалық сықсақ, онда оның қысымы қаныққан будың қысымына жеткенше өседі. Бүкіл бу сұйыққа айналған кезде, сұйықтың аз сығылуының салдарынан көлемінің кейінгі азаюынан қысымның күрт үлкеюіне әкеледі. Ол үшін күдікті К нүктесінен айналып өту процесін орындау қажет. Бұл процестердің бірі 4. 1-суретінде АВС сынық сызығымен көрсетілген. Атмосфералық ауада p 0 қаныққан будың қысымынан кіші болатын парциалды p қысымы кезіндегі әрқашан су буы болады. Процентпен есептелінетін p / p 0 қатынасы салыстырмалы ауа ылғалдығы деп аталады.
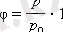
Қаныққан буға идеал газдың заңдарын әрбір T температурасы үшін p 0 қаныққан будың қысымы берілген заттың p 0 ( T ) тепе-теңдік қисығы бойынша анықталғанда ғана қолдануға болады. Газдың қысымы тұрақты молекула концентрациясы кезінде температураға тура пропорционал өседі. Қаныққан буда температура жоғарылаған кезде молекулалар қозғалысының орташа кинетикалық энергиясы ғана емес, олардың концентрациясы да жоғарлайды. Сондықтан, температура жоғарылаған кездегі қаныққан будың қысымы молекулалардың тұрақты концентрациясында идеал газдың қысымына қарағанда тезірек өседі. Булану сұйық бетінен ғана емес, сұйық көлемінде де болады. Сұйықта әрқашан газдың ұсақ көпіршіктері болады. Егер сұйықтың қаныққан будың қысымы сыртқы қысымына үлкен немесе тең болса, онда сұйық көпіршіктердің ішкі жағына қарай буланады. Бумен толтырылған көпіршіктер кеңейіп, бетіне қалқып шығады. Бұл процесс қайнау деп аталады. Сондықтан, сұйықтың қайнауы қаныққан будың қысымы сыртқы қысымына тең болған температурада басталады.
4. 1-суреті газдың булану және конденсация процестерін, яғни газ тәрізді және сұйық заттың фазаларының арасында фазалық өтуін бейнелейді. Тепе-тең күйдегі қысымның температурадан тәуелділігі фазалық тепе-теңдіктің қисығы деп аталады. Мысалы үшін қаныққан бу мен сұйықтың p 0 ( T ) тепе-теңдік қисығы бола алады.
4. 2-. сурет. Заттың типтік фазалық диаграммасы.
К - күдікті нүкте, Т - үш еселі нүкте. І облысы - қатты дене, ІІ облысы - сұйық, ІІІ облысы - газ тәрізді зат.
( p , T ) координаталық жүйесінде кескінделген тепе-теңдік қисықтары фазалық диаграмма деп аталады. Қатты дене мен газ тәрізді газдың фазадарының тепе-теңдігіне сәйкес келетін ОТ қисығы сублимация қисығы деп аталады. Сұйық пен будың арасындағы тепе-теңдік ТК қисығы булану қисығы деп аталады, ол К күдікті нүктесінде үзіледі. Қатты дене мен сұйықтың арасындағы тепе-теңдік ТМ қисығы балқу қисығы деп аталады. Үш фаза да тепе-теңдікте бола алатын қисықтар түйісетін Т нүктесі үш еселі нүкте деп аталады.
5. Сұйықтардың қасиеттері. Беттік керілу.
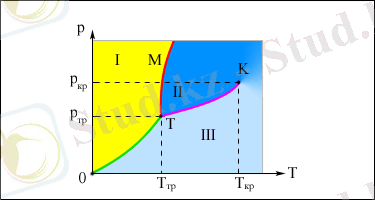
Сұйықтағы молекулалар бір-біріне тығыз орналасқан. Молекулалары реттелген структураларға ие қатты кристаллдық денелерге қарағанда, сұйық молекулаларының еркіндігі жоғары. Қатты дененікі сияқты, сұйықтың әрбір молекуласы көрші орналасқан молекулаларымен «қысылып», тепе-теңдіктің белгілі бір қалпынан жылулық тербелістер жасайды. Алайда, кей кезде кез келген молекула көрші бос орынға кете алады. Мұндай құбылыстар сұйықтарда өте жиі болып жатады, сондықтан молекулалар кристаллдарда сияқты арнайы центрлерге байланбай, сұйықтың бүкіл көлемі бойымен қозғала алады. Бұл сұйықтардың аққыштық қасиетін түсіндіреді. Жақын орналасқан молекулалардың қатты әсерлесуінен олар бірнеше молекуладан құралған локальды (орнықсыз) реттелген топтарды құруы мүмкін. Бұл құбылыс жақындағы рет деп аталады (5. 1-сурет) .
5. 1. -сурет. Кристалдық дененің молекулаларының жақын
және алыс ретінің мысалдары: 1- су, 2- мұз.
5. 2-суреті су мысалында газ түріндегі затты сұйықтан айырмашылығын көрсетеді. Су молекуласы H 2 O 104° жасай орналасқан оттегінің бір атомы мен сутегінің екі атомынан құралған. Бу молекулаларының ара қашықтығы су молекулаларының ара қашықтығынан 10 есе үлкен болады. Молекулалары шар түрінде кескінделген 5. 1-суретіне қарағанда, 5. 2-суретінде су молекуласының структурасы беріледі.
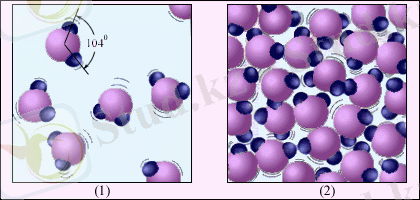
5. 2-сурет. Су буы (1) және су (2) . Су молекулалары 5·10 7 есе үлкейтілген.
Қатты денелер сияқты, сұйықтар да температура өзгергенде өз көлемін өзгертеді. Температураның аз өзгерісінде Δ V / V 0 көлемнің салыстырмалы өзгеруі Δ T температурасының өзгеруіне пропорционал:
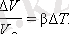
β коэффициентін көлемдік ұлғаюдың температуралық коэффициент деп атайды. Бұл коэффициент сұйықтарда қатты денелерге қарағанда 10 есе үлкен болады. Мысалы суда 20 °С температурасында β в ≈ 2·10 -4 К -1 , болатта β ст ≈ 3, 6·10 -5 К -1 , кварц шыныда β кв ≈ 9·10 -6 К -1 . Судың жылулық ұлғаюы Жердегі өмір үшін өте қызықты және маңызды аномалияға ие. 4 °С-тан кіші температурада су ұлғаяды (β < 0) . 4 °С кезінде су өзінің тығыздығының максимумына жетеді: ρ в = 10 3 кг/м 3 . Қатқан кезде су ұлғаяды, сондықтан мұз қатып бара жатқан судың бетінде қалқып жүреді. Мұз астандағы қатқан судың температурасы 0 °С-қа тең. Судың біршама тығыз қабаттарында температура 4 °С шамасында болады. Осыған байланысты қатып қалған сулардың ішінде де тіршілік бола береді.
Сұйықтардың қызықты ерекшеліктерінің бірі - бұл еркін бетінің бар болуы. Газға қарағанда, сұйық өзі тұрған ыдыстың бүкіл көлемін толтырмайды. Сұйық пен газдың арасында сұйықтың қалған массасына қарағанда ерекше жағдайларда болатын шекара пайда болады. Шекаралық қабатта молекулалар су ішіндегі молекулаларға қарағанда, сол сұйықтың молекулаларымен барлық жағынан қоршалып тұрмайды. Сұйық ішіндегі бір молекулаға әсер ететін молекула аралық күштер жуық шамамен теңгеріледі. Шекаралық қабаттағы кез келген молекула сұйық ішіндегі молекула тарапынан тартылады. Соның нәтижесінде сұйықтың түбіне бағытталған қандай да бір тең әсерлі күш пайда болады. Егер молекула сұйық бетінен сұйық ішіне қарай орын ауыстырса, жұмыс оң деп саналады. Керісінше, бірнеше молекуланы сұйық түбінен бетіне шығару үшін, Δ S бет ауданының өзгеруіне пропорционал сыртқы күштердің оң жұмысын атқару қажет: Δ A сырт = σΔ S .
σ коэффициенті беттік керілу коэффициенті деп аталады (σ > 0) . Сонымен, беттік керілу коэффициенті тұрақты температурада сұйық бетінің ауданын бір бірлікке ұлғайту үшін атқарылатын жұмысқа тең . СИ-да беттік керілу коэффициенті Дж/м2 немесе Н/м өлшенеді. Сондықтан сұйықтың беттік қабатының молекулаларының сұйық ішіндегі молекулаларына қарағанда артық потенциалдық энергиясы болады. Сұйық бетіндегі молекулаларының потенциалдық энергиясы оның бетінің ауданына пропорционал:
Механикадан белгілі: жүйенің тепе-теңдігіне оның потенциалдық энергиясының минималдық мәнінің сәйкес келуі қажет. Осыдан, сұйықтың бос беті өзінің ауданын кішірейтуге тырысады. Осы себептен сұйықтың бос тамшысы шар тәріздес формаға келеді. Сұйықтың бетіне осы бетті тартатын күштер әсер етіп тұрғандай болады. Осы күштер беттік керілу күштері деп аталады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz