Физика-химия және химиялық термодинамиканың негіздері


М а з м ұ н ы
Кіріспе . …… . . . 3
Химиялық термодинамика. …. ……. 4
Термодинамиканың нөлінші заңы5
Термодинамиканың бірінші заңы. 5
Термодинамикалық атаулар мен ұғымдар. . 6
lшкі зенргия. Энтальпия. Жұмыс пен Жылу. . …… 8
Энтальпия . . . 9
Термодинамиканың бірінші заңы . . . 12
Жылу сиымдылық12
Термохимия. . 18
Гесс заңы: Химиялық өзгерістердегі жылу әсерінің
шамасын есептеу………. 19
Гесс заңының салдарлары . . . 22
Термодинамиканың ІІ - бастамасы25
Келтірілген жылу. Энтропия. . 26
Энтропия өзгерісін есептеу. 29
Пайдалы жұмыс . . . 33
Гиббс және Гельмгольц энергиялары37
Термодинамиканың ІІІ - бастамасы. . 42
К і р і с п е
Физикалық химия зат құрылысының заңдылығын, химиялық жүйедегі тепе-тендікті, тепе-тендіктегі бір күйден екінші күйге ауысу мүмкіндігін көрсететін заңдылықты және химиялық түрлену құбылысын зерттейді.
Физикалық химия бірнеше тарауға бөлінеді.
- Зат құрылысы;
- Химиялық термодинамика;
- Ерітінділер;
- Физика-химиялық анализ;
- Ýлектр химиясы;
- Катализ және химиялық кинетика.
Физикалық химия пәнінің химия өнеркәсібі мен ғылыми зерттеу саласындағы мамандар химиктер, химик-технологтар даярлауда алар орыны ерекше. Атап айтқанда:
- аталған пән студенттердің бейорганикалық, органикалық және аналитикалық химия салаларынан алған білімдерін тиянақты түрде нақты өзгеріс не құбылысқа қолдана білуге дағдыландырады;
- өндірістегі технологиялық процестердің жүру заңдылықтары физикалық химия ілімі қарастыратын ой-тұжырымдарға негізделеді;
- технологиялық процестердің дамуы мен өзара тәуелділігінің қазіргі тенденциясын, табиғатты химиялық өндірістің зиянды қалдықтарынан қорғау жолдарын, қалтқысыз өндірістер жасау міндеттерін;
- химиялық термодинамика мен кинетиканың негізгі заңдарын, гомогендік және гетерогендік тепе-теңдіктерді, электрохимияны, термодинамикалық қасиеттерді зерттеудің эксперименттік әдістерін;
- зерттеудің қазіргі әдістерін (ЯМР-, ЭПР-, ИК-, УК-, КР-спектроскопиялар, оның ішінде лазерлік техника, хроматография, рентгенқұрылымдық талдау бар;
- көпкомпонентті жүйелердегі химиялық тепе-теңдікті сипаттау әдістерін;
- талдаудың әртүрлі әдістерін (тұндыру, бөлу, экстракция, спектроскопия, титриметрия, электрохимия) қажетті талдаудың әдісі мен оны жүргізудің әдістемесін таңдау меодологиясын;
- физико-химиялық есептеу әдістемесін;
- физикалық және химиялық құбылыстардың жүру заңдылықтарын зерттейтін жаратылыстану ілімінің дербес бір бөлігі болып табылады.
Т е р м о д и н а м и к а
Жылу құбылысы мен оның түрленуін зерттейтін ілімді термодинамика деп атайды.
Бұл ілім - жалпы, техникалық және химиялық термодинамика салаларына бөлінеді.
Жалпы термодинамика - термодинамика тәсілдерін тұжырымдап, оны фазалық күй өзгерісіне, термоэлектр және магниттік құбылыстарға, сәуле шығару мен дене бетінде орын алатын өзгерістерді зерттеуге арналады.
Техникалық термодинамика - жылу мен жұмыстың түрленуін, жылу двигательдері, тоңазытқыш қондырғыларында орын алатын жылу, механикалық және химиялық құбылыстардың өзара байланыс заңдылықтарымен айналысады.
Химиялық термодинамика құбылыстардың өту механизмі туралы және заттардың ішкі құрылысы туралы қорытындылар жассамайды. Химиялық термодинамика жүйенің басталуы мен соңғы күйлерінің жағдайын және сыртқы күш әсерлерін білу (температура, қысым т. б. ) өте маңызды. Жалпы термодинамика заңдарын химиялық реакция, физика-химиялық құбылыстарға қолдануын қарастырады және химиялық құбылыстарды зерттеуде жалпы термодинамиканың қағидалары мен заңдарын қолданады.
Жүйе /система/ - қоршаған ортадан шартты түрде бөлінген жеке денені немесе өзара әрекеттесетін денелер жиыны, яғни зерттеуге тиісті қоршаған ортаның кеңістіктегі бөлігі.
Термодинамикалық жүйе - сыртқы қоршаған ортадан ойша бөлініп қарастырылатын, өзара жылу және механикалық әсерлесуде болатын дене не заттар жиыны. Ол жабық, ашық, оқшауланған деп үшке бөлінеді.
Жабық жүйе - өзін қоршааған ортамен зат алмаспай тек энергиясымен ғана алмасады.
Ашық жүйе - өзін қоршаған ортамен зат алмасуы да энергия алмасуы да орын алатын жүйелер.
Оқшауланған жүйе - қоршаған ортамен зат және энергия алмаспайтын және сыртқы ортаға қарсы жұмыс істемейтін жүйе.
Термодинамикалық жүйенің күйі термодинамикалық параметрлерімен сипатталады. (температура, қысым, көлем, концентрация т. б. ) .
Термодинамикалық құбылыс - термодинамикалық параметрлердің ең болмағанда біреуінің өзгеруімен жүретін өзгерістер. Егер параметрдің өзгерісі құбылыстың басталуы мен соңғы күйлеріне байланысты болып және құбылыстың жүру жолына байланыссыз болса, ондай параметрді күй функциясы деп атайды.
Күй параметрлері - экстенсивті, интенсивті болып екіге бөлінеді:
Экстенсивті параметрлер /шамалар/ - зат мөлшеріне қарайлас /пропорционал/ (көлем, масса, салмақ, т. б. )
Интенсивті параметрлер /шамалар/ - зат мөлшеріне тәуелсіз (температура, қысым, тұтқырлық, т. б. )
Кез келген параметрлердің өзгерісі термодинамикаық құбылыс /процесс/ деп аталынады да күй параметрлердің тұрақтылығына қарай төмендегіші жіктелінеді:
P - const /тұрақты/ - изобарлы,
V - const - изохорлы,
T - const - изотермиялы,
V, T - const - изохорлы-изотермиялы,
P, T - const - изобарлы-изотермиялы.
Құбылыстың жүру түріне қарай адиабатты, политропты, тұйықталған және тепе-теңдік деп бөлінеді.
Адиабатты - сыртқы қоршаған ортамен, жылу да зат та алмаспай жүретін құбылыс, яғни оқшауланған жүйелерде орын алады.
Адиабата теңдеуі:
PV γ =const
Мұндағы: γ - адиабата көрсеткіші.
Политропты - жүйенің жылу сиымдылық шамасы тұрақты болып өтетін құбылыс.
PV n =const
Мұндағы: n - политроп көрсеткіші.
Тепе-теңдік құбылыс - жүйенің үзіліссіз біртіндеп тепе-теңдік күйін кешу арқылы орын алатын өзгерістер. Ал тепе-теңдік күйде - уақыт бірлігінде жүйенің күй шамалары тұрақты болып зат алмасуы болмайды.
Тепе-теңдік құбылысқы мына ерекшеліктер тән:
- жүйеге әер етуші күш пен қарсы әсердің айырымы өте аз шама;
- тура және кері бағытта істелінетін жұмыстың абсолют шамасы тең;
- жүйеге әсер етуші күштің бағытын өте аз мөлшерде өзгерту құбылыс бағытын да өзгертеді;
- өзгеріс уақытына қарағанда жүйенің тепе-теңдік қалу уақыты өте аз шама.
Жүйеде кез келген құбылыс орын алуы үшін сырттан күшпен әсер ету арқылы оның тепе-теңдік күйін бұзып екінші бір күйге көшіреміз. Осы екінші күйге келуге жұмсалған уақытты - өзгеріс уақыты деп атайды. Ал жүйе екінші күйге жеткенде оны сипаттайтын күй шамалары жүйе бойына қайта тепе-теңдікке көшеді.
Жүйенің өз бойында тепе-теңдік күйін қалпына келтіру уақыты - релаксация уақыты деп аталынады.
Термодинамикалық қайтымды және химиялық қайтымды ұғымдарын шатастырмаған жөн.
“Термодинамикалық қайтымды” - құбылыстың жүру тәсілін, ал “химиялық қайтымды” - құбылыс бағытын сипаттайды.
“Термодинамикалық қайтымды” құбылыс - ол жүйеде идеалды тепе-теңдік құбылыс жүретіндігін мәлімдейді. Ал өмірде мұндай өзгерістер орын алмайды.
Фаза - жүйені құрайтын дене бөліктері белгілі бір кеңістікте өзіндік жазықтық бетпен шектеліп, кеңістіктен нақты көлемді орын алатын, химиялық құрамы, термодинамикалық қасиеттері бірдей бөлікті айтады.
Гомогенді /біртекті/ жүйе - жүйені құрайтын фазалар бір күйде болады.
Гетерогенді /әртекті/ жүйе - жүйені құрайтын фазалар әр күйде болады.
Химиялық термодинамика
Алғашқы кезде термодинамика жылу мен жұмыстың бір-бітіне түрленуін қарастырады, сондықтан да термодинамика (термо грекше - жылу, температура, динамика - күш, жұмыс, қозғалыс) деп ааталады.
XIX ғасырдың екінші жартысында термодинамиканың зетртелу аумағы кеңейе бастады. Соңғы кезде термодинамика заңдарына негізделіп электрлік және тоңазытқыш машиналарындағы, бу турбиналарындағы, іштен жанатын двигательдегі, гальваникалық элементтегі принциптерді, әр түрлі химиялық реакциялар мен биологиялық құбылыстар, жер қыртысындағы және атмосфералық құбылыстар зерттелінеді.
Энергияның бір түрден басқа бір түрге айналу заңдылықтарын зерттейтін ғылым термодинамика деп аталады. Бұл ілім - жалпы, техникалық және химиялық термодинамика салаларына бөлінеді.
Жалпы термодинамика - термодинамика тәсілдерін тұжырымдап, оны физикалық күй өзгерістеріне, термоэлектр және магниттік құбылыстарға, сәуле шығару мен дене бетінде орын алатын өзгерістерді зерттеуге арналады.
Техникалық термодинамика - жылу мен жұмыстың түрленуін, жылу двигательдерді, тоңазытқыш қондырғыларында орын алатын жылу, механикалық және химиялық құбылыстардың өзара байланыс заңдылықтарымен айналысады.
Химиялық термодинамика - жалпы термодинамика заңдылықтарын химиялық реакция, физика-химиялық құбылыстарға қолдануын қарастырады. Яғни:
- химиялық және фазааралық тепе-теңдік күйді;
- белгілі бағытта реакция жүруін;
- химиялық реакция нәтижесінде бөлінетін энергияның түрленуін зерттейді.
Термодинамика төрт постулатқа негізделген. Оларды термодинамиканың бастамасы, заңы немесе принциптері деп те атайды.
Термодинамиканың нөлінші заңы. Р. Фаулер (1831ж) ұсынған. Жылу тепе-теңдігінің өтпелілігі туралы заң. Егер А мен В жүйелерінің әрқайсысы С жүйесімен жылулық тепе-теңдігінде болса, онда А мен В жүйелері де өзара жылулық тепе-теңдігінде болады.
М. В. Ломоносов (1748ж) ұсынды. Басқаша энергияның сақталу заңы ретінде белгілі. Оны былай тұжырымдауға болады: Энергия бірдей қатынаста (мөлшерде) ауысады.
Термодинамиканың бірінші заңы: Жұмыс, жылу және жүйенің ішкі энергиясының өзгеруінің арасындағы байланысты көрсетеді.
Термодинамиканың екінші заңы. Энтропияның өсу заңы ретінде мәлім. Ол әртүрлі энергиялардың жылуға толық айналатындығын, ал жылудың жұмысқа толық айналмайтынын көрсетеді.
Термодинамиканың үшінші заңы. В. Нернст (1860ж) ұсынды. Нернсттің жылулық постулаты ретінде белгілі. Ол дене температурасының абсолюттік нөлге жетпейтіндігін көрсетеді. “0 0 К температурасында көптеген химиялық реакциялардың энтропиясының өзгеруі өте аз шама, ” - деді. Кейінірек Планк (1812ж), Льюс, және Рендалл (1823ж) термодинамиканың екінші заңына байланыссыз және тәжірибе арқылы дәлелденбейтін мынадай тұжырым (постулат) айтты: абсолюттік нөл температурада өте таза кристалдың энтропиясы нөлге тең.
Ішкі энергия. Энтальпия.
Термодинамика ілімі, денелердегі энергия түрленуін олардың кеңістіктегі орналасу жағдайына тәуелсіз қарастырады, яғни макраскопиялық, кинетикалық және потенциялдық энергияларын қарастырмайды.
Кез келген жүйе - дене, зат тобынан, ал олар өздерін құрайтын атом, молекула сияқты ұсақ бөлшектерден тұратыны белгілі. Осындай жүйедегі денелердің энергиясы, өзін құрайтын ұсақ бөлшектердің қозғалысынан пайда болған энергиялардың жиынынан тұрады, яғни бөлшектердің айнымалы, бірқалыпты қозғалыстарынан, молекула - аралық әсерлесу, ядролық әрекеттесу күштерінен құралады.
U = E кин. + Е пот. + Е мол. + Е ядро
Мұндағы: U - ішкі энергия, E кин. , Е пот . - элементтер бөлшектерінің кинетикалық және потенциалдық энергиялары, Е мол. - молекула ішкі бөлшектерінің әрекеттесу энергиясы, Е ядро - ядроның ішкі бөлшектерінің әрекеттесу энергиясы.
Бөлшектердің кинетикалық энергиясы - броундық қозғалыстың нәтижесінде туындайтын энергия және ол температураға қарайлас, яғни;
Е кин. f∙(Т)
Бөлшектердің потенциалды энегиясы - бөлшектердің өзара тартылысын сипаттайды /ішкі қысым/.
Молекута ішкі бөлшектерінің әрекеттесу энергиясы - молекула құрамы мен құрылысын сипаттайды, заттар химиялық өзгеріске ұшырағанда ғана өзгереді. Осы себепті оны химиялық энергия деп те атайды.
Ядро ішкі бөлшектерінің әрекеттесу энергиясы - ядро құрамы мен құрылысын сипаттап ядролық өзгерістер орын алғанда ғана өзгереді. Бұл энергия түрін ядролық энергия деп те атайды. Химиялық реакцияларда атом ядросы мен құрылысы өзгермейтіндіктен ядролық энергия тұрақты деп қарастырылады.
Химиялық термодинамикада энергия түрлерінің ішінде құбылыстарды сипаттауда ішкі энергия (U) мен энтальпияның (Н) маңызы зор.
Ішкі энергия мен энтальпияның бір-бірінен айырмашылығы жүйеде газ тәрізді заттар болғанда ғана болады, ал конденсацияланған күйде (сұйық және қатты денелер) олардың мәні іс жүзінде бірдей болады.
Ішкі энергия жүйе энергиясының жалпы қорын көрсетеді.
Ішкі энергия - жүйені сипаттайтын шама болғандықтан, күй шамаларының /парааметрлерінің/ өзгерісі ішкі энергия шамасын да өзгертеді, яғни күй шамаларына тәуелді күй функциясы болып табылады:
U f∙ = (T, P, V)
Ішкі энергия - денені құрайтын бөлшектердің өзара әрекеттесу кезіндегі потенциалдық энергиялары мен кинетикалық энергияларының қосындысын айтады. Мұндағы кинетикалық энергия молекулалардың ілгермелі және айнымалы қозғалыстардың кинетикалық энергияларының қосындысынан, атомдағы электрондардың айналу энергиясынан, ядролардың тербеліс энергиясынан, атом ядроларындағы энергиялардан, молекула аралық өзара әрекеттесу энергияларының қосындысынан тұрады.
Ішкі энергияның абсолют шамасын анықтау мүмкін емес, химиялық термодинамикада, термодинамикалық құбылыс орын алғандағы жүйенің бір күйден екінші күйге өту кезіндегі ішкі энергияның өзгерісін білу жеткілікті.
∆U = U 2 −U 1
Мұндағы: U 1 , U 2 - жүйе күйінің әуелгі және өзгерістен кейінгі ішкі энергия шамасы. ∆U - ішкі энергия өзгеріс мәні.
Ішкі энергия - экстенсивті шама, зат мөлшеріне қарайлас.
U жүйе = U 1 + U 2 + U 3 + U і
Мұндағы: U 1 , U 2 , U 3 , U і - жүйені құрайтын бөлшектердің ішкі энергия шмалары.
Тізбектелген, бірнеше сатыдан тұратын термодинамикалық құбылыс орын алатын ішкі энергия өзгерісі, құбылыстың әрбір жаңа сатыларындағы ішкі энергия өзгерістерінің қосындысы болып табылады.
∆U = ∆U 1 + ∆U 2 + . . . ∆U і
Мұндағы: ∆U 1, ∆U 2, ∆U і - құбылыстың жеке сатыларындағы ішкі энергия өзгерісі.
Тұйықталған құбылыстар үшін ішкі энергия өзгерісі орын алмайды:
∆U = ( ט ) = 0
Ішкі энергия өзгерісі, өзгерісті іске асыру түріне тәуелсіз. /1/
Көптеген процестерде ішкі энергияның өзгеруі не жылу арқылы, не жұмыс істеу арқылы жүреді. Сонымен жылу мен жұмыс бір денеден екінші денеге энергия берілуінің екі түрі болып есептелінеді, олардың бірлігі энергия бірлігімен сәйкес келеді.
Энтальпия - қоршаған ортаға енген жүйенің өзіне лайықты ішкі энергиясы бар, сол қоршаған ортаға ену үшін өзіне тән ауа кедергісін (Р) жойып сол жүйеге қарайлас көлем (V) алады, яғни: (U + PV) - қосындысын (Н) әріпімен белгілеп - энтальпия деп атаймыз. Н = U + PV
Энтальпияның да абсолюттік мәнін емес, өзгерісін анықтайды.
∆Н = Н 2 − Н 1
Энтальпия - термодинамикалық жүйені толықтау сипаттайтын энергетикалық шама болып табылады, себебі ішкі энергия тек жабық жүйелер үшін орынды, ал энтальпияны ашық та жабық та жүйелерді сипаттауда қолдана беруге болады.
Н = U + PV - болғандықтан, энтальпия шамасы да күй функциясы болып табылады, олай болса оған ішкі энергияның қасиеттерінің бәрі де тән.
- Жүйенің белгілі бір жағдайына энтальпия шамасының нақты мәні сәйкес келеді.
- Термодинамикалық жүйенің энергетикалық күйін сипаттайтын болғандықтан - этальпия - эксстенситі шама.
Н жүйе = Н 1 + Н 2 + Н 3 + Н і
- Энтальпия өзгерісі(∆Н) іс қимыл түріне тәуелсіз және жүйе күйінің өзгеріс нәтижесін ғана білдіреді.
∆Н = Н 2 − Н 1 = (U 2 + PV 2 ) - (U 1 + PV 1 ) = ∆U + P 2 V 2 - P 1 V 1
Қоршаған ортада ауа қысымы тұрақты шама болғандықтан Р 1 = Р 2 = Р яғни:
∆U + P 2 V 2 - P 1 V 1 = ∆U + P(V 2 - V 1 ) = ∆U + P∆V
- Тұйықталған құбылыс орын алған жерде энтальпия өзгеріс шамасы нөлге тең.
∆Н( ט ) = 0
- Ішкі энергия өзгерісі сияқты, бірнеше сатыдан орын алған өзгерістер үшін энтальпия өзгерісі мынаған тең:
∆Н = ∆Н 1 + ∆Н 2 + . . . ∆Н і
- Идеалды газ энтальпиясы тек температураға ғана тәуелді, яғни тек температураның функциясы болып табылады, яғни
Н f ∙ ≈ (Т)
Жылу және жұмыс. Температура.
Энергия қарастырылып отырған жүйеден қоршаған ортаға жылу және жұмыс түрінде беріле алады. Ішкі энергия мен энтальпияға қарағанда, жылу мен жұмыс құбылысты сипаттайды, яғни іс қимылдың нәтижесі болып саналады.
Жылу (Q) мен жұмыс(W) - энергия берілу түрі, яғни қоршаған орта мен термодинамикалық жүйенің энергия алмасуы.
Жылу мен жұмыс құбылыс басталғанда басталып, біткенде бірге аяқталады. Құбылыс орын алмаса, жылу мен жұмыс көрінісі де болмайды.
Жылу мен жұмыстың бір-бірінен айырмашылығы берілу тәсілінде.
Жылу - бөлшектердің ретсіз, бағыт-бағдарсыз қозғалысы нәтижесінде, бөлшектердің өзара соқтығысып іске асатын энергия алмасуын тәсілі.
Жұмыс - реттелген, белгілі бағытта қозғалатын бөлшектердің материя арқылы іске асатын энергия берілісінің көрінісі.
Бөлшектердің реттелген қозғалысы бұзылып, ретсіз, бағыт-бағдарсыз қозғалысқа айналғанда жұмыс жылуға айналады. Ал кез келген ретсіз қозғалыс, ретті бағыииалған қозғалысқа көшкенде, жылу жұмыс атқарады. Бағыт-бағдарсыз қозғалысты ретті қозғалысқа көшіру үшін сырттан белгіілі күш жұмсауды талап етеді, ал ретті қозғалыс ретсіздікке ешқандай күш әсерінсіз-ақ ауыса алады. Сондықтан да жылу өз еркімен жұмыс атқара алмайды, ал жұмыс істелінген жерде жылу құбылысы әр қашанда байқалады. Бірақ атом молекулалық деңгейде жылу мен жұмысты өзара бөліп қарай аламыз.
Температура. Бөлмеге қойылған ыстық қайнаған су біршама уақыттан кейін салқындайды. Егер ыстықтығы бірдей екі дене үшінші бір денемен жанасса біршама уақыттан соң үшеуінің де қызулығы теңеседі. Бұдан шығатын қорытынды, дене күйі тек сыртқы жағдайлармен ғана анықталып қоймай, олардың ішкі жай күйімен сипатталатындығы шығады. Міне осындай шаманың біріне температура жатады, яғни қызулығы әртүрлі денелердің күйлері теңелгеннен кейін барып, жүйенің ішкі күйін сипаттайтын температура деген ұғым енгіздік. Бұл белгілі дәрежеде жүйеге жылу өзгерісі түрінде энергия берілуінде немесе алынуында. Осындай нәтижесінде жүйеде өзгерістер орын алады да, оны санды түрде сипаттау қажеттілігі туындайды, яғни жүйе температурасын анықтау қажеттілігі шығады. Бұл шаманы анықтау термодинамиканың әуелгі бастамасына негізделген.
Термодинамиканың әуелгі (бірінші) бастамасы.
Жүйеге жылу түрінде берілген энергия, жүйе ішкі энергиясын өзгертіп, белгілі бір жұмыс атқаруға жұмсалады және бұл математикалық тілде төмендегіше өрнектеледі: (дифференциалдық және интегралдық) .
δQ = dU + δW
Q = ∆U + W
Мұндағы: δQ, δW - өте аз мөлшердегі жылу және жұмыс, dU - өте аз шамадағы ішкі энергия өзгерісі, Q - жылу мөлшері, ∆U - ішкі энергия өзгерісі, W - жұмыс шамасы.
Енді жылу мен жұмыс мөлшерін сипаттайтын шамалармен танысамыз.
Жылу сиымдылық.
Температураның өсуіне немесе температураның кемуіне жүйеге, берілген жылудың қатынасын жүйенің (заттың) жылу сиымдылығы деп атайды.
Жылу сиымдылық (С) - дегеніміз жүйе температурасын бір градусқа арттыруға қажетті жылу мөлшері.
С=
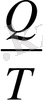 Дж/град
Дж/град
Заттың бірлік массасының температурасын бір градусқа көтеруге кететін жылу м-лшерін меншікті жылу сиымдылық (С m ) деп атайды.
С
m
=
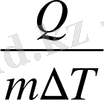 =
=
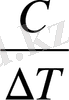 Дж/г∙К
Дж/г∙К
Мұндағы: m - зат массасы (г), Q - жылу шамасы (Дж), ∆Т - температура өзгерісі (К) .
Заттың бір мөлінің температурасын бір градусқа арттыруға қажетті жылу мөлшерін молярлы жылу сиымдылық (С n ) деп атайды.
С
n
=
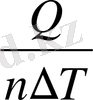 Дж/моль∙К
Дж/моль∙К
Мұндағы: n - зат мөлшері, моль.
Меншікті және молярлы жылу сиымдылықтарының арасындағы байланыс төмендегіше сипатталады:
C = M∙C m немесе C n = μC m
Мұндағы: М немесе μ - молярлы масса г/моль.
Заттың бірлік көлемінің температурасын бір градусқа жоғарлатуға керекті жылу мөлшерін меншікті көлемдік жылу сиымдылық (С V ) деп атайды.
С
V
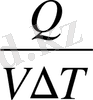
Мұндағы: V - зат көлемі, м 3
Жүйедегі заттың температурасын өте аз шамаға өзгертуге қажетті өте аз жылу мөлшерін нақты жылу сиымдылық (С) деп атайды.
C =
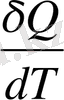
Мұндағы: δQ - өте аз жылу мөлшері, dT - өте аз температура өзгерісі.
Бірлік температураға келетін жылу мөлшерін орташа жылу сиымдылық (С) деп аатайды.
Č =
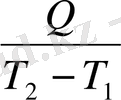 =
=
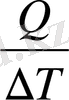
Орташа және нақты жылу сиымдылықтардың арасындағы байланысты төмендегіше өрнектейміз:
Č
V
=
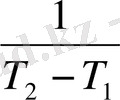
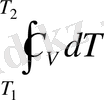 немесе Č
Р
=
немесе Č
Р
=
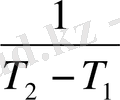
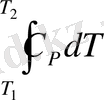
Егер құбылыс сипатын ескерсек:
Изобарлық Р-const
C
P
=
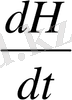 =
=
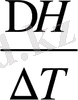
Изохоралық V-const
C
V
=
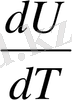 =
=
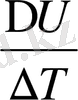
Изохоралық және изобарлық жылу сиымдылықтардың арасындағы байланысты Майер заңдылығы деген атпен таныс өрнекпен өрнектейміз.
С Р − С V = R
Заттардың жылу сиымдылығын температураға тәуелділігі тәжірибе жүзінде анықталған теңдеулермен сипатталады.
С = а + bT + cT 2 + dT 3 +∙∙∙
Мұндағы: a, b, c, d - зат табиғатына тұрақты тәуелді шамалар.
Бұл теңдеудің оң жағындағы қосылғыштардың саны жылу сиымдылықтың қандай дәлдікпен есептелуіне және температура мәндеріне байланысты. Көбінесе қосылғыштардың үш мүшесі алынады.
Газдардың әртүрлі температурадағы жылу сиымдылығын анықтауда молекулалық-кинетикалық теорияны, болмаса Планк пен Энштейннің жылу сиымдылық туралы кванттық теориясын қолданады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz