Кетондар: кетонқышқылдары, ароматтық кетондар және олардың физика-химиялық қасиеттері


Мазмұны
Кіріспе . . . 2
Негізгі бөлім.
2. 1Кетонқышқылдары . . . 3
2. 2. Ароматик кетондар . . . 9
2. 3 Кетонның физикалық және химиялық қасиеті . . . 13
Қорытынды . . . 14
Әдебиеттер тізімі . . . 15
Кіріспе.
Кетондар Женева атауы бойынша, өздері құралатын көмірсутектердің атына «он» деген жалғау жалғанып, оттектің қандай көміртек атомымен байланысып тұрғаны санмен көрсетіліп
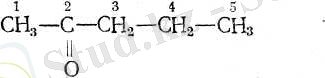
Кетон қатарының бірінші өкілі пропанон немесе оны ацетон дейді. Келесі, тарихи қалыптасқан- тривиалды атау бойынша, карбонилді топпен байланысқан радикал атына «кетон» деген сөзді қосып айтады. Мысалы ацетонды диметилкетон десе, пен-танон -2-ні метилпропилкетон деп айтады.
Кейде карбонилді топтың тұрған орнын грек әріптерімен көрсетіп те айта береді. Бұл карбон қышқылдары мен ароматты қосылыстар қатарында да жиі кездеседі. Әдетте, белгілеп көрсеткелі отырған атомға ең жақын тұрған атомды альфа (а) э екіншісін бета (р), үшіншісіи гамма, төртіншісін дельта (б), бесіншісін эпсилон (е) деп белгілейді.
Сондай-ақ, тізбектегі көміртек атомының санына қарамастан-ақ, тізбек соңындағы атомды грек әліппесінің соңғы омега (о) ) әрпімен де белгілейді,
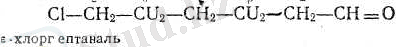
Мысалы, капрон альдегидін (гецтанальді) алайық:
Соңғы қосылысты (у-хлоргептаналь деп те атай береді, өйткені хлор
тізбектегі соңғы атомға жалғанған.
2. 1Кетонқышқылдары.
Молекуласында альдегид және карбоксил топтары бар орга-никалық қосылыстарды альдегид қышқылдары деп атайды. Сол тәрізді кетонқышқылдары деп молекулаларында тағы да кетон топшасы бар карбон қышқылдарын айтады.
Функциалдық осы екі топтың орналасу орнына қарай бұл қышқылдар а-, 3-, ү- және т. т. альдегид - және кетонқышқылдары деп бөлінеді.
Кетонқышқылдарының аттары көбінесе табиғат заттарынан өздерінің алыну әдістеріне байланысты болады. Мысалы, пиро-жүзім қышқылы СН 3 СОСООН өзінің жүзім қышқылынан пиролиз әдісімен алынуына байланысты аталған. Альдегид және кетонқышқылдары, сутектің ацил қалдығьіна алмасудан алынған, өздеріне сәйкес келетін май қышқылының туындылары деп те қаралады.
Систематикалық номенклатура бойынша бұлардың аттары-ның басына оксо деген сөз қосылып өздеріне сәйкес карбон қышқылдарының аттарынан да шығарылады (мысалы, ацетосір-ке қышқылы 3-оксобутан қышқылы, СН 3 -СО-СН 2 -СО-ОН) .
Альдегидқышқылдардың гомологтық қатары глиокеил қышқылынан Н-СО-СООН басталады. Бұл бірден бірғана. мүмкін болатын а-альдегид қышқылы. Қатардың екіншісі - формилсірке қышқылы ОСН-СН 2 -СООН. Бүл қышқыл бос күйінде белгісІз.
Глиоксил қышқылы табиғатта толық піспеген өсімдік жемістерінде кездеседі. Оның алынуы:
1) этйл спиртін, гликольді, гликоль . қышқылын азот қышқылымен тотықтыру,
2) дихлорсірке қышқылын гидролиздеу,
Тотығының аммиактағы ерітіндісімен, көгерткіш қышқылымен, бисульфитпен, гидроксиламинмен және т. с. ) және карбоксил тобына да тән әдеттегі реакцияларға да (тұздар, эфирлер және т. с. түзу) кіріседі.
Жоғарыда айтылған карбоксил тобының альдегид тобына әсер етуі сілтінің әсерінен глиоксил қышқылының Канниццаро реакциясына енуіне бейім етеді:
Кетонқышқылдарының гомологтық қатарындағы бірінші - и р о ж ү з і м қышқылы. Пирожүзім қышқылы - сұйық зат. л қышқыл спиртті ашуда аралық зат болып есептеледі .
Пирожүзім қышқылы былайша алына алады:
- жүзім қышқылының пиролизінде .
- сүт қышқылының тотығуында.
Қышқыл ретшде бүл сірке қышқылынан едәуір күштірек (карбонилдің карбоксил тобындағы сутекке жүргізетін әсерінен білінеді), кетондар мен карбоксил тобын сипаттайтын реакциялардың бәрін де береді. Екі карбонил тобының өз ара әсері күкірт қышқылымен қыздырғанда немесе қыздырмай-ақ ашытқылармен бұл қышқылды сірке альдегидіне және СО 2 ыдырауы-на бейім етеді.
СНз~СО-СООН - СНз-С-СН+СО 2
(3-кетонқышқылдарының гомологты қатары ацетосірке қ ы ш қ ы л ы н а н басталады. Ол қышқыл қант ауруымен ауырған адамдардың несебінде кездеседі.
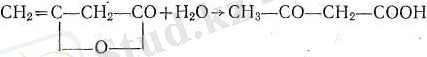
Оны қыздырғанда мынадай теңдеу бойынша ыдырайды:
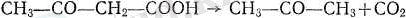
Өзінің зфирлерімен ептеп сабындандырғанда немесе дикетенге су қосылғанда да түзіле алады:
Дәл сондай тұздары да берік емес.
Ацетосірке қышқылының және оның тұздарының төзімсі болу себебі: екі карбонил тобының бір-біріне әсер етулеріне және олардың өте қосарлануы карбонил топтарына деген о-бай ланысты күшті әлсіретеді .
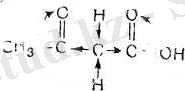
Органикалық синтезде осы қышқылдың этил эфирінің маңызы зор. Ол әр түрлі кетондар мен қышқылдарды алу үшін қолданылады. Органикалық химияның теорияларын талдау жасауда да бұл эфирдің маңызы үлкен.
Ацетосірке эфирі (ацетосірке қышқылының этил эфи-рі) -жағымды иісті сүйық зат. Қайнау темп. 181° С (ыдырай отырып қайнайды) . Суда ерімейді.
Ацетосірке эфирі дикетеннен алынады:
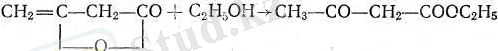
немесе органикалық синтезде маңызды роль атқаратын процестердің бірі - күрделі эфирлі конденсациялану процесін пайдаланып, сіркеэтил эфирінен (Кляйзенше) алынады.
Өсыдан түзілген комплекс (I) екі СО - топтың арасындағы пртонданған сутекпен жартылай ацеталды эфирлік қалдықтан жасалған спирттің молеку-ласын үзіп, шығарып ацетосірке эфирінің натрийлі туындысын түзеді:
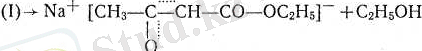
Ацетосірке эфирі - кето-енольдық таутомерияға қабілетті косылыстардың классикалык мысалы:
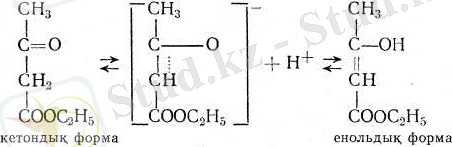
Бұл формалардың екеуі де бос күйінде алынады: кетондық формасын - қатырып алады (мұның балқу температурасы жоғарырақ), енольдігін - кварц ыдыста қыздырып айдап шығарады (бұл, кетондық формасына қарағанда, төменірек тем-пературада қайнайды) .
Дегенмен мұның екеуі де тұрақты емес, тепе-теңдік қоспаға оңай айналады, қоспада енольдық форма 10%-тен кем болады. Әр түрлі еріткіштердегі енольдық форманың мөлшері де әр түр- лі болады: еріткіштің полюстілігі неғұрлым күшті болса, кетондық формада соғүрлым көп болады.
Еріткіш Енольдың мөлшері, %
Су 0, 4Метил спирті 6, 9
Этил спирті 12, 0
Диэтилді эфир 27, 1
Гексан 46, 4
Энергия жағынан енольдық топша, кетондық топшаға қарағанда, тиімсіздеу. Дегенмен біздің алып отырған мысалымызда еноль түзілгенде еселенген байланыстардың қосарланған системасы пайда болады. Қосарлануға кеткен энергия. ұтымы еноль түзілуге жұмсалған энергияның біраз орнын, толтырды, соның салдарынан енольдану бейімділігі өседі.
Химиялық реакцияларда ацетосірке эфирі реагентке қарай кетондық немесе енольдық қасиет көрсетеді.
Кетондық формасының реакциялары:
1) бөлініп шыққан сәтіндегі сутекпен тотықсыздандыру:
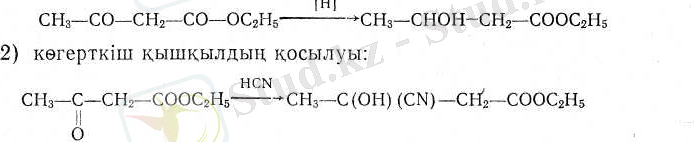
3) фенилгидразиннің әрекеті. Реакцияның нормаль өнімі спирт молекуласын жоғалтып м е т и л ф е н и л пиразолон береді
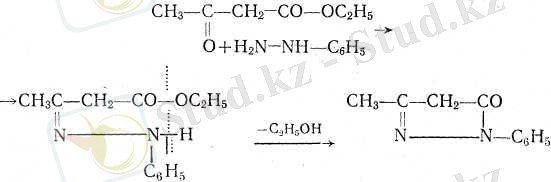
Енольдық формасының реакциялары:
Енольдың түзілуі сутектік байланыс пайда болумен де жеңілденеді:
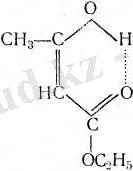
Карбонилді қосылыстардың енольдық формаларының сипаттамасы: олардың сұйытылған ерітінділеріне хлорлы темірмен әрекеттестірсе бояулы тус пайда болады. Комплексті тұз түзіледі.
Алу тәсілдері. Ароматик кетондар алу үшін май қатарының кетондарын алудың көптеген әдістерін пайдалануға болады.
2. 2. Ароматик кетондар.
2. Ароматик бір басқа қышқылдың (құмырсқа қышқылынан өзге) кальций тұздарын айдау:
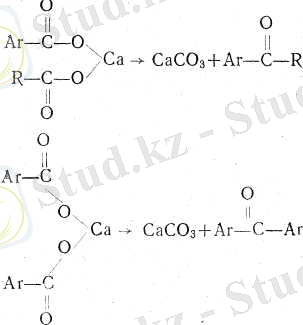
Бұдан басқа, бұл қатардың кетондарын алудың өздеріне тән_ әдістері де бар.
1. Ароматик кетондарды алудың негізгі әдісі ретінде Фри дель - Крафтс реакциясы қолданылады:
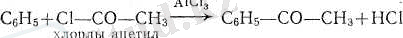
Оның дұрыс өтуі үшін бір мольден гөрі артығырақхлорлы алюминий алу керек. Хлорлы алюминий хлорангидридпен комплекс құрады деп жорамалдайды, ол комплекс хлорлы алюминийдің артық болуының еалдарынан реакция активтік негізі болады:
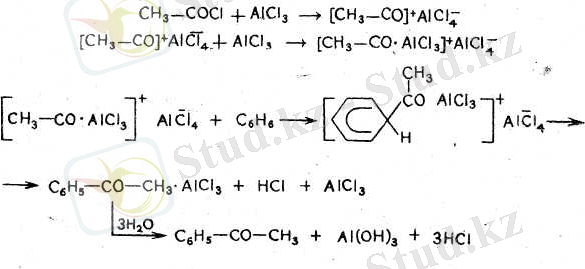
Бұл реакциялар үшін бастапқы заттар есебінде көмірсутектердің, фенолдардың эфирлерін қолдануға болады.
2. Қанықпаған ароматик кетондар ароматик альдегидтерді майлы кетондармен конденсациялау арқылы алады:
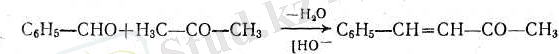
- 3. Ароматик оксикетондарды фриз реакциясы арқылы
алады.

4. Ароматик фенолкетондарды алу үшін Геш әдісі де қолданылады. Әсіресе ж-қалыпта гидроксил топтары бар көп атомдық фенолдар бастапқы заттар болып табылады:
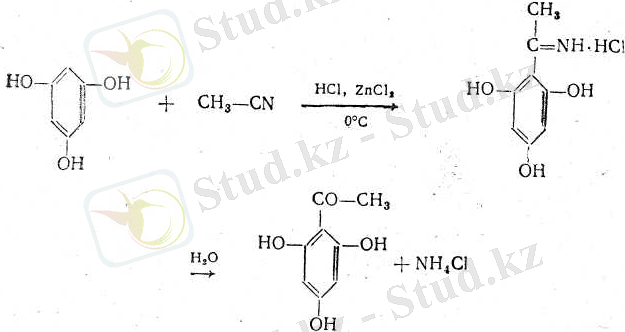
2. 3 Кетонның физикалық және химиялық қасиеті.
Физикалық қасиеттері. Ароматик кетондар-жағымды гүлдің иісі тәрізді сұйықтықтар неімесе қатты заттар. Суда ерімейді.
Химиялық қасиеттері. Май қатарының кетондарынан гөрі ароматик кетондардың реакциялық қабілеттілігі төмендеу; олар мысалы, - натрий бисульфитімен әрекет^еспейді.
1. Көпшілік кетондар гидроксиламинмен және гид-разиннің туындыларымен әдеттегі схема бойынша әрекеттеседі.
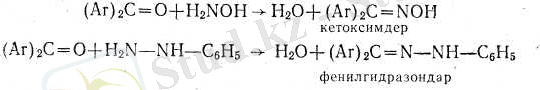
Кетондардық барлык осы азотты туындыларының ішінде ең көп назар аударатыны - оксимдер.
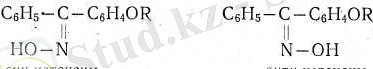

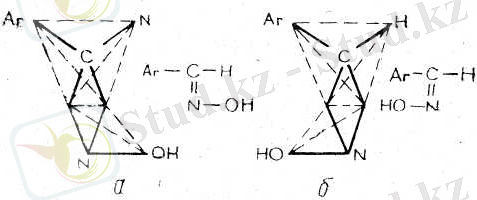
Ароматик симметриясыз кетондардың оксимдері екі геомет-риялық изомерлі түрде, син- және анти- түрде болады.
Оксимнің гидроксил тобына қарағанда ас-қалыпта кіші радикалы бар изомерді синтүр деп есептеу қалыптасқан.
Майлы ароматик кетондардың оксимдерІ әдетте (бірақ әрқашан емес) тө-зімдірек бір түрде өмір сүреді. Бұл олардың таутомерияға қабілеттілігіне бай-ланысты бір оксимді төзімдірек екінші оксимге айналдыруы ықтимал.
Бензол ядросында орынбасарлардың болуы стереоизомерлі оксимдердің тұрақтылығын арттырады. Мысалы, 2-бром-. Бензол ядросымен салыстырғанда а-қалыпта орналасқан карбонил тобы бар кетондарды катализдік тотықсыздандыруда көмірсутектердің түзілуі байқалады:
Ерітінділерде сілтілік металдармен тотықсыздандырғанда, қарастырылып отырған қатардың кетондары пинакондар береді, кейінгілер қышқылдардың әрекетімен қайта топ-тасып, пинаколиндерге айналады:
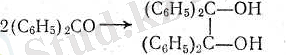
- Магнийорганикалық қосылыстар көпшілік қосылады.
- С і л т і л і к металдардың таза ароматик кетондарға қосылуы м е-•талл-кети лде р береді. Бұлар радикалдық структурасы бар түсі әбденбоялған заттар.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz