Литийдің физикалық және химиялық қасиеттері, алынуы және қолданылуы


Жоспар:
1. Литидің жалпы сипаттамасы
2. Литидің алынуы
3. Литидің физикалық және химиялық қасиеттері
4. Литидің қосылыстары
5. Литидің қолданылуы
Таңбасы Li. А r = 6, 941; М(Li) = 6, 941 г/моль.
Электрондық құрылымы : 3 Li 1s 2 2s 1
Ашылуы
Литий - гректің тас деген сөзін білдіре отырып, 1817 ж. ашылды. Берцелиустың шәкірті швед химигі И. А. Арфведсон Уто, темір кенінде табылған минералды талдай отырып, оның құрамында жаңа элемент бар екендігіне тұжырым жасаған.
1818 ж. Метал күйіндегі литийді ағылшын оқымыстысы Хэмфи Деви алды. Бұл элементті 1855 ж. неміс химигі Р. Бунзен және ағылшын ғалымы О. Матиссен де электролиз арқылы алған болатын.
Литийдің физикалық қасиеті
Литий, судан жеңіл, ауада оңай тотығатын, ашық металдық жылтыры бар, сілтілік металл тобына жатады. Ауада тез тотығатын болғандықтан, керосин, май бойында темір банкілерде сақтайды.
Изотоптары
Табиғатта литий екі түрлі изотоп түрінде ұшырасады:
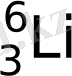 және
және
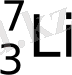 . Жасанды, ядролық реакциялар нәтижесінде радиGaктивті
. Жасанды, ядролық реакциялар нәтижесінде радиGaктивті
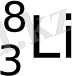 және
және
 алынады. Алғашқысының жартылай ыдырау периоды 0, 841 секунда, ал соңғысінікі - 0, 468 секунда.
алынады. Алғашқысының жартылай ыдырау периоды 0, 841 секунда, ал соңғысінікі - 0, 468 секунда.
Табиғаттағы қосылыстары
Литийдің 150-ден аса минерал түрлері бар. Тұрмыста оның негізінен бес түрі кең қолданыс табады:
Li Al [Si 2 O 6 ] - сподумен
K Li 1, 5 Al 1, 5 [Si 2 Al 10 ] - лепидолит
Li Al [Si 4 O 10 ] - петалит
Li Al [PO 4 ] (F, OH) - амблигонит
K Li (Fe, Mg) Al [Si 3 Al 10 ] (F, OH) 2 - циннвальдит.
Алынуы
Лабораторияда литий азидін ыдырату арқылы литий алынады:
2Li N
3
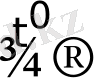 2Li + 3N
2
↑
2Li + 3N
2
↑
Li
+
+
 → Li
0
2
→ Li
0
2
2N
3
-
- 2
 → 3N
2
1
→ 3N
2
1
Өндірісте литийді көп жағдйда литий хлоридінің балқымасын электролиздей арқылы алады. Мұнан соң кезегімен литий карбонатын, литий хлоридін алады. Литий хлоридінің балқымасын, хлорлы калий тұзы қатысында электролизге ұшыратады:
Катод (болат) - : Li
+
+
 → Li сұйық
→ Li сұйық
Анод (графит) + : 2Cl
-
- 2
 → Cl
2
газ
→ Cl
2
газ
Аса таза (особо чистый) литийді LiI+LiBr қоспасын электролиздеп алады.
Литий алу барысында төмендегідей реакциялар да пайдаланылады:
Si + 2 Li
2
O
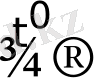 4 Li + SiO
2
4 Li + SiO
2
Кремний орнына ферросилиций қолданылады.
Литийді инертті газ атмосферасында алюмотермия әдісімен алу барысы төмендегідей тотығу-тотықсыздану реакциясына негізделген.
2 Al + 3 Li 2 O → 6 Li + Al 2 O 3
Al - 3
 → Al
3+
1 тотықсыздандырғыш
→ Al
3+
1 тотықсыздандырғыш
Li
+
+
 → Li
0
3 тотықтырғыш
→ Li
0
3 тотықтырғыш
Химиялық қасиеті
Қадірлі оқырман ! Кез-келген элементтің химиялық қасиетін сипаттау барысында, оның VIIА топша элементтерінен бастап, топша реті кему бағытына қарай әрекеттесуін негізге алдық.
1. Литий галогендермен тікелей әрекеттесіп, тұз түзеді. Фтор, хлорда литий өздігінен тұтанады.
2 Li + F 2 → 2 LiF
2 Li + Cl 2 → 2 LiCl
Сұйық броммен жайбарақат әрекеттеседі, ал иодпен қыздырғанда барып қосылыс түзеді.
LiF - суда нашар ериді және криасталлогидрат түзбейді. Литийдің өзге галогенидтері суда жақсы ериді, қыздырғанда ыдырауға түспей, балқиды.
2. Литий ауада оттегімен тез тотығады:
4 Li + O 2 → 2 Li 2 O
Қыздыру барысында литий ауада көк жалынмен жанады да Li 2 O литий оксидін түзеді.
Li 2 O қиын балқитын, суда өзге сілтілік металл оксидтеріне қарағанда баяулау әрекеттестетін негіздік оксид.
Li 2 O ауада көмір қышқыл газын оңай сіңіріп алады:
Li 2 O + CO 2 → Li 2 CO 3
Ал, Li 2 O-ның судағы ерітіндісі сілті болып табылады:
Li 2 O + H 2 O → 2 LiOH
Өзге сілтілік металдардай литий, оттегімен тікелей әрекеттесіп асқын тотық (пероксид) Li 2 O 2 түзбейді.
Литий пероксиді - литий гидроксидінің спирттегі қаныққан ерітіндісіне сутек асқын тотығымен әсер ету арқылы алынады:
2 LiOH + 2 H 2 O 2 → Li 2 O 2 · H 2 O 2 · 2 H 2 O ↓
Түзілген пероксидтер қоспасын вакуумде фосфор ангидриді үстінде ұстап, бос күйіндегі Li 2 O 2 жеке бөліп алады.
Литий күкіртпен төмендегідей қосылыстар түзеді.
2 Li + S → Li 2 S литий сульфиді
2 Li + 2 S
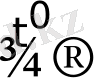 Li
2
S
2
литий дисульфиді
Li
2
S
2
литий дисульфиді
3. Сілтілік металдар ішінде азотпен жеңіл әрекеттесіп нитрид түзетін литий ғана. Температураны 250 0 С-ге дейін көтеру реакция жылдамдығын арттырады.
6 Li + N 2 → 2 Li 3 N жасыл қара түсті литий нитриді
Сұйық аммиак бойында литий сольваттанған қаракөк түсті катион түзіп ерітіндіге көшеді:
Li + xNH
3
→ [Li·уNH
3
]
+
+
 ·NH
3
·NH
3
Балқыған литий үстінен газ күйіндегі аммиакты өткізгенде литий амиді түзіледі:
2 Li + 2 NH 3 → 2 LiNH 2 + H 2 ↑
Литий фосфиді литийдің аммиактағы сұйық ерітіндісіне ақ фосформен немесе элементтерді өзара тікелей әрекеттестіру арқылы алынады:
3Li + P → Li 3 P
Фосфидтер сумен белсенді әрекеттесіп, фосфин және гидроксид түзеді.
Li 3 P + 3 H 2 O → 3LiOH + PH 3 ↑
Ал, литий арсениді Li 3 As өте тұрақсыз, ылғал әсерінен тез ыдырайды.
4. Сілтілік металдар ішінен қыздыру барысында тікелей көміртекпен және азотпен қосылыс беретіні литий элементі.
2 Li + 2C
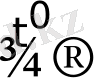 Li
2
C
2
литий карбиді
Li
2
C
2
литий карбиді
Карбид сумен жеңіл әрекеттесіп, ацетилен түзеді.
Li 2 C 2 + 2 H 2 O → 2LiOH + C 2 H 2
Қыздыру барысында Li 2 C 2 элементтерге оңай ыдырайды.
5. Сутекпен литий тұз текстес (ионды) гидрид береді:
2 Li + H 2 → 2 LiH
Li -
 → Li
+
2 тотықсыздандырғыш
→ Li
+
2 тотықсыздандырғыш
H
2
+ 2
 → 2H
-
1 тотықтырғыш
→ 2H
-
1 тотықтырғыш
Литий гидриді 450 0 С-де вакуумде қайтадан литиймен сутекке ыдырай алады:
2 LiH → 2 Li + H 2 ↑
Литий гидриді төмендегідей өзгерістерге оңай түседі:
2LiH + H 2 S → Li 2 S + 2H 2 ↑
2 H
-
-2
 → H
2
1
→ H
2
1
2 H
+
+ 2
 → H
2
1
→ H
2
1
LiH + HCl → LiCl + H 2 ↑
LiH + CO 2 → HCOOLi литий формиаты
Литий гидриді алюмогидрид алуда кең қолданылады:
LiH + (AlH 3 ) n → Li[AlH 4 ]
эфирдегі ерітіндісі литий алюминий гидриді
6. Литий сумен, спиртпен, галогеналкиндермен және қышқылдармен жайбарақат әрекеттеседі:
2 Li + 2 H 2 O → 2 LiOH + 2 H 2 ↑
2 Li + CH 3 Br → CH 3 Li + LiBr
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz