Осмий, иридий және платинаның жалпы сипаттамасы, қосылыстары, алынуы және қолданылуы


Жоспар:
- Металдардың жалпы сипаттамалары
- Ашылулары
- Қосылыстары
- Алынулары
- Жай зат күйіндегі физикалық қасиеттері
- Химиялық қасиеттері және қосылыстары
- Осмий, иридий және платина қосылыстарының қолдануы
Металдардың жалпы сипаттамалары
Осмий, иридий және платина бағалы асыл металдар топшасындағы ауыр платиналық металдар тобын құрайды.
Аталған металдардың жалпы физикалық шамалары 1-кестеде жинақталған.
1-кесте
Ar(Э)
М(Э), г/моль
M(Э), г
Электрондық құрылымы
Сыртқы энерг. қабаттары
Атом радиусы. нм Иондану потенциалы, эВ
М
1
-
 →М
+
, эВ
→М
+
, эВ
190, 2
190, 2
3, 157·10 -22 ~4f 14 5s 2 p 6 d 6 6s 2
~32) 14) 2
N O P
0, 135
8, 5
192, 22
192, 22
3, 19·10 -22 ~4f 14 5s 2 p 6 d 7 6s 2
32) 15) 2
N O P
0, 136
9, 1
195, 09
195, 09
3, 24·10 -22 ~4f 14 5s 2 p 6 d 8 6s 2
(~ 5d 10 6s 0 )
32) 18) 2
N O P
0, 138
9, 0
Жай зат күйіндегі тығыздығы, г/см 3
t балқу ºс
t балқу ºс
Ст. электр. потенциалы
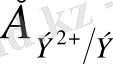
Электр терістілігі
Тотығу дәрежелері
Жер қыртысындағы масс. үлесі, %
22, 7
3050
4600
+0, 7
1, 52
0, 2, 3, 4, 5, 6, 8
5·10 -6
22, 65
2443
4500
+1, 15
1, 55
0, 1, 2, 3, 4, 5, 6
1·10 -7
21, 46
1769
3800
+1, 19
1, 44
0, 1, 2, 3, 4, 6
5·10 -7
Ашылулары
1804 ж. ағылшын ғалымы Смитсон Теннант иридий және осмий элементтерін ашты. Осмий элементінің аталуы гректің «иісің» деген сөзінен туындайды, ал иридий қосылыстары жағдайға қарай түрлі түс беретіндіктен, оның атауы да «кемпірқосақ» (радуга) деген сөзден шығады.
Платинаны 1750 ж. алған ағылшын ғалымы Уотсон болып саналады, ал жаңа элемент ретінде Шеффер зерттеулерінен кейін 1752 ж. тіркелді. Жалпы «ақ алтынның», «шірік алтынның» (гнилое золото), бақа алтынның (лягушечье золото) деген платинаға қатысты атаулар ХVIII ғ. әдебиетінде кездеседі. Платинаның түйірлері алтын өндіру барысында дербес күйінде ұшырасқанымен оны өңдеу қиын болғандықтан, тұрмыста сол кезде кең қолданыс таппады.
Платина атауы испаншы «plata»күміс деген сөзінен туындаған.
Қосылыстары
Осмий табиғатта массалық сандары 184, 186 -190 және 192 жеті түрлі изотоп түрінде ұшырасады. Бір қызығы - массалық саны жоғары осмий кең таралған. Мысалы, 184 Os - 0. 018% болса 192 Os -41% құрайды.
Жасанды радиоактивті изотоптарынан ең тұрақтысы 194 Os-жартылай ыдырау мерзімі 700 күн.
Осмий - осмиридин деп аталатын бірнеше түрде кездесетін иридий мен осмий минералдарында (17-ден 80% Os) ұшырасады. Сонымен қатар, осмит, яғни жеке дербес осмий, сисерскит деген минералдары бар.
Иридий - осмиймен бірге жүреді, ал платина металдары никель-мыс рудаларымен бірге қабаттасып жүреді.
Иридий - осмирид және невьянскит (80%-ке дейін Ir бар) деген минералдар құрамында ұшырасады.
Иридийдің табиғатта екі изотопы ұшырасады:
191 Ir - 38, 5%; 193 Ir - 61, 5%.
Радиоактивті жасанды иридий изотоптары ішінен 192 Ir кең қолданыс табады.
Платина - куперит (PtS), бреггит (Pt, Pd, Ni) S минералдары түрінде және дербес күйінде ұшырасады.
Сонымен қатар, платина полигексан (80-88% Pt, 9-10% Fe), купроплатина (65-73% Pt, 12-17% Fe, 7-14% Cu), спериллит - PtAs 2 минералдары құрамында бар.
Дербес күйіндегі платинаның 5918, 4 және 7960, 5 г кесектері Ресейдің «Алмаз қоры» көрмесінде сақталуда.
Алынулары
Платина металдарын өндіру технологиясын, жолдарын жетілдіру өз шешімін күткен мәселе.
Осмий
Осмийді OsO 4 түрінде алып болғаннан соң, оны [OsO 2 (NH 3 ) 4 ] Cl 2 қосылысына айналдырады. Алынған тұнбаны сутек атмосферасында қыздыру арқылы кеуекті (губчатый) осмий алынады:
[OsO
2
(NH
3
)
4
] Cl
2
+ 3H
2
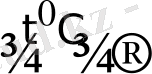 Os + 4NH
3
+ 2HCl + 2H
2
O
Os + 4NH
3
+ 2HCl + 2H
2
O
Осмий алу барысында оның оксидтерін де тікелей сутекпен тотықсыздандыруға болады:
OsO 4 + 4H 2 → Os + 4H 2 O
Сонымен қатар, калийдің гексахлоросмиатын (IV) мырышпен тотықсыздандыруға болады:
K 2 [OsCl 6 ] + 2Zn → Os + 2ZnCl 2 + 2KCl
Иридий
Иридийді - «осмиридий» қоспасынан никель тазарту барысында түзілетін анодтың шламдардан өндіреді. «Осмиридий» шикізатын және платина алу барысында патша арағында ерімей қалған қалдықтарды ВаО 2 -мен қосып балқытады.
Технологиялық желіге сай бірнеше іс-амалдар жүзеге асырылған соң, қызыл сары (NH 4 ) 2 [IrCl 6 ] қосылысын термиялық өңдеуге ұшыратып иридий металын алады:
(NH 4 ) 2 [IrCl 6 ] + 2H 2 → Ir + 2NH 3 + 6HCl
Платина
Платина да гидрометаллургиялық платина рудаларынан және анодтық шламдардан алынады. Платинаның сары түсті (NH 4 ) 2 [PtCl 6 ] комплексін алынған соң, оны да термиялық өңдеу арқылы ыдыратады. Дәл осы жолмен платинохлорлысутек қышқылын H 2 [PtCl 6 ] термиялық жолмен өңдеп ұнтақ платина алады:
(NH 4 ) 2 [PtCl 6 ] → 2NH 3 + Pt + 2Cl 2 ↑ + 2HCl
H 2 [PtCl 6 ] → Pt + 2HCl + 2Cl 2
Жай зат күйіндегі физикалық қасиеттері
Осмий (Os) - ақ күміс түстес, қатты, қиын балқитын, морт, ауыр металл. Моос шкаласында қаттылығы 0, 7 шамасын құрайды. Дербес күйінде ұшыраспайды.
Иридий (Ir) - ақ күміс түстес, родийге ұқсас, өте қатты морт ауыр металл.
Платина (Pt) - ақсұр металлдық жылтыры бар, өңдеуге қиын көнетін осмий, иридийге қарағанда жұмсақ металл. Платина сым созуға, тақта етіп өңдеуге (прокалка) жеңіл көнеді.
Платина металдарының құрамында аздаған қоспалардың болуы, оларға пластикалық қасиет береді. Бұл орайда осмий, иридий, платина ішінен соңғы металды ерекше атауға болады.
Химиялық қасиеттері және қосылыстары
Осмий - Иридий - платина бағытында солдан оңға қарай аталған металдардың оттек әсеріне тұрақтылығы артады. Мысалы, ұнтақ осмий кәдімгі жағдайдың өзінде ауада тотығып OsO 4 түзеді:
Os + 2O 2 → OsO 4 -ұшуға бейім, улы оксид!
Қыздыру барысында ұнтақ иридий де тотығады:
2 Ir
2
+ 3O
2
 2Ir
2
O
3
2Ir
2
O
3
Платина қыздыру барысында оттекте тотығады да, түзілген оксидтер одан әрі қыздыру барысында қайта ыдырайды:
Pt + O
2
→ PtO
2
; PtO
2
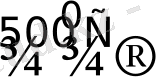 Pt + O
2
Pt + O
2
Осмий (ІІІ) оксиді қыздырғанда ыдырайды:
OsO 4 → OsO 2 + O 2 ↑
Ал, осмий (ІV) оксиді болса, жоғары температурада диспропорцияналды:
2OsO 2 → OsO 4 + Os
Осмий (VІІІ) оксиді қышқыл-сілтілермен әрекеттеседі:
OsO 4 + 4 HCl → OsO 2 + 2 Cl 2 + 2H 2 O
2OsO 4 + 4KOH → 2K 2 OsO 4 + O 2 + 2H 2 O
OsO 4 + 2 KOH + KNO 2 → K 2 OsO 4 + KNO 3 + H 2 O
K 2 OsO 4 - күлгін түсті кристалды зат, қышқылдар қатысында диспропорциялануға ұшырайды.
2K 2 OsO 4 + 2H 2 SO 4 → OsO 4 + OsO 2 + 2K 2 SO 4 + 2H 2 O
Os
6+
- 2
 → Os
8+
1
→ Os
8+
1
Os
6+
+ 2
 → Os
4+
1
→ Os
4+
1
OsO 4 - қышқылдық қасиетті әлсіздеу көрсетеді және Л. А. Чугаев K 2 [OsO 4 (OH) 2 ] түріндегі қосылысты ала білді:
2KOH + OsO 4 → K 2 [OsO 4 (OH) 2 ]
Иридий оксиді диспропорциялануға бейім:
2Ir
2
O
3
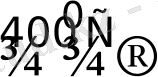 Ir + 3IrO
2
Ir + 3IrO
2
2Ir
2
O
3
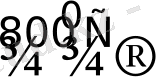 4Ir + 3O
2
4Ir + 3O
2
Иридий (III) оксидіне сәйкес келетін Ir(OH) 3 натрийдің гексахлороиридат
(III) комплексіне CO 2 атмосферасында сілті ерітіндісімен әсер ету арқылы алынады:
Na
3
[IrCl
6
] + 3KOH
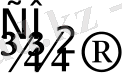 Ir(OH)
3
+ 3NaCl + 3KCl
Ir(OH)
3
+ 3NaCl + 3KCl
Ir(OH) 3 - қыздырғанда диспропорцияланады:
4Ir(OH)
3
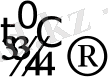 3Ir(OH)
4
+ Ir
3Ir(OH)
4
+ Ir
Сілтілік ортада, оттекпен Ir(OH) 3 иридий (VI) оксидіне көшеді:
4Ir(OH) 3 + 3 O 2 → 4IrO 3 + 6H 2 O
Платина оксиді 550 0 C -де ыдырайды
2PtO
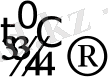 2 Pt + O
2
2 Pt + O
2
Pt 2 O 3 ·nH 2 O, PtO 2 ·2H 2 O қосылыстарын PtCl 3 -ті натрий корбанатымен
PtCl 4 -натрий гидроксидімен ерітінділерімен қайнату арқылы алады:
2PtCl 3 + 3Na 2 CO 3 + nH 2 O → Pt 2 O 3 ·nH 2 O + 6NaCl + 3CO 2
PtCl 4 + 4NaOH → PtO 2 · 2H 2 O + 4NaCl
OsO 2 ·2H 2 O - қышқыл, суда нашар еритін қаракөк ұнтақ СО 2 атмосферасында төмендегі реакция бойынша түзіледі:
K 2 [OsCl 6 ] + 4NaOH → OsO 2 · 2H 2 O + 4NaCl + 2KCl
Жалпы, ұнтақ еүйіндегі металдарға қарағанда, олардың кесекті түрде (компактный) болуы, олардың тұрақтылығын арттырады.
Ұнтақ металдарды фтор, хлор атмосферасында қыздыру олардың галогенидтерін береді:
Os + F
2
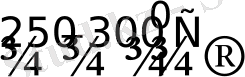 OsF
2
(OsF
4
, OsF
6
, OsF
8
) ;
OsF
2
(OsF
4
, OsF
6
, OsF
8
) ;
Ir + F 2 → IrF 2 (IrF 4 , IrF 6 ) ;
Pt + F 2 → PtF 2 (PtF 4 , PtF 6 ) .
Осы арады мына мәселеге назар аудартқымыз келеді. В. В. Некрасовтың «Основы общей химии» III томында OsF 8 жоққа шығарылады. »1958 ж. дейін» OsF 6 және OsF 8 қосылыстары шын мәнінде OsF 5 және OsF 5 болып табылады», -делінеді. Сонымен қатар», Краткая химическая энциклопедия» кітабында тұрақсыз OsF 7 қосылысы алынғаны, ал OsF 8 -қайнау температурасы 47, 5 0 С екендігі келтіріледі.
Ал, И. А. Зубович «Неорганическая химия», -М. :Высшая школа, 1989. -432 с. оқулығында осмий октафторидінің сумен әрекеттесу теңдеуін келтірілген:
OsF 8 + 4H 2 O → OsO 4 + 8HF
Бәлкім OsF 8 жылдам гидролизге ұшырайтын (ауа ылғалы әснріненде) болғандықтан, оның октафториді пікірталас тудырып отырған шығар. Бәрінің де жауабын тәжірибе көрсетеді, ал сіздің бұл мәселеден хабардар болғаныңыз жөн.
Хлормен бірінші кезекте дихлоридтер түзіледі:
Os + Cl 2 →OsCl 2 (OsCl 4 )
Ir + Cl 2 → IrCl 2 (IrCl, IrCl 3 , IrCl 4 )
Pt + Cl 2 → PtCl 2 (Pt 6 Cl 12 )
Тетрахлорплатина H 2 [PtCl 6 ] қосылысын ыдырату арқылы алынады:
H 2 [PtCl 6 ] → PtCl 4 + 2HCl
Платина металдарының галогенидтері қыздыру барысында ыдырайтыны белгілі:
PtCl
4
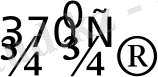 PtCl
3
PtCl
3
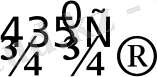 PtCl
2
PtCl
2
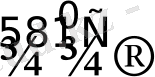 PtCl
PtCl
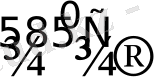 Pt + Cl
2
Pt + Cl
2
PtBr
4
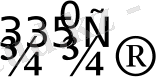 PtBr
3
PtBr
3
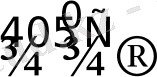 PtBr
2
PtBr
2
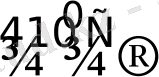 Pt + Br
2
Pt + Br
2
PtI
4
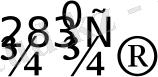 PtI
3
PtI
3
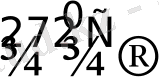 PtI
2
PtI
2
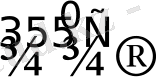 Pt + I
2
Pt + I
2
Дәл осындай өзгерістер IrCl 4 , OsCl 4 , OsI 3 үшін де тән:
OsCl 4 → OsCl 3 → OsCl 2 → OsCl → Os
OsI 3 → OsI 2 → OsI → Os + I 2
Металл галогенидтерінің әртүрлі қасиет көрсететініне дәлел болатын төмендегі реакциялар:
2 IrF 6 + 10 H 2 O → 2 Ir(OH) 4 + 12 HF + O 2 ↑
+1 +5
PtF 6 + O 2 → O 2 [PtF 6 ] диоксогенил гексафторо
платинат (V)
Pt
+6
+
 → Pt
+3
1
→ Pt
+3
1
O
2
-
 → O
2
+
1
→ O
2
+
1
PtCl
4
+ 2 H
2
O
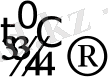 H
2
[Pt(OH)
2
Cl
4
]
H
2
[Pt(OH)
2
Cl
4
]
Галогенидтер-фторлы сутек, хлорлы сутек қышқылдарымен комплекс түзуге бейім:
OsF 4 + 2HF → H 2 [OsF 6 ]
IrCl 3 + 3HCl → H 3 [IrCl 6 ]
PtCl 4 + 2HCl → H 2 [PtCl 6 ]
PtCl 4 -қоңыр қызыл ұнтақ, сумен қосылып пентагидрат түзуге бейім.
Аталған металдар азотпен, сутекпен, көміртекпен әрекеттеседі.
Сутек бұл металдар бетінде адсорбцияланып, диссоциацияға ұшырайды, бойына сіңіріледі. Мысалы, 450°С-де Pt бір көлем бірлігі, сутектің 70 көлем бірлігін бойына сіңіреді. Осмий сутегін өте аз сіңіреді.
Жоғары температурада, көміртек, платина металдарының балқымасында ериді, ал платинаның өзі бойында көміртекті жақсы тұтады. Мысалы, платинадан жасалған ыдысты күйелі жалындағы көміртек қызған платина бойына көшті.
Лабораторияда платина оймақтарын (тигли), ыдыстарын күйелі жалынды газ жалынына (газовые горелки) қыздырмайды.
Платина металдары халькогенидтерімен, бор және кремниймен металл іспеттес (металлоподобные) валенттік ережелеріне бағына бермейтін бинарлы қосылыстар түзеді. (OsS 2 , OsTe 2 , PtS 2 , PtTe 2 т. с. с. ) .
Кесекті түрдегі (компактный) осмий және иридийге қышқылдар, патша арағы әсер етпейді, ал ұнтақ күйінде баяу әсерлеседі, концентрлі тұз қышқылы, патша арағы, су буы қатысында цианды калий платинаны ерітеді:
Pt + 6HCl + O 2 → H 2 [PtCl 6 ] + 2H 2 O
Pt + 18HCl + 4HNO 3 → 3H 2 [PtCl 6 ] + 4NO + 8H 2 O
Pt + 4KCN + 2H 2 O → K 2 [Pt(CN) 4 ] + 2KOH + H 2 ↑
Осмийді тотықтырғыштар қатысында сілтімен қосып балқытқанда осматтар түзіледі:
Os + 3KNO 3 + 2KOH → K 2 OsO 4 + 3KNO 2 + H 2 O
Os + KClO 3 + 2KOH → K 2 OsO 4 + KCl + H 2 O
Ұнтақ осмийді концентрлі азот қышқылымен қосып қыздырғанда баяу әрекеттесіп OsO 4 түзеді.
Os + 4HNO 3 + O 2 → OsO 4 + 4NO + 2H 2 O
Иридийді балқыған ас тұзы қатысында хлорлап, суда еритін қосылысын алады:
Ir + 2Cl 2 + 2NaCl → Na 2 [IrCl 6 ]
Жоғары қысымда (250 атм. . ) және 150-200 0 С-де көміртек (II) оксиді атмосферасында осмий, иридий карбонилдер түзеді:
Os + 5CO
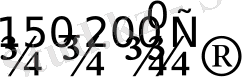 Os(CO)
5
Os(CO)
5
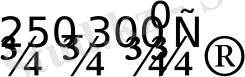 Os + 5CO
Os + 5CO
250 атм.
Os(CO) 5 кәдімгі жағдайда түссіз сұйық, бірті-бірте сары түсті кристалл Os 3 (CO) 12 -ге өтеді. Os(CO) 5 -жоғары температурада және қысымда осмий (VIII) оксидінен де алынады:
300 атм.
OsO
4
+ 5CO
 Os(CO)
5
+ 2O
2
↑
Os(CO)
5
+ 2O
2
↑
250 атм.
2Ir + 8CO
 Ir
2
(CO)
8
Ir
2
(CO)
8
Платина үшін карбонилдер белгілі болғанымен, аталған қосылыстар оған тән емес.
Балқыған сілті, пероксидтер осмий, иридий, платинамен қосылады.
2Os + 4KOH + 3O 2 → 2K 2 OsO 4 + 2H 2 O
2Ir + 4KOH + 3O 2 → 2K 2 IrO 4 + 2H 2 O
2Pt + 4KOH + 3O 2 → 2K 2 [PtO 4 ] + 2H 2 O
Осмий, иридий, платина көптеген комплексті қосылыстап түзеді және оны арнайы әдебиеттен тереңірек оқыған жөн. Төменде металдардың әртүрлі тотығу дәрежелеріне сәйкес кейбір комплексті қосылыстар түрлерін назардан тыс қалмау үшін келтірдік.
0
+2
+3
+4
+6
+8
үшжақты бипирамида тетраэдр октаэдр
октаэдр
октаэдр
октаэдр тетраэдр октаэдр
Os(CO) 5
-
K 2 [Os(CN) 6 ] K 3 [Os(CN) 6 K 3 [OsCl 6 ]
K 2 [OsO 2 Cl 4 ] K 2 [OsO 4 ] K[OsO 3 N] K 2 [OsO 4 (OH) 2 ]
Ir 2 (CO) 8
- [Ir(NH 3 ) 6 ] Cl 3 Na 3 [Ir(NO 2 ) 6 ] (NH 4 ) 2 [IrCl 6 ] Cs 2 [IrCl 6 ] N + O [IrF 6 ] -
-
-
квадрат
K 2 [Pt(CN) 4 ] K 2 [Pt(NO 2 ) 4 ] - [Pt(NH 3 ) 6 ] Cl 4 H 2 [PtCl 6 ] Xe + [PtF 6 ] -
-
Осмий, иридий және платина қосылыстарының қолдануы
Осмий және оның қосылысы осмий (VIII) оксиді катализатор ретінде қолданылады.
OsO 4 - фармацевтикада «кортизон» дәрісін синтезделуде және өсімдіктер мен тіршілік дүниеліктерінің жасушаларын (клеткаларын) зерттеуде пайдаланылады.
OsO 4 - улы, көзге қатты әсер етеді.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz