Рубидий, цезий және францийдің физикалық-химиялық қасиеттері, табиғаттағы кездесуі, қосылыстары және алыну әдістері


Жоспар:
- Жалпы сиаттамасы.
- Рубидий, цезий физикалық және химиялық қасиеттері.
- Табиғатта кездесуі.
- Рубидий, цезий қосылыстары
- Рубидийді, цезийдің алыну жолдары
- Франций
- Изотоптары
1. Рубидий - латын тілінде «қызыл» деген мағынаны білдіреді.
Таңбасы Rb. A r (Rb) = 85, 468; М(Rb) = 85, 468 г/моль.
Электрондық құрылымы : 37 Rb 1s 2 2s 2 p 6 3s 2 p 6 d 10 4s 2 p 6 5s 1 .
Ашылуы
Лепидолит минералы құрамынан спектроскопиялық әдіспен 1861 ж. рубидий элементін ашқын неміс ғалымдары Кирхгофф және Бунзен болып есептелінеді
Спектрдің қара-қызыл сызықтары жаңа затқа тән екендігін ескере отырып, оның аталуын қызыл деп қабылдаған.
Рубидий- жұмсақ, металдық жылтыры бар, оңай балқитын сілтілік металл.
Табиғи изотоптары
 - 72, 15%;
- 72, 15%;
 - 27, 85%.
- 27, 85%.
Табиғи қосылыстары
Рубидий тау жыныстары мен минералдық қосылыстар құрамында өте аз мөлшерде ұшырасады. Кларк мөлшері 9-15·10 -3 %.
Лепидолит минералы құрамында Rb 2 O түрінде 0, 2% кейде 1-3% шамасында кездеседі.
Рубидий тұздары теңіз, мұхит суларында, өсімдіктер дүниесі - шай, қант құрағы, кофе дәнінде, темекі жапырағының күлінде 0, 0004%-ке дейін болады.
Рубидий карналитке ұқсас RbCl·MgCl 2 ·6H 2 O минералын түзеді және сол карналитпен қатты ерітінді түрінде де ұшырасады.
Рубидий - мыс, мырыш, қалайы, қорғасын секілді элементтерден көп, алайда өндірілуі қиын, шығынды көп қажет етеді.
Алынуы
Рубидийді оның хлоридінен кальциймен вакуумде тотықсыздандыру арқылы алады:
2RbCl + Са
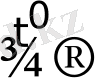 CaCl
2
+ 2Rb
CaCl
2
+ 2Rb
Реакция темір түтікте вакуум жағдайында кварцтан жасалған құрылғы ішінде жүзеге асырады. Температура 700-800 0 С шамасында рубидий хлориді - хлорын кальцийге беріп, рубидий өзі металл күйінде буланып ұшады.
Қолданылуы
Рубидий элементі - әлі әзірге кең қолданысқа ие болған жоқ. Әлемдік рубидий өндірісі жылына бірнеше ондаған килограммды ғана құрайды.
Рубидий қосылыстары - жарақат ауыртпалығын ауырсынбау үшін эпилепсияның кейбір түрлерін емдеуде, мазасызданып ұйқы қашқанда, жайбарақаттандырып ұйқы шақыру дәрмегі ретінде пайдаланылады.
Аналитикалық химияда Mn, Zr, Au, Pd және Ag элементтерін анықтау барысында рубидий реактивтері қолданылады.
Рубидий қосылыстарының катализаторлық қасиеті жан-жақты зерттелуде. Синтетикалық мұнай өнімдері синтол алуда катализатордың маңызды құрамдас бөлігі болып рубидий қосылыстары саналады.
С и н т о л деп - 140-150 атм. қысымда 410 0 С температурасында «су газынан» (сутек және иіс газы қосып) түзілген спирт, альдегид, кетон қоспасын атайды.
Ал төмен қысымда және температурада (0, 1-1 МПа, ~200°С Со, Fe - kt) көмірсутектер - синтин алынады.
2. Цезий
Таңбасы - Cs. A r (Cs) = 132, 901; М(Cs) =132, 901 г/моль.
Электрондық құрылымы : 55 Cs 1s 2 2s 2 p 6 3s 2 p 6 d 10 4s 2 p 6 d 10 5s 2 p 6 6s 1
Ашылуы
Неміс ғалымдары Бунзен және Кирхгофф 1860 ж. цезий элементін ашқан деп есептеледі.
Таза металл күйіндегі цезий тұңғыш рет 1882 ж. швед химигі Сеттербергтер электролиз нәтижесінде тұз балқымаларынан бөліп алды.
Цезий - тұтқырлығы жоғары, кәдімгі температурада сүзбе күйінде болатын сілтілік металл. Балқу температурасы 28, 5 0 С.
Табиғи изотопы
:

Табиғи қосылыстары
Цезийдің сирек ұшырасатын табиғатта екі минералы бар:
поллуцит (Cs, Na) [AlSi 2 O 6 ] ·nH 2 O
авогадрит K · Cs(BF 4 ) .
Цезий - берилл, карналлит құрамында да ұшырасады.
Цезий кларкі - 3·10 -4 %.
Алынуы
Цезий вакуумды - термиялық тотықсыздандыру арқылы поллуциттен алынады. Поллуцитті өңдеу арқылы хлорид алынады да, оны кальциймен тотықсыздандырады:
2 CsCl + Ca → CaCl 2 + 2Cs
Мұнай өндіру барысында жерасты суларынан цезийді экстракциялық және сорбциялық жолмен де алады.
Қолданылуы:
Цезий және оның қосылыстары:
- Радиотехникада, әртүрлі приборлар жасауды;
- Электрлік вакуумды фотоэлементтер алуда;
- Фотоэлектронды көбейткіштер және электронды - оптикалық түрлендіргіштер (преобразователей) өнеркәсібінде;
- Жартылай өткізгіштік қасиетке ие пьезоэлектрлі және сегнетоэлектрлі кристалдар алуда;
- Аккумуляторлар жасауда;
- Катализаторлар құрамында цезий-ароматты көмірсутектердің сутектендірілуін (гидрогенизация) жеделдетеді;
- «атом сағаттарын» жасауда қолданылады.
Соңғы кезде Cs плазмасы жан-жақты зерттелуде. Бұл бір жағынан термоядролық синтезді басқану жағына жол ашады.
Зияндылығы
Цезий өндірісінде жұмыс істейтін адамдардың жүрек қан тамырлар жүйесі бұзылып, жоғары тыныс ауруына шалдығуы байқалған.
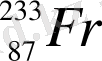 3. Франций
-
3. Франций
-
Ашылуы
Периодтық заңдылықты пайдалана отырып, Д. И. Менделеев францийге - экацезий ретінде 1871 ж. жорамал жасаған болатын. Франций элементін Мария Складовская-Кюридің шәкірті Маргарита 1939 ж. ашты.
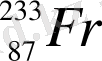 Франций
- радиGaктивті элемент, сілтілік металл. Ең тұрақты деген франций изотопының жартылай ыдырау мерзімі - 22 минут, балқу температурасы 8
0
С, ал қайнау температурасы 620
0
С.
Франций
- радиGaктивті элемент, сілтілік металл. Ең тұрақты деген франций изотопының жартылай ыдырау мерзімі - 22 минут, балқу температурасы 8
0
С, ал қайнау температурасы 620
0
С.
Табиғи - жер массасындағы үлесін жинағанда 500 г ғана шамасын құрайды.
Сондықтан да франций элементін зерттеу - оның жасанды радиактивті изотоптарын пайдалануға негізделген.
Мысалы, алтыннан жасалған қаңылтырды (фольга) неон-22 иондарымен атқылағанда (140 МэВ) франций-212 түзіледі.
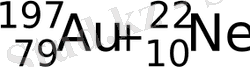 →
→
 →
→

Ядролық реакциялар нәтижесінде францийдің массалық саны 203-тен 229-ға дейінгі 27 түрлі изотопы алынды.
Қолданылуы:
- Францийді пайдалану арқылы актиний элементін табиғи қосылыстарда оңай анықтауға болады.
- Францийді медицина саласында қолдану жолдары зерттелуде;
- Франций тұрмыста кең қолданыс таба қойған жоқ.
Рубидий, цезий және францийдің химиялық қасиеттері
1. Аталған элементтер галогендермен белсенді түрде әрекеттесіп, яғни өздігінен тұтанып тұз түзеді:
2 Rb + Cl 2 → 2 RbCl
2 Cs + Cl 2 → 2 CsCl
2 Fr + Cl 2 → 2 FrCl
Ал, аталған элементтер сұйық броммен қопарылыс бере әрекеттеседі. Иодпен әрекеттесу өзге галогендерге салыстырғанда жайбарақат өтеді.
2. Оттекпен Rb, Cs, Fr әрекеттесіп пероксидтер түзеді:
Rb + O 2 → Rb 2 O 2
Cs + O 2 → Cs 2 O 2
Әдебиетте К, Rb, Cs кәдімгі атмосфералық жағдайда оттекпен асқын пероксидтер түзетіні айтылады:
Rb + O 2 → RbO 2
Cs + O 2 → CsO 2
Сонымен қатар, төмендегідей құрамдағы оксидтер бар екендігі белгілі:
Rb 6 O; Rb 9 O 2 ; Cs 7 O; Cs 4 O; Cs 3 O; Cs 11 O 3
Рубидий, цезий пероксидтерінде, асқын пероксидтерінде-натрий, калий пероксид, асқын пероксидтерінде байқалатын қасиеттер тән.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz