Рутений, родий және палладий: физика-химиялық қасиеттері, қосылыстары, өндіру және қолданылуы


Жоспар:
- Рутений, родий және палладий элементтері, ашылуы, табиғи изотопы
- Қосылыстары
- Физикалық және химиялық қасиеттері
- Табиғатта кездесуі
- Технологиясы
- Аналитикалық сипаттамалары
- Палладийді қолдану
Металдардың жалпы сипаттамасы
Рутений, родий, палладий бағалы асыл металдар қатарына жатады. Олардың кейбір физикалық шамалары төменде кестеде келтірілген.
1-кесте.
А r (Э)
М(Э), г/моль
m(Э), г
Электрондық құрылымы
Атом радиусы, нм
Иондану потенциалы, эВ
Жай зат күйінде тығыздығы, г/см 3
t балқу , 0 С
t қайнау. , 0 С
Электрлік терістігі
Ст. электр потенциалы
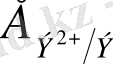
Тотығу дәрежелері
Жер қыртысындағы массалық үлесі,
101, 07
101, 07 1, 677·10 -22
~ 4d 6 5s 2 (4d 7 5s 1 )
0, 132
7, 36
12, 8
2400
4200
1, 42
+0, 45 0, 1, 2, 3, 4, 6, 7, 8
9·10 -7
102, 9055 102, 9055 1, 708·10 -22
~ 4d 7 5s 2 (4d 8 5s 1 )
0, 1345
7, 46
12, 42
1966
3900
1, 45
+0, 60
0, 1, 3, 4, 6
2·10 -8
106, 4
106, 4 1, 766·10 -22
~ 4d 8 5s 2 (4d 10 5s 0 ) 0, 1375
8, 33
12, 03
1555
3173
1, 35
0, 83
0, 2, 4, 6
2·10 -7
Ашылулары
Рутенийді 1844 жылы Казан университетінің профессоры Карл Клаус ашты. ресейдің латынша атына сәйкес Ruthenia, яғни Россия дегенді білдіреді. Рутений -ядролық реакциялар нәтижесінде түзіледі.
Родийді 1833 жылы ағылшын ғлымы Уильям Волластон ашты. Родий қосылысының ерітінділерінің түстері раушан гүлі реңдес (розовый) және жаңа элемент атауын осыдан алады.
Палладий мен родийді қатар ашқан жоғарыда аталған ғалым Уильям Волластон болып саналады. У. Волластон палладий элементінің «Паллада» астероидының ашылуына орай палладий данышпандық құдайы Афина Паллада құрметіне атаған болатын.
Қосылыстары
Рутений - платина және палладий минералдарымен бірге кездеседі.
Рутенийдің табиғатта өте сирек ұшырасатын RuS 2 -лаурит минералы бар.
Рутений қосылыстарын өз бойына жинақтайтын минерал қатарына пиролюзитті (MnO 2 ), ал өсімдіктер тарапынан бұршақты дәнді дақылдарды (тамырына жинақталады) атауға болады.
Родий, палладий - платина және мыспен икелі бар полиметалл рудаларында бірге ұшырасады.
Родий өте сирек кезддесетін осмийлі придийдің бір түрі родийлі невьянскит минералы құрамында бар (11, 3 % Rh) .
Палладий - дербес (самородный) металл түйірлері және Pd 3 Sb, Pd 3 Sn, PdO қосылыстары түрінде кездеседі.
PdHg - потарит минералы 34, 8 % Pd, 65, 2% Hg-тан тұрады. Дербес күйінде ұшырасатын алтынның бір түрі палладийлі алтын немесе порпецит құрамында Pd - 8-11% құрайды. Сыртқы түріне қарап порпецитті алтыннан айыру өте қиын.
Алынулары
Рутений, родий және палладий табиғатта сирек және бірге ұшырасаты элементтер болғандықтан, оларды өндіру өте күрделі және бірнеше сатыдан тұратын іс-амалдарды жүзеге асыруды талап етеді.
(Благородные металлы. Справочник / Под ред. Е. М. Савицкого. -М. : Металлургия, 1984) .
Рутений - рутений концентратынан RuO 4 және (NH 4 ) 3 [RuCl 6 ] қосылыстарын алып, оларды қыздыру барысында сутекпен тотықсыздандыру арқылы алаынады.
RuO 4 + 4H 2 → Ru + 4H 2 O
2(NH 4 ) 3 [RuCl 6 ] + 3H 2 → 2Ru +6NH 3 ↑ + 12HCl↑
Родий - [Rh(NH 3 ) 3 ] Cl 3 комплексінен қыздыру барысында сутекпен тотықсыздандырылып алынады. Технологиялық желіге сәйкес родий қосылысы (NH 4 ) 2 Na[Rh(NO 2 ) 6 ] комплексіне айналдырылады. Алынған қосылысты NaOH-та ерітіп NH 4 Cl қосылады да [Rh(NH 3 ) (NO 3 ) 3 ] бейтарап комплексі алынады. Мұнан соң, алынған қосылысқа тұз қышқылымен әсер етіп родийдің аммиакты қосылысы [Rh(NH 3 ) 3 ] Cl 3 алынады. Металл алу үшін қыздыру барысында сутекпен тотықсыздандырады.
2[Rh(NH 3 ) ] Cl 3 + 3H 2 → 2Rh + 2NH 3 ↑ + 6HCl↑
Палладий - [Pd(NH 3 ) 2 ] Cl 2 комплексінен сутекпен тотықсыздандыру арқылы алынады:
[Pd(NH 3 ) 2 ] Cl 2 + H 2 → Pd + 2NH 3 + 2HCl
Физикалық қасиеттері
Рутений (Ru) - күміс жылтыры бар, ақсұр түсті морт, соғуға, созуға көне бермейтін, қиын балқитын момноморфты құрылымдағы металл.
Рутенийдің табиғатта радиоактивті изотоптары ұшыраспайды, алайда ядролық реакторлар жұмыс істеу барысында плутонийдің ыдырауынан радиоактивті рутений пайда болады. Мысалы, 103 Ru және 106 Ru радиоактивті изотоптарының жартылай ыдырау мерзімі жазылу ретіне қарай 40 сөтке және 1, 01 жыл. Міне, осы радиоактивті рутенийді залалсыздандыру шешімін күткен үлкен мәселе.
Родий (Rh) - металдық күміс жылтыры бар, аздап көгілдір тартады, механикалық өңдеугге кәдімгі жағдайда көне бермейтін қатты металл.
Палладий (Pd) - сыртықы түрі жағынан күміске ұқсас, салқындату барысында қаттылығы 2-2, 5 есе артатын, жалпы жағдайда механикалық өңдеуге ыңғайлы металл. Периодтық кестеде s деңгейшесінде кәдімгі жағдайда электрон жайғаспайтын бірден-бір элемент.
Химиялық қасиеттері және қосылыстары
Кәдімгі жағдайда Ru, Rh, Pd ауада тотықпайтын, галогендермен әрекеттеспейтін, қышқыл-сілтіде ерімейтін бағалы асыл металлдар. Осы орайда, ең күшті тотықтырғыш фтордың өзі де, әлсіздік танытады.
Қыздыру барысында аталған металдар жоғарыда айтылған заттардың көпшілігімен әрекеттесіп, әртүрлі құрамдағы қосылыстар түзеді.
Ru, Rh, Pd - қыздыру барысында гологендермен қосылады:
2Ru + 3F 2 → 2RuF 3 (RuF 4 , RuF 5 , RuF 6 )
2Rh + 3F 2 → 2RhF 3 (RhF 4 , RhF 5 , RhF 6 )
2Pd + 3F 2 → 2PdF 3 (PdF 2 , PdF 4 )
Гексафторидтер, күшті тотықтырғыштар тез ыдырайды:
2RuF 6 + 10H 2 O → 2Ru(OH) 4 + 12HF + O 2
2RhF 6 + 10H 2 O → 2Rh(OH) 4 + 12HF + O 2
2RhF 6 + 3Cl 2 → 2RhF 3 + 6ClF
Осы элементтер хлормен Ru, Rh - моно, ди, три, және тетрахлоридтер түрінде қосылса, Pd -дихлорид қана түзеді:
2 Ru + Cl 2 → 2RuCl (RuCl 2 , RuCl 3 , RuCl 4 )
2 Rh + Cl 2 → 2RhCl (RhCl 2 , RhCl 3 , RhCl 4 )
Pd + Cl 2 →PdCl 2
Галогенидтер оңай гидролизге ұшырап гидроксидтертүзеді:
RuCl 2 + 2H 2 O → Ru(OH) 2 ↓ + 2HCl
RuCl 4 + 4H 2 O → Ru(OH) 4 ↓ + 4HCl
RhCl 3 + 3H 2 O → Rh(OH) 3 ↓ + 3HCl
сары түсті тұнба
PdCl 2 + 2H 2 O → Pd(OH) 2 ↓ + 2HCl
қара түсті тұнба
Гидроксидтердің бәрі де қышқылда ериді, қыздырғанда ыдырайды:
Ru(OH)
4
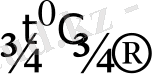 RuO
2
+ 2H
2
O
RuO
2
+ 2H
2
O
2Rh(OH)
3
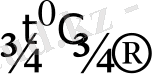 Rh
2
O
3
+ 3H
2
O
Rh
2
O
3
+ 3H
2
O
Pd(OH)
2
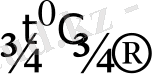 PdO + H
2
O
PdO + H
2
O
қара түсті
Келтірілген металл оксидтері жай заттарды жоғары температурада қыздыру барысында да түзіледі. Қыздыру барысында ұнтақ Ru, Rh, Pd оның кесек күйіне қарағанда оттекпен жеңілдеу тотығады. :
Ru + O
2
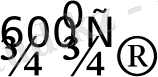 RuO
2
RuO
2
RuO 2 қара түсті ұнтақ, суда, қышқылда ерімейді:
Ru + 2 O
2
 RuO
4
RuO
4
RuO 4 -рутений (VIII) қоңыр қызғылт сары түсті сұйыққа 25 0 С-де айналады, буланып ұшуға бейім, озон иісті улы зат. Органикалық заттардың өте аз мөлшерімен (следовые количества) жанасса, қопарылыс береді . RuO 4 - қыздырғанда ыдырап қопарылыс береді:
RuO
4
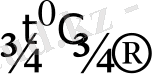 RuO
2
+ О
2
↑
RuO
2
+ О
2
↑
Қышқыл сілтілермен әрекеттеседі және реакция жүруіне қышқыл концентрациясы, температура көп әсер етеді. :
RuO 4 + 4HCl → RuO 2 + 2 Cl 2 + 2H 2 O
RuO 4 + 8HCl → RuCl 4 + 2Cl 2 + 4H 2 O
2RuO 4 + 4KOH → 2K 2 RuO 4 + O 2 + 2H 2 O
Родий 1000 0 С төңірегінде барып қана оксид түзеді:
4Rh + O
2
 2Rh
2
O
3
қарасұр ұнтақ
2Rh
2
O
3
қарасұр ұнтақ
Қатты қыздырғанда Rh 2 O 3 оттекті бөліп ыдырайды:
2 Rh
2
O
3
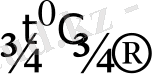 4RhO + O
2
4RhO + O
2
Ұнтақ палладий 500 0 С-ден жоғары температурада оттекпен әрекеттесіп оксид түзеді:
Pd + O
2
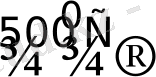 PdO
PdO
PdO - суда, қышқылда ерімейді, 800 0 С-де ыдырайды:
2PdO
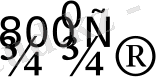 2Pd + O
2
2Pd + O
2
Rh, Pd -гидраттанған оксидтер түзеді.
Rh 2 O 3 ·5H 2 O - лимонсары түсті, суда ерімейді, қышқылда еріп, тұз түзеді:
Rh 2 O 3 · 5H 2 O + 6HCl →2 RhCl 3 + 8H 2 O
PdO 3 ·2H 2 O -қарақызыл түсті, сұйытылған қышқыл, концентрлі сілтілермен әрекеттеседі, 200 0 С-ден жоғары ыдырайды:
2 PdO 3 · 2H 2 O → 2 PdO + O 2 + 4H 2 O
Гидраттанған палладий (IV) оксидін мына реакция алуға болады:
K 2 [PdCl 6 ] + 4KOH → PdO 3 · 2H 2 O + 6KCl
Күкіртпен, селенмен, теллурмен жоғары температурада Ru, Rh, Pd - бинарлы қосылыстар береді:
Ru + 2S → RuS 2
Ru + 2Se →RuSe 2
Ru + 2Te →RuTe 2
Rh + S →RhS (RhS 2 , Rh 2 S 3 )
Rh + 3Se →RhSe 3
Rh + 3Te → RhTe 3
Pd + S → PdS (PdS 2 , Pd 4 S)
Pd + Se → PdSe (PdSe 2 , Pd 4 Se)
Pd + Te → PdTe (PdTe 2 , Pd 2 Te, Pd 3 Te, Pd 4 Te)
Ru, Rh, Pd - азотпен тікелей қосылыс түзбейді.
Ru, Rh, Pd - сутекті бойларына жақсы сіңіреді.
1 см 3 Ru - 1500 см 3 Н 2
1 см 3 Rh - 192 см 3 Н 2
1 см 3 Pd - 940 см 3 Н 2 кәдімгі жағдайда өз бойларында сіңіреді (сорбирует) .
Родийді мырышпен қосып балқытып, онан соң құйманы тұз қышқылымен өңдегенде жарылғыш родий алынады. Оның себебі родий бойына сіңірілген сутек және оттек газдары әрекеттесіп қопарылыс береді.
Кесек түрінде Ru, Rh-ға қышқылдар да, патша рағыда әсер етпейді. Ұнтақ родий патша арағында аздап ериді.
Палладий 300 0 С-де концентрлі HNO 3, H 2 SO 4 патша арағы бойында ериді:
Pd + 2H 2 SO 4 → PdSO 4 + SO 2 + H 2 O
Pd + 4HNO 3 → [Pd(NO 2 ) 2 (NO 3 ) 2 ] + 2H 2 O
3Pd + 18HCl + 4HNO 3 → 3H 2 [PdCl 6 ] + 4NO + 8H 2 O
Хлор қатысында тұз қышқылымен де палладий әрекеттесіп комплекс түзеді:
Pd + 2HCl + 2Cl 2 → H 2 [PdCl 6 ]
Рутений күшті тотықтырғыштар қатысында сілтілермен қосып балқытқанда, рутенаттарға көшеді:
Ru + 3KClO + 2NaOH → Na 2 RuO 4 + 3KCl + H 2 O
Ru + KClO 3 + KOH → K 2 RuO 4 + KCl + H 2 O
Ru + 2KOH + O 2 → K 2 RuO 4 + 2H 2 O
Ru + 3KNO 3 + 2KOH → K 2 RuO 4 + 3KNO 2 + H 2 O
Родий - қызып тұрған кезінде KHSO 4 балқымасымен әрекеттеседі:
2Rh + 12KHSO 4 → Rh 2 (SO 4 ) 3 + 3SO 2 + 6K 2 SO 4 + 6H 2 O
Сонымен қатар, ұнтақ родийді қатты қыздырып (температура красного каления) ас тұзының балқымасымен қосып хлорласа, суда ерімтал комплексті қосылыс түзеді:
Rh + 2Cl
2
+ 2NaCl
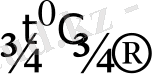 Na
2
[RhCl
6
]
Na
2
[RhCl
6
]
Рутений, родий карбонильді қосылыстар түзеді:
Ru + 5CO
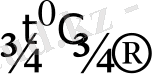 Ru(CO)
5
Ru(CO)
5
250 атм.
2Rh + 8CO → Rh 2 (CO) 8
Палладий карбонилдері бар болғанымен бұл қосылыстар оған онша тән емес.
Ru, Rh, Pd - d- металдарына жататындықтан бұларға комплексті қосылыстар тән және катионды, анионды, бейтарап түрлерінің бәрін түзеді.
Аталған элементтердің аммиакатты қосылыстары тұрақты болып келеді.
Анионды галогенді комплекстерінде палладий үшін комплекс тұрақтылығы артады:
Комплексті анион: [PdCl 4 ] 2- [PdBr 4 ] 2- [PdI 4 ] 2-
pK тұр-з 13 16 25
Pd(II) - фторлы комплекстері белгісіз
Тотығу дәрежесі +3 болатын октаэдрлі комплекстер Rh, Ru-ге тән.
[Rh (NH 3 ) 6 ] Cl 3 ; [Ru (NH 3 ) 6 ] Cl 3
Анионды цианидті, роданидті, хлоридті комплекстер Ru, Rh, Pd- тән, ал олардың органикалық лигандалары бар қосылыстары, кластерлері де жетерлік.
Жалпы аталған металдар +2, +3, +4 тотығу дәрежелеріне сәйкес комплексті қосылыстар түзуге бейім:
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz