Термохимия негіздері: термохимиялық теңдеулер, калориметриялық өлшеулер және энтальпиялық заңдар


Жоспар:
- Кіріспе
1. 1. Термохимия жайлы жалпы түсінік
- Негізгі бөлім
2. 1. Термохимиялық теңдеулер
2. 3. Термохимиялық өлшеулер
2. 4. Термохимияның негізгі мақсаты
- Қорытынды
- Пайдаланылған әдебиеттер
I. Кіріспе
Термохимия - химиялық динамиканың бөлімі, ол химмиялық реакциялардың жылу эффектісін және реакцияның жүру барысындағы элементтердің физико-химиялық параметрлеріне тәуелділігін қарастырады. Сонымен қатар термохимия мақсатына жылудың фазалық өтулер, ерулер, қосылу, тағы басқа процестер, жылу сыйымдылықты меңгеру және заттардың энтальпиясы мен энтропиясы кіреді. Термохимияның негізгі тәсілі - калориметрия болып табылады. Кей жағдайларда калориметриялық емес те тәсілдер (тепе-теңдік константасын өлшеу нәтижелерінен жылу эффектілерін санау) қолданылады, алайда бұл жағдайларда нәтижелер онша дәл болмайды.
Нтүзо фундаменталды термохимиялық анықтамаларда жиылған. ∆1840 жылы Гесс атты химик тамаша заң ашты, кейіннен осы заңға оның аты беріліп, бұл заң реакцияның жылу эффектісін, заттардың түзілу жылулығын немесе олардың жануын есептеуге мүмкіндік береді. Сонымен қатар тузілуі қиын, ал кейде мүлде мүмкін емес реакцияның жылу эффектісін табуға жол ашты.
Есептеуге қажетті стандартты жылу түзілулер ХІХ ғасылдың ортасында Томсон және Бертло ой тұжырымдады, олардың айтуы бойынша, энергиясыз болып жатқын химиялық реакциялар максималды жылу бөлінген жаққа ағады. Олармен және олардың шәкірттерімен термохимияның негізгі эксперименталдық тәсілдері жасалды және көптеген реакциялардың жылу эффектілері өлшенді. Жалпы алғанда Бертло-Томсеннің мәлімдемелері шындыққа сай болмады, бірақ термохимияда белгілі бір шартта химиялық реакциялардың ағу мүмкіндігін зерттеу маңызы сақталды. Сонымен, Н-ТS=-RTlnKp - термодинамиканың бірінші және екінші бастамасының жалпы теңдеуі болып табылып (Н - энтальпия өзгеруі, S - химиялық реакция кезіндегі энтропияның өзгеруі, Т - температура, R - газ тұрақтысы), кез-келген реакцияның тепе-теңдік константасын жылулық өлшемдер арқылы есептеуге мүмкіндік береді.
II. Негізгі бөлім
Термохимиялық теңдеулер . Химиялық реакциялар жүру барысында реакцияға түскен зат молекулаларындағы байланыстар үзіліп, реакция өнімдерінің молекулаларында жаңа байланыстар түзілу керек. Бұл үрдістер энергия өзгерістері арқылы жүзеге асады.
Энергия сақталу заңы бойынша кейбір реакциялар жылу бөле (экзотермиялық), ал кейбіреулері жылу сіңіре (эндотермиялық) жүреді, олар реакция теңдеулерінде көрсетілсе, мұндай теңдеулер термохимиялық теңдеулер деп аталады.
Термохимиялық реакция теңдеулерінде заттардың агрегаттық күйі жақша ішінде көрсетіледі және коэффициенттер бөлшек сандарда болуы мүмкін.
Күрделі заттың 1 молінің жай заттардан түзілуі кезінде бөлінетін не сіңірілетін жылуды заттардың түзілу жылуы деп атайды. Жану реакциясы кезінде 1 моль зат жанғанда бөлінетін жылу жану жылуы деп аталады.
Заттың түзілу жылуы оның агрегаттық күйіне байланысты екендігін мына мысалдан көруге болады:
Q түзілу (Н 2 О) сұйық = 286, 4 кДж / моль
Q түзілу (Н 2 О) газ = 241, 9 кДж / моль
2Н 2(газ) + О 2(г) = 2H 2 O сұйық + 572, 8 кДж
2Н 2(газ) + О 2(г) = 2H 2 O газ + 483, 8 кДж
Заттардың түзілу жылуының мәедері стандартты жағдайда анықтама кітаптарында беріледі. (Стандартты жағдай t = 25 0 C, p = 1aтм = 101, 3 кПа) .
Энергия сақталу заңына сәйкес заттың түзілу жылуы мен оның айырылу жылуының абсолюттік мәндері тең, ал таңбалары қарама қарсы болады, бұл тұжырым Лавуазье - Лаплас заңы деп аталады.
Термодинамиканың тағы бір заңы - Гесс заңы (1841 ж. ) .
Гесс заңы - реакцияның жылу эффектісі оның жүру жолына тәуелсіз, тек заттардың бастапқы және соңғы күйіне тәуелді.
С (қ) + 1 / 2 О 2(г) = СО (г) + Q 1
CO (г) + 1 / 2 О 2(г) = СО 2(г) + Q 1
С (қ) + 1 / 2 О 2(г) = СО 2 (г) + Q 1
Q 3 = Q 1 + Q 2
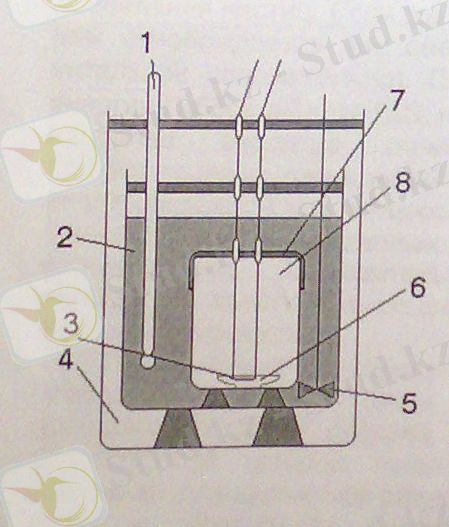
Термохимиялық өлшеулер . Ерітінділердің қасиеттері әр түрлі болғандықтан, олар термодинамикалық қасиеттеріне қарай жіктеледі. Бұл көзқарастан идеал және идеал емес ерітінділерді бөледі. Көпшілік физико-химиялық өлшеулер үшін процеске түсетін заттың жылусыйымдылығын, сонымен қатар еру процесінің жылу эффектілерін, фазалық ауысуын және химиялық реакцияларды білу қажет. Бөлме температурасына (20-50 0 С) жуық температура кезінде калориметриялық әдіс кеңінен пайдаланылады.
Калориметриялық әдіс кезінде жылу эффектінің Q белгісі мен мөлшерін калориметр температурасын ∆t өлшеу арқылы анықтайды:
Q=(∑m i c i ) ∆t=c ω ∆t
мұнда, m i - зерттелетін заттың массасы, калориметр және қосымша тетіктер (араластырғаш, ампула, термометр) ; c i - зеттелетін заттың меншікті жылу сыйымдылығы; c ω - калориметриялық жүйенің суммалық жылу сыйымдылығы.
1-теңдеу былай жазылуы мүмкін:
Q=(K+m 1 c 1 ) ∆t
мұнда, К - калориметр тұрақтысы, яғни жылуалмасуға қатысатын көмекші тетіктер мен калориметр бөлшектерінің жылу сыйымдылығы, Дж/К; с 1 - калориметр құрамының жылу сыйымдылығы; ∆t - калориметр мен қоршаған орта арасындағы жылу алмасу жоқ кездегі процесс температурасының өзгеруі.
Изотермиялық қабаты (диатермиялық) бар калориметр ортамен жылу алмасуын аңғартып, температура өзгеруін ∆t есептеуге мүмкіндік береді.
Жылу сыйымдылық С жүйесін dQ/dT шығарушысы деп атайды. Газ бен сұйықтық жылу сыйымдылықтары температураға тәуелді, ал қатты заттардікі орта және жоғары температураларға тәуелді емес.
Біртекті дененің орташа жылу сыйымдылығын келтірілген жылудың температура көтерілуіне қатынасын айтады:
<C>=Q / (T 2 -T 1 ) =Q-∆T
Орташа жылу сыйымдылық <C> температуралар интервалына (Т 2 -Т 1 ) тәуелді. Нағыз және орташа жылу сыйымдылық арасындағы тәуелділік мына теңдікпен беріледі:
<C>=∫CdT / (T 2 -T 1 )
∆T ≤ 5 0 болған жағдайда жетілдірілген калориметр (дәлдік есептеуі 0, 005%) көмегімен нағыз және орташа жылу сыйымдылығын айыра алмаймыз. Сондықтан, калориметриялық температураның өзгеруін 2-3 0 болған жағдайда, оны нағыз деп санайды және (Т 2 -Т 1 ) /2 температураға жатқызады. Біртекті дененің жылу сыйымдылығы оның массасына тәуелді
С=cm немесе <C>=<c>m
мұнда, <c> - заттың меншікті жылу сыйымдылығы, m - зат массасы. Егер масса молярлы немесе атом массасына тең болса, онда жылу сыйымдылық молярлы немесе атомдықпен сәйкестендіріледі. Егер тәжірибе кезінде калориметриялық жүйеде қысым тұрақты болса, онда тұрақты қысым кезінде процестің жылу эффектісі Q p , ал жылу сыйымдылық C p болады. Термохимиялық өзгеру кезінде жылу бөлумен жүретін процестерге оң таңба қойылады. Жүйелік жылу кезінде энтальпиясы жоғалады. Осыдан Q p =-∆H шығады. Егер есептеулерде жылу эффект Q немесе q болып белгіленсе, бұл жағдайда термохимиялық таңба жүйесін қолдану керек.
Термохимияның негізгі мақсаты. Термохимия - химиялық динамиканың бөлімі, ол химмиялық реакциялардың жылу эффектісін және реакцияның жүру барысындағы элементтердің физико-химиялық параметрлеріне тәуелділігін қарастырады. Сонымен қатар термохимия мақсатына жылудың фазалық өтулер, ерулер, қосылу, тағы басқа процестер, жылу сыйымдылықты меңгеру және заттардың энтальпиясы мен энтропиясы кіреді. Термохимияның негізгі тәсілі - калориметрия болып табылады. Кей жағдайларда калориметриялық емес те тәсілдер (тепе-теңдік константасын өлшеу нәтижелерінен жылу эффектілерін санау) қолданылады, алайда бұл жағдайларда нәтижелер онша дәл болмайды.
1840 жылы Гесс атты химик тамаша заң ашты, кейіннен осы заңға оның аты беріліп, бұл заң реакцияның жылу эффектісін, заттардың түзілу жылулығын немесе олардың жануын есептеуге мүмкіндік береді. Сонымен қатар тузілуі қиын, ал кейде мүлде мүмкін емес реакцияның жылу эффектісін табуға жол ашты. Есептеуге қажетті стандартты жылу түзілулер фундаменталды термохимиялық анықтамаларда жиылған.
ХІХ ғасылдың ортасында Томсон және Бертло ой тұжырымдады, олардың айтуы бойынша, энергиясыз болып жатқын химиялық реакциялар максималды жылу бөлінген жаққа ағады. Олармен және олардың шәкірттерімен термохимияның негізгі эксперименталдық тәсілдері жасалды және көптеген реакциялардың жылу эффектілері өлшенді.
 Жалпы алғанда Бертло-Томсеннің мәлімдемелері шындыққа сай болмады, бірақ термохимияда белгілі бір шартта химиялық реакциялардың ағу мүмкіндігін зерттеу маңызы сақталды. Сонымен, ∆Н-Т∆S=-RTlnK
p
- термодинамиканың бірінші және екінші бастамасының жалпы теңдеуі болып табылып (∆Н - энтальпия өзгеруі, ∆S - химиялық реакция кезіндегі энтропияның өзгеруі, Т - температура, R - газ тұрақтысы), кез-келген реакцияның тепе-теңдік константасын жылулық өлшемдер арқылы есептеуге мүмкіндік береді.
Жалпы алғанда Бертло-Томсеннің мәлімдемелері шындыққа сай болмады, бірақ термохимияда белгілі бір шартта химиялық реакциялардың ағу мүмкіндігін зерттеу маңызы сақталды. Сонымен, ∆Н-Т∆S=-RTlnK
p
- термодинамиканың бірінші және екінші бастамасының жалпы теңдеуі болып табылып (∆Н - энтальпия өзгеруі, ∆S - химиялық реакция кезіндегі энтропияның өзгеруі, Т - температура, R - газ тұрақтысы), кез-келген реакцияның тепе-теңдік константасын жылулық өлшемдер арқылы есептеуге мүмкіндік береді.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz