Цирконий мен гафний: изотоптары, физико-химиялық қасиеттері, қосылыстары және өндіру мен бөліну технологиясы


Жоспар:
- Табиғи тұрақты изотоптары
- Физикалық қасиеттер
- Химикалық қасиеттер
- Қолданылуы
Цирконий мен гафний
Цирконий ( Zіrconіum ), Zr - элементтердің периодтық жүйесінің ІV тобындағы хим. элемент, ат. н. 40, ат. м. 91, 22.
Табиғи тұрақты изотоптары
90Zr (51, 46), 91Zr (11, 23), 92Zr (17, 11), 94Zr (17, 40), 96Zr(2, 80) .

Цирконий Zr
Физикалық қасиеттері
Жасанды жолмен алынған радиоактивті изотоптары 93Zr, 95Zr радиоактивті индикатор ретінде пайдаланылады. Цирконийді 1788 жылы неміс ғалымы М. Клапрот циркон минералын талдау нәтижесінде ашқан. Жер қыртысындағы салмақ мөлш. 2°10-2%. Табиғатта негізінен циркон, бадделеит және күрделі цирконсиликат (эвдиалит, эвколит) минералдары түрінде кең таралған. Цирконий - күміс түсті ақ метал, балқу t 1852°C, қайнау t 3580 - 3700°C. Таза күйінде Цирконий пластик. және оңай өңделеді. Цирконийдің ең бағалы қасиеті - коррозияға, хим. агрессивті ортаға тұрақтылығы. Қосылыстарындағы тотығу дәрежесі +4. Галогендермен әрекеттесіп галогениттер (ZrГ4), фосформен қосып қыздырғанда дифосфид ZrР2, бормен 1500°С-тан жоғары темп-рада боридтер түзеді.
Химиялық қасиеттері
Цирконий қосылыстарының маңыздысы - қос тотығы ZrO2. өнеркәсіпте Цирконийді көбіне циркон және бадделеит минералдарынан алады. Металл Цирконийді өзінің қос тотығын кальций немесе кальций гидридімен, Цирконий хлоридін магниймен, фторцирконат калийді натриймен тотықсыздандыру арқылы алады.
Қолданылуы
Цирконий электрвакуумдық техникада, металлургияда, машина жасау өндірісінде, т. б. пайдаланылады. Цирконий қос тотығы және циркон отқа берік материалдар, шынының ерекше сорттарын дайындауда қолданылады.
Цирконий мен гафний периодтық жүйенің ІV тобына титанның топшасына кіреді.
Цирконий 1789 жылы М. Кларпорт (Германия) циркон деген минералды ашты. Цирон өте ертеде белгілі болды, оның аталуы әр түрлі - гиацинт, яцинт, яргон. Оның өте әдемі түсіне және мөлдірлігіне байланысты әр түрлі әшекей ретінде пайдаланылды.
1923 жылы гафнийді циркон (Скандивания) минералынан Д. Хевеши, Д. Костер (Дания) ашты. Гафний деп аталуы Копенгаген деген Скандиван қаласына байланысты (латынша "Наfnia") .
Д. И. Менделеев периодтық жүйені құрағанда гафний әлі ашылмаған, сондықтан перидтық жүйеде белгісіз элементке бос орын қалдырылған, оның реттік нөмірі 72 деп анықталған. Цирконда циркониймен қатар жүрген жаңа осы элемент (N72) деп табылған.
Цирконий мен гафнийдің электрондық құрылысы келесідей: Zr - 2, 8, 18, 10, 2; Hf - 2, 8, 18, 32, 10, 2. Осыған байланысты тұрақты валенттілік күйі - төрт. 1 кестеде цирконий мен гафнийдің ең маңызды физикалық константалары келтірілген.
1 кесте. Цирконий мен гафнийдің физикалық константалары
Реттік
номері
Тығыз-
дық
г/см 3
Атомдық
радиусы
Балқу
темпер. 0 С
Қайнау
Темп. 0 С
Балқу және қайнау температуралары металдардың тазалығына байланысты. Сыртқы түріне қарағанда металдар болатқа ұқсас, таза түрінде өте жұмсақ.
Цирконий мен гафний ядролық техникада маңызы олардың пайдаланылатын қасиеттері - жылы нейтрондар алу: цирконийдің нейтрондарды басып алуының көлденең қимасы өте аз - 0, 18 барн., ал гафнийдікі 120 барн.
Екі металдың бірнеше табиғаттық изотоптар бар (Zr-7, Hf-6) және бірнеше қолдан істелген изотоптар, кейбіріне «таңбаланған атомдар» (радиоактивті индикаторлар) ретінде пайдаланады.
Металдардың химиялық активтлігі жоғары болғандықтан оларды таза түрінде алу өте қиын. Кәдімгі температуралы ауада олар өзгермейді, бірақ қыздырғанда оттек және азотпен әрекеттесіп, оксидтер мен нитриттер түзеді. Металдар сутекті жұтып нитриттер түзеді: Zr 4 Н, Zr 2 Н. ZrН, ZrН 2 .
Қышқылдардың цирконий мен гафнийге әсері жоқ, тек қана патша және фтор қышқылында ериді. Бірақ кейбір әрекеттесулерде - цирконийдің жай күкірт және концентрлі тұз қышқылында еруі көрсетілген.
Цирконий коррзияға жоғары тұрақтылық крсетеді. Цирконий (гафний) сілтілердің ерітіндісімен әрекеттеспейді, ал балқыған сілтілермен әрекеттеседі.
Оттекпен қосылыстары
Цирконий мен гафнийді ауада қыздырғанда тотығып, оксидтер түзеді. Цирконийдің жоғары оксиді - ZrО 2 , балқу температурасы 2700°С. ZrО 2 үш кристаллды модификацияда болады, өзгеру нүктелері 1205°-1900°С, қайнау температурасы 4300°С. ZrО 2 табиғатта боc күйінде кездеседі (минерал бадделеит) .
Цирконийдің төменгі оксидтері Zr 2 О 3 және ZrО белгілі. Гафний - НfO 2 деген жоғары оксид түзеді, балқу температурасы 2990°С.
Цирконий мен гафнийдің оксидтері суда ерімейді. Оларға сәйкес гидраттарды екі жолмен алуға болады: кейбір тұздардың ерітінділерін гидролиздеу арқылы немесе тұздарға сілтілермен әсер ету арқылы. Бірінші жағдайда гидраттар түзіледі, олар матақышқылдарға сәйкес келеді, мысалы, ZrО(ОH) иемесс Н 2 ZrО 3 :
Zr(SО 4 ) 2 + ЗН 2 О → Zr(ОН) 2 ↓ + 2Н 2 SО 4 ;
екінші жағдайда - ортоқышқылдарға Zr(ОН) 4 немесе Н 4 ZrO 4
Zr(SО 4 ) 2 + 4NaОН → Zr(ОН) 4 + 2Nа 2 О 4 .
Гидроксидтер амфотерлі қасиеттер көрсетеді.
ZnO 2 және НfО 2 күшті қышқылдарды қосып (жай қосу керек, қыздыру) немесе сілтілермен балқытып ерітуге болады:
ZrO 2 + 2H 2 SO 4 → Zr(SО 4 ) 2 + 2Н 2 О
ZrO 2 + 2NaOH → Na 2 ZrO 3 + Н 2 О
Комплексті қосылыстар түзілетін болғандықтан, оксидтер фтор қышқылында жақсы ериді.
Цирконий мен гафнийдің тұздары
Цирконий мен гафнийдің оксидтерін сілтімен балқытқанда цирконий мен гафний қышқылдарының (Н 2 ZrO 3 , Н 2 Hf O 3 ) тұздары - цирконаттар мен гафнаттар (Ме 2 ZrO 3 , Ме 2 Hf O 3 ) түзіледі:
ZrO 2 + 2NaOH t → Na 2 ZrO 3 + H 2 O
HfO 2 + 2NaOH t → Na 2 HfO 3 + H 2 O
Цирконий мен гафнийдің оксидтері СаО, ВаО, SrО жоне МgО оксидтерімен әрекеттеседі, мысалы:
ZrO 2 + CaO → CaZrO 3
HfO 2 + CaO → CaHfO 3
Сирек жер элементтер оксидтерімен (лантан, самарий, неодим) әрекеттескенде цирконат түзіледі, құрамы Lа 2 Zr 2 О 7 .
ZrO 2 және НfО 2 кремний оксидімен балқығанда силикиттар түзеді.
ZrO 2 + SiO 2 → ZrSiO 4
HfO 2 + SiO 2 → HfSiO 4
Цирконий мен гафний силикаттары табигатта минерал түрінде кездеседі: ZrSіО 4 - циркон, HfSіО 4 - гафнон.
Циркон (ZrSіО 4 ) содамен немесе натрий гидроксидімен әрекеттескенде натрий цирконосиликаты түзіледі Nа 2 ZrSіО 5 немесе ZrSіО 4 ·Nа 2 О - ақ ұнтақты зат, суда ерімейді, минералды қышқылдарда жақсы ериді.
Цирконий мен гафнийдің оксидтері қышқылдарда ерігенде тұздар түзіледі:
ZrO 2 + 2H 2 SO 4 → Zr(SO 4 ) 2 2H 2 O
HfO 2 + 2H 2 SO 4 → Hf(SO 4 ) 2 2H 2 O
Тұздар ерітінділерде оңай гидролиздеңеді, сондықтан бір мезгілде цирконийдің әр түрлі иондары болуы мүмкін: Zr 4+ - цирконий-иондары, ZrО 21 - цирконил-иондары, сонымен қатар гидратты түрлері. Цирконий (IV) ерітіндіде полимер түрінде болуы мүмкін, полимерлену дәрежесі цирконийдің концентрациясы мен рН-на байланысты. Бұл байланыс 1 суретте керсетілген.
Осы байланыстан көретініміз: цирконийдің концентрациясы мен рН-ы жоғары болса - полимерлену дәрежесі де жоғарылайды. Комплекс түзуші реагенттерді қосқанда, мысалы, фтор қышқылын, полимерлер бұзылады.
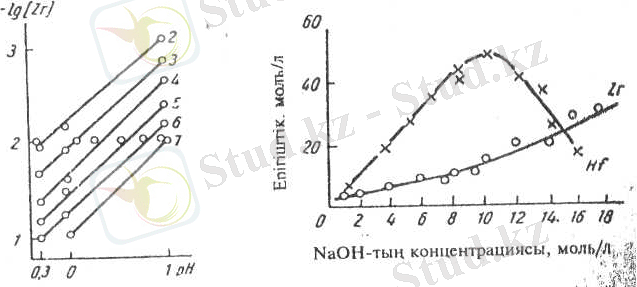
1 сурет - Цирконий иондарының полимерлену факторының концентрациясынан және ерітіндінің рН-нан тәуелділігі (сызықтар жанындағы сандар полимерлену факторына тең)
2 сурет - Цирконий мен гафний гидроксидінің натрий гидроксидінде ерігіштігі
Цирконий мен гафнийдің тұздарына аздап сілті қосса немесе гидролиздену реакциясын өткізсе, тұнбаға негізгі тұздар түседі, біртіндеп гидроксидтерге ауысады. Цирконий мен гафнийдің гидроксидтері натрий гидроксидтерінде ериді.
Бұл суреттен гафний гидроксидінің ерігіштігі цирконий гидроксидінен жоғарылау екенін байқауға болады. Натрий гидроксидінің максимумына жетіп (12моль/л) гафний ерігіштігі төмендейді. Осы жағдайда натрий гидроксогафнаты Nа 2 Нf(ОН) 6 түзіледі, бұл зат қатты фаза түрінде бөлінген.
Еріген комплексті қосылыстардың жалпы формуласы Ме(ОН) 4+n n- (Me - циркоий мен гафний), олардың тұрақсыз константалары келесідей: Zr(OH) 5 - 1, 9*10 -5 , Hf(OH) 5 - 1, 1*10 -5 .
Гироксидінің ерігіштік көбейтіндісі: Zr(OH) 4 - 3*10 -26 , Hf(OH) 4 -4*10 -26 .
Цирконий мен гафнийдің фосфаттары және ферроцианидтері
Цирконий мен гафний нашар еритін фосфаттар түзеді және Zr 3 (РО 4 ) 4 . Бұл фосфаттар қышқыддарда ерімейді, сондықтан цирконий мен гафнийді басқа металдардан бөлуге болады.
Цирконий мен гафний аз еритін ферроцианидтер түзеді. Ферроцианидтердің құрамы оның концентрациясына және цирконий тұздарының гидролизіне байланысты.
Цирконий оксихлоридіне натрий феррацианидін қосса, құрамы [ZrО(ОН) ] 4 [Ғе(СN) 6 ] қосылыс түзіледі, ал калий феррацианидін қосқанда ZrО[ZrO(ОН) ] 2 [Ғе(СN) 6 ] қосылыс түзіледі. Гидролиз болмағанда қышқылды ортада нормальды ферроцианид құрамы Zr[Ғе(СN) 6 ] -6Н 2 О түзіледі.
Пероксидті қосылыстары
Цирконий мен гафнийдің тұздарына сілтілі ортада пероксид сутекті қосқаңда, пероксидті қосылыстар түзіледі - надқышқылдар, оларды бос түрінде түссіз тұнба ретінде бөлуге болады. Надқышқылдар сутек пероксиді сияқты күшті тотықтырғыштар.
Галогендермен қосылыстары
Цирконий мен гафний қыздырғанда галогендермен әрекеттеседі.
Цирконий фториді ZrҒ 4 цирконий металын фторсутекпен қыздырғанда алынады. Әдетте ZrҒ 4 цирконий оксидіне фторид сутегін қосу арқылы немесе цирконий тұздарын ерітіндіден ZrҒ 4 ·nН 2 О түрінде алынады:
ZrO 2 + 4HF → ZrF 4 + 2H 2 O
Zr(SO 4 ) 2 + 4HF → ZrF 4
ZrF 4 - ақ түсті зат, 800-1000 0 С ұшады, суда қиын ериді (14л/л), фтор қышқылында комплексті қышқыл түзіп, жақсы ериді:
ZrF 4 + 2HF → H 2 [ZrF 6 ] + 2H 2 O
HfCl 4 комплексті қосылысты (NH 4 ) 2 HfF 6 термиялық диссоциялану арқылы алынады:
(NH 4 ) 2 HfF 6 → HfF 4 + 4NH 4 F
Цирконий мен гафнийдің хлоридтері металдардың хлормен қыздырғанда немесе металдардың оксидтерінің (көміртек қатысында) хлормен әрекеттесуі арқылы алынады.
ZrCl 4 - ақ түсті ұшқыш кристалды зат, су қосқанда толық гидролизденеді:
ZrCl 4 + 2H 2 O → Zr(OH) 4 + 4HCl
Сондай-ақ басқа галогендерді қыздырғанда менталдармен әрекеттеседі. Технологияда және aнaлитикалық химияда иодидтер пайдаланады.

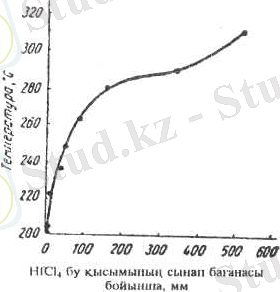
3 сурет - цирконий хлориді мен иодидінің булары қысымының температурадан тәуелділігі
ZrCl 4 - ақ түсті, ұшқыш кристаллды зат.
ZrІ 4 - сары түсті кристаллды зат, балқу температурасы 499°С (қысым жағдайында) . Қыздырғанда цирконий иодиді айдалады.
Цирконий мен гафнийді таза металл күйінде алу үшін иодидтер пайдаланылады. Металдар таза күйінде термиялық диссоциация әдісімен алынады:
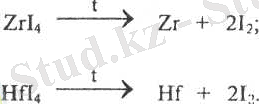
Комплексті фторидтердің және комплексті хлоридтердің тәжірибеде маңызы зор.
Олар "Комплексті қосылыстар" деген бөлімде қарастырылады.
Хлоридтер органикалық заттармен бірқатар күрделі Қосылыстар береді, мысалы, спирттермен, пиридинмен. Цирконий хлоридіне белгілі этил-, метил-, фенилбензоаттар, гафний хлоридіне - этил-, метилбензоаттар. Бұл заттар су қосқанда ыдырап, тетрахлорид және эфир береді, осы қасиетті пайдаланып, цирконий мен гафнийді басқа элементтерден бөлуге болады.
Цирконийге сонымен қатар белгілі оксихлорид, мысалы ZrOCl - цирконилхлорид, цирконий хлориді сумен әрекеттескенде түзіледі:
ZrС1 4 + Н 2 О → ZrОС1 2 + 2НСІ
ZrОС1 2 молекуласы 8 су молекуласымен кристалданады. Суда жақсы ериді, концентрлі тұз қышқылында қиын ериді. ZrОС1 2 -8Н 2 О 45-65 0 С температураға дейін қыздырғанда су бөлінеді, ал 80°С температурада ыдырап хлор бөлінеді, ал 400 - 450 0 С температурада ZrО 2 бөлінеді.
Егер белгілі рН-та оксихлорид ерітінділеріне сульфат иондарын қосса (натрий, алюминий, темір, аммоний сульфаттарының ерітіндісі) цирконийді негізгі сульфаттар түрінде тұнбаға түсіруге болады.
Цирконий мен гафнийдің дигалогенидтері алынған. Цирконий тетрахлоридін цирконий металы қатысында қыздырғанда қара түсті дихлорид түзіледі:
ZrС1 4 + Zr → 2ZrCl 2
Ал ZrС1 4 ауасыз ортада 350°С температурада алюминий металымен тотықсыздандырғанда қызыл-қоңыр түсті ZrС1 3 түзіледі, одан әрі қыздырса диспроспорциялану процесі өтіп ди- және тетрахлорид түзіледі:
2ZrС1 3 ↔︎ ZrС1 2 + ZrСІ 4
Дәл осындай реакциялар, цирконий мен гафиийдің бромидтермен және иодидтермен өтеді.
Комплексті қосылыстары
Цирконий мен гафний комплексті галогенидтер береді құрамы Ме 2 ZrГал 6 (Ме - бір валентті металл, Гал. - галоид) .
Комплексті галогенидтер тұрақты, ең маңыздысы, калий фторцирконаты К 2 ZrF 6 , технологияда және анализде пайдаланылады. Гафнийдің алюминий фторгафнаты (NH 4 ) 2 HfF 6 ерігіштігі жоғары болғандықтан оны цирконийден бөлу үшін пайдаланады. Келесі комплексті қосылыстар белгілі: Rb 2 Zr(Нf) Ғ 6 , Сs 2 Zr(Нf) Ғ 6 , Т1 2 Zr(Нf) Ғ 6 , АgZr(Нf) Ғ 6 .
Фторцирконаттар цирконийді алу үшін пайдаланылады, сондықтан толық зерттелген.
465°С температураға дейін қыздырғанда К 2 ZrҒ б ыдырап, КҒ және ZrҒ 4 бөлінеді:
КZrF 6 → 2KF + ZrҒ 4
600°С температурада ауада ZrО 2 түзіледі. Цирконий фториді комплексінің тұрақсыз константасы 10 -9 .
Сонымен қатар цирконий мен гафнийдің гексахлоридтері белгілі, сыртқы сфeрасында әр түрлі сілтілі металдар бар олар: натрий, калий, рубидий, цезий. Жоғары температурада ыдырау реакциясы өтеді:
Ме 2 ZrСІ 6 ↔︎ 2МeС1 + ZrСІ 4
Цирконий мен гафнийге комплексті сульфаттар белгілі, сонымен бірге цирконий комплексінің тұрақтылығы гафнийден жоғарылау. Күкірт қышқылды ортадан цирконий сульфаты түссіз цирконил күкірт қышқылы кристалл түрінде бөлінеді, гидролиз өткенде негізгі сульфаттар бөлінеді. Осы қосылыстарды комплексті қосылыстар деп қарастыруға болады, мысалы Н 4 [Zr(ОН) 2 (SО 4 ) 6 ] 4Н 2 О.
Цирконилкүкірт қышқылдың түзілуін және гидролиздену реакциясын пайдаланып тәжірибеде цирконийді ерітіндіден бөледі.
Күкірт қышқылының жоғары концентрациясында басқа зат түзіледі - цирконий үшсульфаты Н 2 [Zr(SО 4 ) 3 ] · 3Н 2 О.
Цирконий нитраты бірнеше комплексті қосылыстар береді, олар әр түрлі азот қышқылдық ортада түзіледі: азот қышқылының нормальдық концентрациясы 0, 3 төмен болса, онда цирконий гидроксиді тузіледі - Zr(ОН) 4 , қышқылдың концетрациясы жоғарыласа жоғары полимерлі молекулалар түзіліп [Zr 2 О 3 ] 2+ иондар пайда болады, соңғысында келесідей комплексті иондар түзіледі: [Zr(ОН) 2 NО 3 ] + , [Zr(ОН) 2 (NО 3 ) 2 ] °, Zr(NО 3 ) 2 ] 2+ , [Zr(ОН) 2 (NО 3 ) 4 ] 2- .
Цирконий мен гафний қымыздық қышкылмен комплексті қосылыстар береді, оның формуласы [Мо(С 2 O 4 ) 4 ] 4- (Ме - цирконий немесе гафний) . Бұл комплекс тұз кышқылды ерітіндіде металмен оксалат ионның қатысымен Ме:С 2 О 4 2- 1:25-тен 1:100-ге дейін болғанда түзіледі. Ал оксалаттың концентрациясы жоғары болғанда (рН мәні 5, 8-ден 6, 2-ге дейін) келесі комплекс түзіледі - [Ме(С 2 О 4 ) 5 ] 6- . Комплекстің тұрақты константасы 10 36 . Басқа жұмыста көрсетілген тағы үш тұрақты оксалат комплекстің түзілуі, тұрақсыз константалары есептелген:
ZrC 2 O 4 2+ ; (K = 1, 6·10 -10 ) ; Zr(C 2 O 4 ) 2 (K = 4, 6·10 -8 ) ; ZrO C 2 O 4 (K = 2, 1·10 -7 )
Цирконий мен гафнийдің басқа көп органикалық реагенттермен комплексті қосылыстарын технологияда және анализде пайдаланады. Мысалы цирконий лимон қышқылымен калий гидроксиді қатысында калий цитратоцирконилоат түзеді, құрамы К 3 [ZrO(С 6 Н 5 О 7 ) 2Н] ·8, 5Н 2 О, спирт қосқанда тұнбаға түседі.
Бормен, көміртекпен, кремниймен, азотпен және фосформен қосылыстары
2 кестеде цирконий мен гафнийдің қосылыстарының құрамы және маңызды физикалық қасиеттері келтірілген.
Осы ксстеден цирконий мен гафний барлық қосылыстарында жоғары балқу температураға және жоғары электрөткізгіштік қасиетіне ие екені байқалады. Келтірілген барлық қосылыстар хлордың атмосферасында ыдырайды, себебі хлоридтер түзіледі.
Боридтер келесі реакция бойынша қыздырғанда алынады:
7Zr + 3В 4 С + В 2 О 3 → 7ZrB 2 + 3CO
Нитриттер металдар азотпен немесе аммиакпен әрекеттескенде алынады. Силициттерді әр түрлі жолмен алады:
2 кесте. Цирконий мен гафний боридтерінің, карбидтерінің, силициттерінің, нитриттерінің және қасиеттері
- Элементтердің тура вакуум пеште әрекеттесуі;
- 2С температурада цирконий мен гафнийдің кремниймен әрекеттесуі, сосын 1500-18000С температурада сутек атмосферада жандыру;
- Алюминотермиялық тотықсыздандыру;
- Сілтілі металдың фторсиликатының балқымасы электролиздеу.
Цирконий мен гафнийдің карбидтері оксидтерді көміртек пен сутек немесе көміртек оксидімен 2000°С температурада пеште күйдіру арқылы алынады. Бұл тотықсыздану процесін жалпы келесі реакция арқылы көрсетуге болады:
ZrO 2 + ЗС → ZrС + 2СО
Сонымен қатар цирконий фосфидтері: α-, β-монофосфидтері ZrР және дифосфиді ZrР 2 белгілі, олар элементтерден синтeз арқылы қыздырғанда (қысым) немесе 750°С температурада ZrCl 4 + РН 3 қоспаны қыздырып, одан әрі 850°С температурада фосфинді металмен әрекеттескенде алады. Осыған ұқсас гафний фосфиді белгілі.
Күкіртпен қосылыстары
Сульфидтер, құрамы МеS 2 элеметтерді қыздырғанда бір-бірімен әрекеттесіп немесе 600 0 С температурада күкіртсутек хлоридімен әрекеттесу арқылы алынады. Цирконий мен гафний тұздардың ерітінділеріне күкіртсутек қосқанда тұнба түзілмейді.
ZrS 2 - қара-қоңыр ұнтақ, ауада тұрақты, суда ерімейді, қыздырғанда оксид түзіледі.
Электрохимиялық сипаттамасы
Сулы ерітінділерде цирконий мен гафний тек қана төрт валентті күйде болады. Төменгі валенітік күй тек қана галогенидтерге және оксидке ZrO тән. Сондықтан ерітіндіде тотығу-тотықсыздану реакциялар өтпейді.
Келесі реакцияның Ме 4+ → Ме нормальдық потенциалдың шамасы цирконийге - 1, 56 В, гафнийге - 1, 7 В. Цирконий мен гафнийдің қосылыстардың металға дейін тотықсыздануы тек қана фторид немесе хлорид комплексті қосылыстардың балқымасында өтуі мүмкін.
Минералдары мен кендері
Цирконий ванадий сияқты кең тараған сирек элементтерге жатады. Жер қыртысында таралуы бойынша цирконий 19-шы орын алады, IV декадаға жатады. Цирконийдің кларкі 0, 025, гафнийдің кларкі 4-10 -6 (VI декада) . Цирконийдің ең маңызды минералдары келесілер:
Бадделеит (немесе бразилит) ZrО 2 , бай кені Бразилиада кездеседі.
Циркон ZrSіО 4 (арабша "zerk" - асыл тас) . Цирконның әр түсті түрлері гиацинт деп аталады. Минералдың ірі кені Австралияда, Индияда, Норвегияда, Мадагаскарда, Цейлонда кездеседі. Кейбір циркондарда басқа сирек элементтер кездеседі: олардың ішінде - сирек жер элементтер, ниобий, тантал, торий, уран.
Эвдиалит - күрделі минерал, оның құрамы мына формуламен көрсетілген: (Na, Са) ZrSі 6 О 17 (О, ОН, С1) . Минералдың түсі әр түрлі: қызғылт немесе қызыл-сұр. Минералда тантал, ниобий, сирек жер элементтер (церий, лантан, празеодим), иттрий, гафний кездеседі. Минерал кені Гренландияда, Норвегияда, Мадагаскарда кездеседі.
Гафний табиғатта өз минералдары түрінде сиректеу кездеседі, цирконийдің тұрақты серігі. Гафнийдің ең жоғары мөлшері цирконда.
Технологиясы. Концентраттарды ыдырату
Цирконий ядролық техникада пайдаланылатын болғандықтан, оны таза түрінде бөлу керек (гафний болмауы керек) . Циркон концентраттарын ыдыратқанда үш әдіс пайдаланылады:
- Карбид әдісі, осы әдіспен сусыз хлоридтер алынады, гафний экстракция арқылы бөлінеді.
- Калий кремний фторидімен балқыту, сосын цирконий мен гафнийдің комплексті фторидтерінің фракциялық кристаллизациясы.
- Натрий гидроксидімен балқыту, азот қышқылындаеріту, гафнийді экстракция арқылы бөлу.
Бадделеитті басқаша өндейді.
Концентратты күйдіреді, сосын суда суытады, оның нәтижесінде минерал ұнтақ түрінде болады, алюминий және темірдің қоспаларын қышқылмен бөледі. Таза оксид керек болса бадделеитті күкірт қышқылымен қыздырып ыдыратады, ерітіндіден натрий гидроксидін қосып, цирконийдің гидроксидін тұнбаға түсіреді.
Кендердің құрамында титан болса, оны цирконийден бөлу үшін қос фторидтердің ерігіштіктерінің айырмашылығын пайдаланады: К 2 ZrҒ 6 -ның ерігіштігі (14г/л) титан фторидінің (К 2 ТіҒ 6 ) ерігіштігінен жоғары.
Цирконий мен гафнийді бөлу
Цирконий мен гафнийдің қасиеттері өте жақын болғандықтан, оларды бір-бірінен бөлу өте күрделі мәселе.
Цирконий мен гафнийді келесі әдістермен бөлуге болады:
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz