Қаныққан көмірсутектердің галоген туындылары: изомерия, номенклатура, алынуы және қасиеттері


Жоспар:
- КіріспеҚаныққан көмірсутектердің моногалогенді туындылары. Изомериясы, номенклатурасы.
- Негізгі бөлімГалогеналкан, алынуы. Галогеналкандардың физикалық және химиялық қасиеттеріҚаныққан көмірсутектердің ди- және полигалогенді туындылары
- қолданылуы
- Пайдаланылған әдебиеттер
- Кіріспе. Қаныққан көмірсутектердің моногалогенді туындылары. Изомериясы, номенклатурасы.
Галоген туындыларын көмірсутектердегі бір немесе бірнеше сутек атомдарының орнын галоген атомдарының басуынан шыққан өнімдер деп қарастыруға болады.
Қаныққан көмірсутектердің моногалогенді туындылары галоген алкилдер деп аталады. Олардың жалпы формуласы С n H 2n+1 Hlg. Галоген атомының орналасуына, галоген атомымен байланысқан көміртек атомының түр айырмашылығына байланысты галоген туындылары біріншілік (1), екіншілік (ІІ) және үшіншілік (ІІІ) болып бөлінеді: R - CH 2 - Cl (I), R 2 CH - Cl (II) және R 3 C - Cl (III) .
Галоген туындыларының изомериясы көміртек скелетінің құрылысына және тізбектегі галоген атомның орнына байланысты. Сондықтан, қаныққан көмірсутектерінен гөрі галоген туындыларының изомерлер саны көбірек болады. Изомерия қатардың үшінші мүшесінен басталады. Галоген туындылардың аттары систематикалық номенклатура бойынша, оларға сәйкес қаныққан көмірсутектердің аттарына галогендердің атын қосу арқылы құрайды, галоген атомының тізбектегі орны цифрмен көрсетіледі. Галоген туындылардың ең қарапайым мүшелерін олардың құрамына кіретін радикалдар бойынша атайды:
СН 3 - Сl хлорметан, хлорлы метил
СН 3 - CH 2 Сl хлорэтан, хлорлы этан
СН 3 - CH 2 - CH 2 Сl 1-хлорпропан, хлорлы пропил
СН 3 - CHСl - CH 3 2-хлорпропан, хлорлы изопропил, немесе
хлорлы екіншілік пропил
СН 3 - CH 2 - CH 2 - CH 2 - Сl 1-хлорбутан, хлорлы бутил
СН 3 - CHСl - CH 2 - CH 3 2-хлорбутан, хлорлы екіншілік бутил
СН 3 - CH(CH 3 ) - CH 2 Сl 1-хлор-2-метилпропан, хлорлы изобутил
СН 3 - CСl - CH 3 2-хлор-2-метилпропан, хлорлы үшіншілік
бутил
CH 3
II. Негізгі бөлім
- Галогеналкан, алынуы.
Алкандарды жарық сәулесі қатысында галогендеу (радикалды орын басу реакциясы S R ) галогенді қосылыстарды береді.
СН 4 + Cl 2
СН 3 Cl + HCl
СН 3 Cl + Cl 2
СН 2 Cl 2 + HCl
СН 2 Cl 2 + Cl 2
СНCl 3 + HCl
СНCl 3 + Cl 2
СCl 4 + HCl
С 2 H 6 + Br 2
СН 3 - CH 2 Br + HBr
Алкандармен фтор қопарылыс бере әрекеттеседі, ал иод әрекеттеспейді!
Тұйық сақиналы көмірсутектер түрліше әрекеттеседі:
Cl
+ Cl 2 → + HCl
Циклопропан, циклобутанды галогендеу барысында сақина жазыңқы тізбекке көшеді!
Алкендерге галогендердің, галогенсутектердің қосылуы:
СН 3 - СН = СН 2 + Сl 2 → CH 3 - CHCl - CH 2 Cl
СН 3 - СН = СН 2 + HСl → CH 3 - CHCl - CH 3
Есіңізге Марковников ережесін және Хараш әсерін түсіріңіз.
Алкендерге НСl, Нl тек қана Марковников ережесіне сәйкес қосылады.
Мысалы:
НІ
І
СН 3 СН 3
Н
Н
Н НІ
Пероксид
СН 3 СН 3
СН
3
- С = СН
2
 СН
3
- СН - СН
2
- Вr
СН
3
- СН - СН
2
- Вr
пероксид
СН 3 СН 3 СН 3 СН 3
СН
3
- С = С - СН
3
 СН
3
- С - СН - СН
3
СН
3
- С - СН - СН
3
СН 3
Сl СН 2 - СН 3 І СН 2 - СН 3
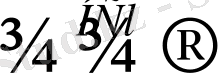
;
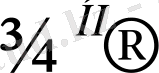
пероксид
Осы орайда органикалық қосылыстардың реакцияға бейімділігі бөлігіндегі статикалық және динамикалық электрондық әсерлер нәтижесінде туындайтын карбкатиондардың тұрақтылығы да реакция бағытын айқындайтынына зер салыңыз.
Галогеналкандарды спирттермен галогенсутектерді әрекеттестіру нәтижесінде алады. Галоген сутектердің реакцияға бейімділігі төмендегідей ретте кемиді:
НІ > НВr > HСl
Хлорлысутек біріншілік және екіншілік спирттермен тек катализатор қатысында (ZnCl 2 ) ғана әрекеттеседі:
ОН
 Вr + Н
2
О
Вr + Н
2
О
СН
3
- ОН
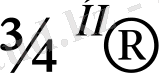 СН
3
І + Н
2
О
СН
3
І + Н
2
О
СН 3 СН 3
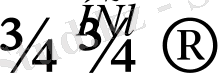
ZnCl 2
ОН Cl
CН
3
- СН
2
- ОН
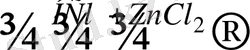 CН
3
- СН
2
- Cl
CН
3
- СН
2
- Cl
(лакмус реактиві)
R - OH
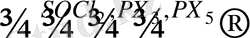 R - X
R - X
CН
3
- СН
2
- ОН
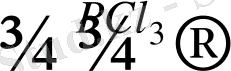 CН
3
- СН
2
- Cl
CН
3
- СН
2
- Cl
Көпатомды спирттерге, кетондарға, альдегидтерге пентахлорлы фосформен әсер ету арқылы дигалогенидтер алынады:
СН 2 ОН - СН 2 ОН + 2РСl 5 → ClCH 2 - CH 2 Cl + 2HCl + 2POCl 3
СН 3 - CO - СН 3 + РСl 5 → CH 3 - CCl 2 - CH 3 + POCl 3
O
CH 3 - C + PCl → CH 3 - CHCl 2 + POCl 3
H
Фторлы туындылар альдегид, кетон, қышқылдарға тетрафторлы күкірт қосу арқылы алынады:
R R
C = O + SF 4 → CF 2 + SOF 2
R R
RCOOH
 RCOF
RCOF
 RCF
3
RCF
3
-SOF 3
Сонымен қатар металл фторидтерімен көмірсутекті әрекеттестіреді:
2CoF 3 + RH → RF + 2CoF 2 + HF
Сусыз фторлы сутектің электролизі арқылы органикалық заттарды фторлау да қолданылады.
Иодтың алкандармен тікелей әрекеттеспейтіндігі мәлім. Иодты алкандарды алу үшін көп жағдайда алкандардың хлорлы не бромды туындыларына, иодты натрийдің ацетондағы ерітіндісімен әсер етеді:
СН
3
Сl + Nal
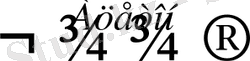 СН
3
I + NaCl↓
СН
3
I + NaCl↓
Ацетонда Nal жақсы ерімтал, ал NaСl ерігіштігі нашар болғандықтан, тұнбаға түседі.
Иодты алкандарды спирттерге не алкендерге иодты сутек қосу арқылы алатындығымен жоғарыда таныстық.
- Галогеналкандардың физикалық және химиялық қасиеттері.
Галоген туындыларының физикалық қасиеттері галоген атомдарының табиғатына, көмірсутек радикалының құрамына және құрылысына байланысты болады.
Қалыпты жағдайда фторлы метил, этил, пропил және бутил, хлорлы метил және этил, бромды метил газдар болып табылады. Қалған галоген алкилдер - сұйықтықтар, жоғары өкілдері - қатты заттар.
Көміртек қаңқасы бірдей галогеналкилдердің қайнау температурасы фтролы алкилдерден иодты алкилдерге қарай өсіп отырады; көміртек атомдарының мөлшері бірдей туындылардың ішінде үшіншілік галогеналкилдердің қайнау температурасы төменірек келеді.
Галогеналкилдердің тығыздығы фторлы алкилдерден иодты алкилдерге қарай өсіп отырады.
Галогеналкилдердің бірінші мүшелерінің тәтті наркотик иісі болады. Олар іс жүсінде суда ерімейді, бірақ органикалық еріткіштерде жақсы ериді және өздері еріткіш болып табылады. Галогеналкилдер едәуір полюсті келеді.
Галогеналкандар бойындағы галоген топшасы реакцияға өте бейім және өзгеріс байыбын төмендегіше сипаттауға болады:
- С - Х + Z → - С - Z + X
δ + δ -
Өзгеріс байыбынан көріп отырғанымыздай, нуклеофильді бөлшек көміртекке шабуыл жасайды. Әртүрлі нуклеофильдердің галогеналкандармен орын басу реакциясына түсу бейімділігін салыстырмалы түрде төменде келтірілген кестеден көруге болады.
Келтірілген жылдамдық мәні шартты, өйткені галогеналкан құрамы мен құрылымына қарай топшалар арасындағы байланыс өзгеріп тұрады.
Кестеде келтірілген реакция түрлері нукллеофильді орын басу -S N түріне жатады.
Кестеде келтірілген өзгерістердің бәрін де жеке-жеке реакция түрінде келтіруге болады:
СН 3 Br + NaSH → CH 3 SH + NaBr
CH 3 CH 2 Br + NaCN → CH 3 CH 2 CN + NaBr
CH
3
Cl + NaI
 CH
3
I + NaCl
CH
3
I + NaCl
Вильямсон тәсілімен жай эфирлерді синтездеу. Мұнда тек біріншілік алкилгалогенидтер пайдаланылады, ал спирт біріншілік, екіншілік, үшіншілік бола беруі мүмкін:
СН 3 СН 3
СН 3 - СН 2 - СН 2 - І + СН 3 - С - О - Na + → CH 2
СН 3 СН 2
СН 3 O
СН 3 - C - OH Na СН 3 - C - СН 3
СН 3 СН 3
Галогеналкандар аммиакпен аминдер түзе әрекеттеседі. Түзілген аминдер өзге галогеналкандармен жаңа аминдер береді. Барлық жағдайда аминотопша нуклеофильдік қасиет көрсетеді:
а)
І + NH
3
→ NH
3
+
I
-
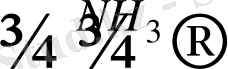 NH
2
+ NH
4
+
I
-
NH
2
+ NH
4
+
I
-
амин
ә) Сl - H
CH
3
- CH
2
- Cl + H
2
N - CH
3
→ CH
3
- CH
2
- N
+
- CH
3
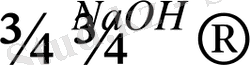
H
→ CH 3 - CH 2 - NH - CH 3 + NaCl + H 2 O
Сұйытылған сілті ерітіндісімен галогеналкандар әрекеттесіп, спирттер түзеді. Үшіншілік көміртек атомындағы галогендер әлсіз нуклеофильдік қасиет көрсететін сумен әрекеттесіп спирт және қышқыл түзеді:
С 2 Н 5 Сl + NaOH → C 2 H 5 OH + NaCl
CH 3 CH 3 CH 3
+
CH 3 - C - Br + H 2 O → CH 3 - C - OH + Br - → CH 3 - C - OH + HBr
CH 3 CH 3 H CH 3
спирт
Біріншілік галогеналканмен сілті ерітіндісінің әрекеттесуін S N 2 деп белгілейді, өйткені реакция биомолекулалы (реакция жылдамдығы сілті және галогеналканы концентрациясына тәуелді) .
Үшіншілік галогеналкандармен сілті ерітіндісінің әрекеттесуінен S N 1 деп белгілейді, өйткені реакция мономолекулалы, яғни жылдамдығы тек үшіншілік галогеналканның концентрациясына ғана тәуелді.
Галогеналкандардан галогенсутектердің бөлінуі () .
Галогеналкандар бойынан галогенсутектердің бөлінуін жалпы жағдай үшін төмендегідей түрде бейнелейді:
Н
- С - С -> С = С < + Н++ Х-
Х
Келтірілген реакция түрін жүзеге асыру үшін күшті негіздерді пайдалана беруге болады. Жалпы, калий гидроксидінің спирттегі ерітіндісінде өзгеріс жақсы жүреді:
а)
І + КОН
 + КІ + Н
2
О
+ КІ + Н
2
О
б) СН
3
- СН - СН
2
+ КОН
 СН
3
- СН = СН
2
+ KBr + H
2
O
СН
3
- СН = СН
2
+ KBr + H
2
O
Br H
в) СН
3
- СН - СН - СН
2
+ КОН
Н Вr H
→ СН 3 - СН = СН - СН 3 + СН 3 - СН 2 - СН = СН 2 + KBr + H 2 O
Өзгерістің «в» жағдайында алкеннің изомерлері түзіледі. Реакция нәтижесінде қандай алкен басым түзілетіндігіне көз жеткізу үшін мына төмендегі берілген қосылыстың құрылымына назар аударыңыз:
СН 3 - С = С - СН 2 - СН 3 а)
СН 3 СН 3
H Br H
СН 3 - СH - С - СН 2 - СН 3 б)
СН
3
- C - C - CH - СН
3

спирт СН 3 СН 3
Н - СН 2
СН 3 СН 3 - СH 2 - С = С - СН 3 в)
СН 3 СН 3
1. Галогенмен бірге бөлінетін сутек атомдарының мүмкін болатын жағдайларын сызықпен қоршай отырып, түзілетін өнім түрлерін жазалық
2. Қос байланыстағы көміртек атомдарын төмендегідей түрде сызықтармен қоршап қоялық:
а) С - С = С - С - С б) C - C - C - C - C в) С - С - С = С - С
С С С С С С
3. Қос байланыстағы көміртектермен байланысып тұрған алкил топшаларының көміртектерін төмендегідей түрде сызықпен қоршалық:
а) С - С = С - С - С б) C - C - C - C - C в) С - С - С = С - С
С С С С С С
Байқадыңыз ба? «а» жағдайында төрт алкил топшалары «б» жағдайында екі және «в» жағдайында үш алкил топшалары бар. Алкил топшалары көп қос байланысты құрылым негізгі өнім болып табылады.
Қарастырылып отырған галогенсутектің бөліну раекциясының байыбы Е2 - деп қабылданады, яғни бимолекулалы ыдырау реакциясы. Мұнда, гидроксо топшаның сутек атомына шабуылы мен электрондар ығысуы бір мезетте орын алады, яғни:
Н
НО + - С - С - → Н - О - Н + >С = С < + Х
Х
Галогеналкандар диэтил эфирінің бойында магниймен әрекеттесіп, магнийорганикалық қосылыстар түзеді:
СН
3
Br + Mg
 CH
3
MgBr
CH
3
MgBr
Полигалогенидтер химиялық қасиеті жөнінен ұқсас.
R - CHCl + CH 2 Cl + HOH → RCHOH - CH 2 OH +2HCl
O
СН 3 - CHCl + HOH → СН 3 - C + 2HCl
H
СН 3 - CCl 2 - СН 3 + HOH → СН 3 - CO - СН 3 + 2HCl
СН 3 - CCl 3 + 2HOH → СН 3 COOH + 3HCl
CCl
4
+ 2HF
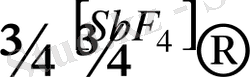 СF
2
Cl
2
+ 2HCl
СF
2
Cl
2
+ 2HCl
фреон-12
- Қаныққан көмірсутектердің ди- және полигалогенді туындылары
Ди- және полигалогенді туындыларында бірдей немесе әр түрлі галоген атомдары, бір немесе әр түрлі көміртек атомдарында болуы мүмкін.
Изомерия. Номенклатура. Галоген атомдары бір көміртек атомында орналасқан галоген туындыларды - геминальді, ал қатар көміртек атомдарында орналасқандарын вицинальді деп атайды. Төменде полигалоген туындыларының аттарына мысал келтірілген:
СН 3 Cl 2 дихлорметан, хлорлы метилен
CHCl 3 трихлорметан, хлороформ
ССl 4 тетрахлорметан, тетрахлорлы көміртек
CH 3 - CHCl 2 1, 1-дихлорэтан, хлорлы этилиден
CH 2 Cl - CH 2 Cl 1, 2-дихлорэтан, хлорлы этилен
CHCl 2 - CH 2 Cl 1, 1, 2-трихлорэтан
CCl 3 - CH 3 1, 1, 1-трихлорэтан
CCl 3 - CH 2 Cl 1, 1, 1, 2-тетрахлорэтан
CHCl 2 - CHCl 2 1, 1, 2, 2-тетрахлорэтан
CCl 3 - CHCl 2 1, 1, 1, 2, 2-пентахлорэтан
CCl 3 - CCl 3 гексахлорэтан
Алу тәсілдері. Полигалогенді туындыларды әдетте көміртек сутектерінен немесе құрамында оттек бар қосылыстардан алады.
1. Ди- және полихлоридтерді қаныққан көмірсутектерін хлорлап алған өнімінен бөліп шығаруға болады.
2. Геминальді дигалоген туындылар альдегидтер мен кетондарға бес хлорлы фосформен әрекеттестіру арқылы пайда болады. Мысалы:
О
СН 3 - С + PCl 5 → CH 3 - CHCl 2 + POCl 3
H
сірке альдегиді
3. Винилальді дигалоген туындыларын қанықпаған көмірсутектерге галогендерді қосып алуға болады.
СН 3 - СН = СН 2 + Br 2 → СН 3 -CHBr - CH 2 Br
1. 2-дибромпропан
4. Әр түрлі көміртек атомдарындағы ди- дәне полигалогенді туындылары галоген атомдарымен галогенді сутектермен, фосфор галогенидтерімен, хлорлы тионилдің гликольдермен немесе басқа көп атомды спирттермен әрекеттестіргенде құралады.
3СН 2 ОН - СН 2 - СН 2 - CH 2 OH + 2PBr 3 →
1, 4- бутандиол
→ 3СН 2 Br - CH 2 - СН 2 - СН 2 Br + 2P(OH) 3
1. 4 - дибромбутан
Физикалық қасиеттері. Ди- және полигалоген туындылары - ауыр майлар немесе кристалды заттар. Суда ерімейді.
Химиялық қасиеттері. Ди- және полигалоген туындылары галогеналкилдер сияқты нуклеофильді орын басу реакцияларына қатысады (сумен, аммиакпен т. б. ) .
Егер галоген атомдары әр түрлі көміртек атомдарында орналасса, гидролиздеу арқылы екі атомды спирттер алынады (гликлоьдер) . Мысалы:
СН 2 Cl - CH 2 Cl + 2HOH → СН 2 OH - CH 2 OH + 2HCl
Егер галоген атомдары бір көміртек атомында орналасса (геминальді қосылыстар), гидролиздеу арқылы альдегидтер, кетондар немесе қышқылдар алынады.
Мысалы,
OH
СН 3 - CHCl 2 + 2HOH→ CH 3 - CH + 2HCl →
OH
→ СН 3 - CH = O + 2HCl + H 2 O
СН 3 - CCl 2 - СН 3 + 2HOH → [СН 3 - C(OH) 2 - СН 3 ] + 2HCl →
→ СН 3 - CO - СН 3 + 2HCl + H 2 O
OH
СН 3 - CCl 3 + 3HOH→ CH 3 - C - OH + 3HCl →
OH
OH
→ CH 3 - C + 3HCl + H 2 O
O
Жеке мүшелері. Метан мен этанның хлорланған өнімдері сондай-ақ фторхлоридтердің техникада маңызы зор.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz