Бериллий (Be): физикалық және химиялық қасиеттері, қосылыстары, алынуы және қолданылуы


Жоспар:
- КіріспеСирек элементтерБериллий (Be) . Тарихи мағлұматтар
- Негізгі бөлімБериллийдің физикалық және химиялық қасиеттеріҚосылыстары, технологиясыАлынуы. Аналитикалық сипаттамасы
- ҚорытындыҚолданылуы
- Пайдаланылған әдебиеттер
Бериллий (Be)
Кіріспе
Жоғарыда қарастырылған сирек элементтердің ешқайсысы табиғатта күрделі силикат немесе алюмосиликат түрінде кездеспейді. Осы металдармен түзілетін көптеген минералдардың меншікті салмағы, электрөткізгіштігі және магниттік қасиеттері жоғарылау және де осы қасиеттер кендерді байытуды оңайлатады.
Минерал құрамындағы бағалы компоненттің көп мөлшерде болуы, металдың бөлінуін жеңілдететін жоғары процентті концентраттар алуға мүмкіндік береді.
ІІ-І топтардағы сирек элементтер - бериллий, литий, рубидий, цезий. Бұл элементтер көбінесе алюмосиликаттар түрінде кездеседі. xMeOySiO 2 Аl 2 О 3 , олардың таза минералдағы проценттік құрамы көп емес, ал концентраттарда тіпті аз болады. Кендердің және концентраттардың құрамында көп мөлшерде кремнезем мен глиноземнің болуы шикізаттан металдарды бөліп алу процесін күрделендіреді.
Тарихи мағлұматтар
Бериллий деп аталған элементті берилл минералыман 1979 ж. Вокелен ашты. Бериллийді таза күйінде алу өте қиын болды, тек 1827 жылы бериллий оксидін металдық кальциймен тотықсыздандыру арқылы жартылай таза бериллий алынды. Бериллийді алудың қиындығы, ол XX ғасырға дейін тек ғылыми қызығушылықта болды, ал практикада қолданылмады, осы себеппен түсіндіріледі. Алғаш рет бериллийді өндірісте балқыған тұздардан электролиз арқылы алуға деген талпыныс біздің ғасырдың 20-шы жылдардың соңына қарай болды, яғни бериллийді металл күйінде алғаннан кейін 100 жылдан кейін.
Қазіргі кезде бериллийдің бірнеше қызықты қасиеттерге иe екендігі белгілі және осымен байланысты химия және металлургияда бериллийді зерттеу және өндірістік алудың басты назарында болып отыр.
Әсіресе реакторларда нейтрон тежеткіш нейтрон көзі ретінде және ядролық техниканың басқа да қажеттіліктерінде пайдаланылуы оның ядролық қасиеттеріне байланысты.
Бериллийдің қосылыстарын зерттеуде И. В. Авдеев өтe көп еңбек еткен, ол 1842 жылы көптеген тәжірибелер арқылы бериллий алюминийге ұқсас болғанымен де, магнийге ұқсастығын дәлелдеген, яғни басқа ғалымдар атағандай, үш валенттілік емес екі валенттілік көрсететінін айтқан.
Тау инженері Авдеев бериллий қосылыстарын зерттеуді 1831 жылы Екатеринбург таулы аймағында шаруалармен кездейсоқ табылған берилл минералының үлгісін Екатеринбургқа гранильдеуші фабрикаға әкелгеннен бастады. Авдеев бірнеше қызықты тәжірибелер жүргізіп калий-бериллий-сульфат қос тұзын алды. Алынған өнімді анализдеу негізінде бериллий түзілуі алюминийге тән кварцтар түзбейтінін дәлелдеді. Бериллий оксидін "глицинді" зерттей отырып, Авдеев ол алюминий оксидіне қарағанда магний оксидіне көп ұқсас екенін және глицин оттектің бір атомынан тұратынын дәлелдеді. Авдеев сонымен қатар бериллийдің атомдық салмағын (9, 26-ға тең) анықтады. Д. И. Менделеев Авдеевтің пікірімен толық келісті және бериллий оксидін "глиноземді" емес "магнезиалды" тотық деп санады, яғни оған Ве 2 О 3 формуласы емес BeО дәл деп санады. Авдеев зерттеулері Менделеевке бериллийді периодтық жүйедегі II топқа кіргізуіне негіз болды және оған 9, 4 атомдық салмағын қабылдады, бұрынырақта атомдық салмағы 13-ке тең деп есептелген.
Бериллий алынғаннан кейін оны тәтті дәмі болғандықтан жаңа элементті "глиций" деп атауға ұсыныс жасалды. "Глиций" - "тәтті" дегенді білдіреді. Бірақ бұл атау (кезінде қолданылған) берілмеді және G1 деген символ тек кейбір француз туындыларында кездеседі.
Физикалық және химиялық қасиеттері
Берилий периодтық жүйедегі II топқа кіреді, атомдық салмағы 9, 2. Бериллийдің электрондық құрылысы, реттік нөмірі 4 болғандықтан өте қарапайым: 2, 2. Сыртқы екі электронын беріп Be, инертті газ гелийдің тұрақты конфигурациясына ие болады. Сондықтан, әдетте бериллий өзінің қосылыстарында екі валентті.
Металдық бериллий тығыздығы - 1, 84 г/см 3 .
Балқу температурасы - 1284°С.
Қайнау температурасы - 2744°К.
Бериллийдің бу қысымдары келесі шамалармен өрнектеледі:
Электрөткізгіштігі мысқа қарағанда 12 есе аз. Электр кедергісі 5, 88 10 -6 Ом см (0°С-де) . Металдық бериллий сұр болат түсті. Кристалдық торы гексагональды тығыз орналасқан. Бериллийдің созылғыштық модулі 3000 кг/мм 2 .
Оның механикалық қасиеттері бериллийді өңдеу мен алу жолына байланысты, яғни оның кристалл торының құрылымына байланысты.
Кристалдардың бағдарлы орналасуымен байланысты тіке және көлденең кескіні үшін бериллийдің қаттылығы да әp түрлі. Мысалы үлгінің көлденең кескіні үшін қаттылық мәні 64-ке тең, ал тіке кескіні үшін - 81, 2. Металдың қаттылығы, сонымен қатар оның тазалығына тәуелді. 99, 9%-ды таза бериллий морт сынғыш болады, сондықтан суық күйінде де, ыстық күйінде де майыстыруға келмейді. Ыстық күйінде оны нығыздауға болады.
Бериллийдің морттылығы оның құрамында оттек болуымен байланысты болуы мүмкін. Егер бериллийді вакуумда қышқылдық қасиеттері басым металдармен балқытса (мысалы 0, 5% титан қосса), онда қақтауға төзімді металл пайда болады.
Құрғақ ауада қалыпты температурада тұрақты, ылғал ауада ақырындап тотығады. 400-500°С-ға дейін қыздырғанда тотығу өте ақырын жүреді, 800°С-тан бастап жылдамдықта , 1200°С-да металдық бериллийдің ВеО - оксидінің жануы болады. Сутекпен металдық бериллий әрекеттеспейді.
Бериллийдің суға қатынасы өте ерекше: бериллий электр теpіc металл, кернеу қатарында магний мен кальцийдің арасында орналасқанымен де ол сутегін судан суық және ыстық қыздырылған күйде де ығыстырып шығара алмайды. Бұл металл бетінде тотық қабықшасының түзілуімен түсіндіріледі.
Бірақ металдық бериллий су мен әр түрлі кристал-логидраттар бөліп шығарады. Осындай құбылыстар магний, алюминий және мырыш үшін бұрынырақ та кездескен . Ұнтақталған металдық бериллий әp түрлі жылдамдықта ұнтақ тұздармен әрекеттеседі. Әсіресе кейбір металдардың хлорид кристаллогидраттары өте активті: сульфаттардың кристаллогид-раттары суды қиынырақ бөледі, ал нитраттың кристаллогидраттары бериллиймен мүлдем әрекеттеспейді.
Минералды қышқылдар бериллийді жақсы ерітеді, қыздырылған азот қышқылында ол тез ериді. Бериллий оксиді түзілуінен суық азот қышқылы металды енжарлайды.
Сілті ерітінділерімен бериллий алюминаттарға сәйкес - бериллат тұздарын түзеді:
Ве+2NaOH→Na 2 BeO 2 +H 2
Бериллийге ұқсас металдың бір де біреуі (магний, кальций, стронций, барий) қасиетке ие емес. Осы жағдайда периодтық жүйенің сол жақ бөлігіндегі элементтерге тән сипаттама, нақты айтқанда "диагональ бойынша ұқсастық" (1 сурет) .
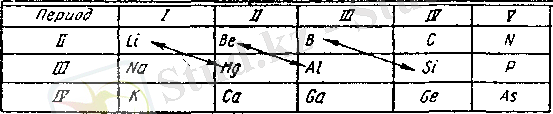
1 сурет - Элементтердің диагональ бойынша ұқсастығы
Сонымен, бериллий көптеген қатынастарда алюминиймен ұқсас, бор - кремниймен, литий - магниймен. Бериллий ядролық техникада маңызы болғандықтан, оның ядролық қасиеттеріне толығырақ тоқталып өтейік. Бериллийдің тек бір ғана табиғи изотопы бар - Be
9
. Жасанды жолмен бірнеше изотоптары алынған, оның ішінде маңыздысы Be
8
. Ол Be
8
- изотопын нейтрондармен немесе гамма-сәулелермен шағылдырғанда түзілуі мүмкін. Be
8
- жартылай ыдырау периоды бар болғаны 0, 61 сек., сондықтан ол ақырындап гелийдің екі атомына ыдырайды - Не
4
. Нейтрондармен шағылған металда (ядролық факторларда) 450°С-дан жоғарыда кішкене шарлар түрінде бөлінетін газдың қосылуы байқалады.
 - бөлшектердің әсерінен мынадай реакция өтеді:
- бөлшектердің әсерінен мынадай реакция өтеді:
4 Be 9 + 2 He 4 → 6 C 12 + нейтрон
Осының нәтижесінде бериллий дәл осындай жағдайларда нейтрон көзі болып табылады. Бериллийдің нейтрондарының жылуының көлденең қиылысуы өте көп емес - 0, 010 барн. Бериллий реакторлардағы металдық жүйелердегі нейтрондарды баяулатқыш болып табылады. Олардың толық сипаттамасы арнайы еңбектерде жызылған, мысалы, Дж. Стен мақаласында.
Бериллийдің улы екенін атап кету керек. Лабораториялық және өндірістік орындарда бериллий үнемі қолданатын жерлерде ауадағы бериллийдің шектік мөлшері 2 мкг/м 3 және аз уақытта қолдану, яғни 25 мкг/м 3 болу керек.
И. Азимов бериллийдің улылығын кейбір ферменттерде магнийді ығыстыратындығымен және сонымен оның тірі ағзадағы қозғалысын баяулатуымен байланыстырды.
Бериллий көптеген металдармен құйма түзеді. Осы құймалардың кейбіреуі іс жүзінде маңызды орын алады. Мысалы: мыспен балқымасы "бериллий бронзасы". Бериллийдің аралық металдармен қосылыстары (бериллидтер) ыстыққа және коррозияға төзімді болып келеді. Мынадай бериллидтер ZnВе 13 немесе NbBе 12 құрамында бериллий көп мөлшерде болғандықтан меншікті салмақтары аз және нейтрондарының көлденең басып алуы төмен. Осындай қосылыстар қазіргі кезде олардың жоғарғы температуралардағы тұрақтылығымен зерттеледі (1000°С) . Бериллийдің сынапта ерігіштігі өте төмен: 20°С-да - 0, 001%мас. Ертеректе берілген мәліметтер бойынша бериллийдің ерігіштігі одан да азырақ - 10 -6 % мас. 100°С-та, және - 10 -4 % 800°С-та.
Қосылыстары. Оттекпен қосылыстары
ВеО - бериллий оксиді аз борпылдақ ұнтақ. BeО - түзілу жылуы теория бойынша есептелген 135 ккал/моль. Кейбір авторлардың эксперимент бойынша берілген мәліметтері одан жоғары және 137, 4-тен 147, 3кал/моль аралығында (зерттеу әдісіне байланысты) . ВеО-ның балқу температурасы өте жоғары (2520±30°C) . Сәл төмен балқу температурасында ВеО-ның (2300°С-тан бастап) ұшқыштығы байқалады, ол лезде су буы қатысында мына реакция бойынша жоғарылайды:
BeO + H 2 O ↔︎ Be(OH) 2
Бериллий оксиді металды тотықтыру арқылы алынады немесе бериллий гидроксидін не бериллий сульфатын қыздыру арқылы алынады:
BeSO 4 →BeO+SO 3
ВеО, әсіресе ол 400°С-тан жоғары температурада қыздырылса, қышқылдарда нашар ериді, ал сілтілермен тек балқытқанда ғана әрекеттеседі. Бериллий тұздарының ерітіндісіне аммиакпен әсер еткенде бериллий гидроксиді де тұнбаға түседі. Бериллий оксиді және Ве(ОН) 2 амфотерлік қасиеттері арқасында қышқылдарда және сілтілерде сәйкесінше қышқылдар және бериллаттар (Na 2 BeO 2 ) түзуімен ериді. Өте таза бериллий оксидін келесі тәсілмен алады: техникалық оксидті негізгі ацетат ВеО Ве(СН 3 СаО) 2 -ге ауыстырады, оның балқу (2300) және қайнау (3300) температуралары төмен. 360-400°С-қа дейін қыздырғанда бериллий ацетаты айдалып техникалық оксидтегі қоспаларынан бөлінеді. Бериллий ацетатын қайтара айдағаннан соң, оны термиялық ыдыратады. 600-700°С-да газ фазадан жұқа ұнтақ ВеО түзіледі.
Оттекті қышқылдардың тұздары
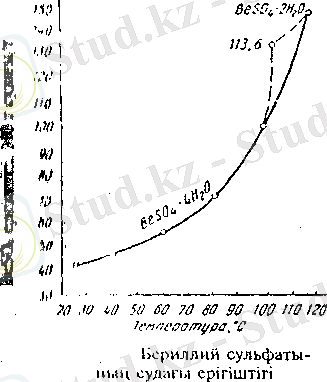
Бериллийдің қышқылды тұздарының ішінде маңызы зор тұздары, технология саласы бойынша сульфаттар. Бериллий сульфаты BeSO 4 (магний сульфатына ұқсас) саны әр түрлі кристалдық суы бар гидраттар түзеді. Бериллийдің алюминийге емес магнийге ұқсас жай немесе қос сульфаттар түзеді. Бұл жағдайдың іс жүзіндегі маңызы зор. Осыны пайдаланып бериллийді алюминийден кристаллизациялау жолымен бөлуге болады, ол алюмокалийлі ашудастар, жай немесе қос тұздар бериллий-калий сульфаттарына қарағанда ерігіш.
Я. А. Фиалков және С. Д. Шаргородский төрт сулы бериллий сульфатының дегидратациялануын BeSO 4 ·4H 2 O және сусыз сульфаттың термиялық диссоциациясын толығымен зерттеді. Тұздарды зерттеудің термографиялық әдісін қолдана отырып, 580° және 635°С-да байқалатын жылу эффектілері сусыз бериллий сульфаттарының термиялық диссоциациясына дәл келеді. Осы температурада BeSO 4 балқымастан ыдырайды.
Изоморфты бериллий селениді BeSeO 4 ·4H 2 O 300°С-да дегидратацияланады, ал толық ыдырау - 560°С-та жүреді. Сульфаттар және сілтілік жер металл селенидтері термиялық тұрақтылығы жағынан бериллий бірінші орында, яғни басқалардан оңай, жылдам ериді. Жеткілікті түрде өте үлкен және температура жоғарылауымен көтеріледі. Сулы ерітінділеріне қышқылды реакция тән.
Бериллий нитраты судың торы молекуласымен кристалданады. Тұздары өте ылғалтартқыш, ауада балқи бастайды, қыздырғанда азот оксидтерін бөліп отырып және ВеО түзе отырып ыдырайды. Be(NO 3 ) 2 -нің сулы ерітінділеріне қышқылдық орта береді. Бериллий нитраты спиртте, ацетонда және басқа органикалық ерітінділерде ериді.
 А. В. Новоселова Be(NO
3
)
2
-HNO
3
-H
2
O жүйесін толық зерттей отырып, үш-, екі-, моногидраттарды зерттеді. Бериллий карбонаты ВеСО
3
4Н
2
О, негізгі бериллий карбонатының ерітіндісін көмірқышқыл газымен қанықтыру арқылы, сосын ерітіндіні суалтып эксикаторда кептіру арқылы алу мүмкін.
А. В. Новоселова Be(NO
3
)
2
-HNO
3
-H
2
O жүйесін толық зерттей отырып, үш-, екі-, моногидраттарды зерттеді. Бериллий карбонаты ВеСО
3
4Н
2
О, негізгі бериллий карбонатының ерітіндісін көмірқышқыл газымен қанықтыру арқылы, сосын ерітіндіні суалтып эксикаторда кептіру арқылы алу мүмкін.
Бериллий тұздарының сулы ерітінділерімен сілтілік металл карбонаттарының әрекеттесуі нәтижесінде құрамы тұнбаға түсіру жағдайына байланысты болатын негізгі карбонаттар түзіледі. Жоғарыда көрсетілгендей, бериллий гидроксиді қышқылды да және сілтіде де ериді. Ол көмірқышқылды аммонийде комплексті бериллий карбонатын түзу арқылы ериді:
Ве(ОН) 2 + 2 (NH 4 ) 2 CO 3 →(NH 4 ) 2 [Ве(СО 3 ) 2 ] +2 NH 4 ОН
Бериллий карбонатының ерітіндісін қайнатқанда гидролиз жүреді, негізгі тұз тұнбаға түседі:
2(NН 4 ) 2 [Ве(СО 3 ) 2 ] +Н 2 О→Ве(ОН) 2 BeCO 3 ↓+2(NH 4 ) 2 CO 3 +CO 2 .
Бериллий карбонатының ерігіштігін пайдаланып алюминийден бөлуге қолданылады. Бериллийдің басқа да оттекті қышқылдары белгілі.
Біз тек бериллий метафосфатына ВеР 2 О 6 және ВеОР 2 О 5 -ке тоқталамыз, бұл метафосфат бериллий оксидін метафосфор қышқылының артық мөлшерімен балқыту арқылы алуға болады. Бериллий метафосфаты түссіз кристалл, ультракүлгін сәулелерін толығымен өткізеді, техникада қолданады. Бериллий тұзы гидролизге оңай ұшырайтын болғандықтан оны зерттеу қиынға соғады. Бериллат ерітінділерін қайнатқанда бериллий толық тұнбаға түседі:
Na 2 BeO 2 +2HOH→Be(OH) 2 ↓ + 2NaOH.
Бериллийдің органикалық қосылыстары
Бериллий органикалық қышқылдармен әр түрлі әдіс арқылы алынатын өте тұрақты қосылыстар түзеді. Бұл қосылыстардың жалпы формуласы Be 4 O(RCOO) 6 , мұнда R - органикалық радикал (немесе құмырсқа қышқылы болған жағдайда сутек ионы) . Бұл қосылыстар суда мүлде ерімейді, бірақ органикалық еріткіштерде жақсы ериді, орташа температураларда ыдыраусыз айдалады (300-350°С) . Тұздарды минералды қышқылдармен өңдегенде ВеО түзе отырып және сәйкес органикалық қышқылдар түзе отырып ыдырайды. Бұл қосылыстардың қасиеті көрініп түрғандай, бериллийдің жаңа тұздарын алуға мүмкіндік береді.
Сондықтан, кейбір тұздары бериллийдің химиялық технологиясында маңызды роль атқарады. Осындай типтегі тұздарды зерттеумен А. В. Новоселова қызметкерлермен бірге айналысады, ол комплексті аммиактар BеO 4 (RCOO) 6 5NH 3 типі түзілуін дәлелдеген. Сонымен қатар майлы аминдермен берилий ацетатының қосылыстары зерттелген.
В. К. Золотухин берген мәліметі бойынша, Ве(ОН) 2 шарап қышқылды натрий ерітіндісінде ерігенде, құрамы натрий тартратынан және ерітіндінің рН-на тәуелді болатын натрий гидрооксотартрат комплекс деп анықталған. Тартраттың артық мөлшерінде [Be(OH) 2 C 4 H 4 O 6 ] Na 2 қосылысы түзіледі, бұл қосылыс бериллий фторидімен салыстырғанда тұрақтырақ.
Бериллий хлориді жай эфирлермен диэтил, диметил, анизолмен, диоксан және тағы басқалармен қосылу өнімдерін түзеді. Бұл қосылыстардың жалпы формуласы - ВeCI 2 nR 2 O. Осы қосылыстардың қасиеті (сәйкесінше) эфир түзетін сәйкес спирттердің атомдылығынан тәуелді болады, екі атомды спирттер эфирімен түзілетін бұл қосылыстарды полимерлі қосылысты деп жорамалдауға болады: олар балқымастан ыдырайды, органикалық еріткіштерде ерімейді және химиялық инертті.
Әсіресе металдық бериллийді бериллий хлоридімен абсолютті этил спиртінде өңдегенде түзілетін бериллий алкоголяттарын атап өңдеуге болады. Сутегі бөлінуімен жүретін реакция нәтижесінде - бериллий этилаты алынады - Ве(ОC 2 Н 5 ) 2 , ол инерттілігімен ерекшеленеді, ол балқымайды, айдалмайды. Әдеттегі органикалық еріткіштің біреуінде де ерімейді, спиртпен қайнатқанда да өзгермейді. Бірақ бериллий этилатының сірке қышқылдығы өлшемі этоксаацетатқа Ве(ОС 2 Н 5 ) (ОСОСН 3 ) ауысады, ал абсолютті спирттегі бериллий хлоридында бериллий этилаты толығымен комплексті қосылыс түзе отырып ериді.
Бериллий сонымен бірге кейбір органикалық негіздер - пиперидин, хинальдин және тағы басқалармен комплексті қосылыстар береді. Бұл қосылыстар органикалық еріткіштерде (эфир, бензолда) ерігіш және бериллийді басқа элементтерден бөлуде қолданады.
Галогендермен қосылыстары
Бериллий тікелей галогендермен қосылады: фтормен бөлме температурасында, хлормен, бром және иодпен қыздырғанда. Бериллий фториды және хлориды оның маңызды қосылыстары, бериллий кендерін өңдегенде қолданылады.
ВеҒ 2 - бериллий фториды түссіз, шыны тәріздес зат, 577 + 10 0 С температурада балқиды. 800°С-да бериллий фториды қозғалмалы сұйықтыққа айналады, ол осы температурада булана бастайды.
ВеҒ 2 -нің қаныққан бу қысымы жұмыс авторларының мәліметі бойынша 846К-да 1, 76210 -3 мм сынап бағанасымен, 949, 5К-да 6, 18410 -2 мм сынап бағанасы бойынша жетеді. Магний фторидінен айырмашылығы бериллий фториді суда жақсы ериді. Бериллийдің жай және қос фторидтерінің ерітінділері толығымен зерттелген.
И. В. Тананаев және Э. Н. Дейчман ВеҒ 2 ерітіндісін физика-химиялық анализ әдісімен зерттей отырып мынадай қорытынды жасады. ВеҒ 2 - НҒ - Н 2 О жүйесінде бериллий комплексті ион түзеді, мұнда ең тұрақтырағы ВеҒ + ионы, оның тұрақсыздық константасы 5∙10 -5 . Осыған ұқсас қорытындылар бериллийдің фторидті комплекстерін колориметрлік анализ әдісімен зерттеу кезінде де алынған.
LiF-BeF 2 жүйесінде литий фториді мен бериллий фторидінің түрлі қатынастарымен ерекшеленетін және сонымен бірге балқу температураларында едәуір айырмашылық болатын қос фторидтер, мысалы: 2LiFBeF 2 (немесе Li 2 BeF 4 ) және LiF 2 BeF 4 (немесе LiBe 2 F 5 ) түзілетіні анықталған. BeF 2 алюминийдің сәйкес қосылыстарынан айырмашылығы калий және натрий фторидтерімен суда еритін комплексті қосылыстар (Na, K) 2 BeF 4 және (Na, K) BeF 3 береді. Осыған байланысты бериллий фторидінің комплекстері бериллийді алюминийден бөлуде практикалық маңызы өте зор.
Комплексті фторид (NH 4 ) 2 BeF 4 қыздырғанда ВеҒ 2 бөле отырып ыдырайды. Осы процесті төменгі температурада термогравиметрлік әдіспен зерттегенде, ыдырау процесі үш сатымен өтетіні анықталады:
(NH 4 ) 2 BeF 4 →NH 4 BeF 3 → NH 4 Be 2 F 3 → Be F 2
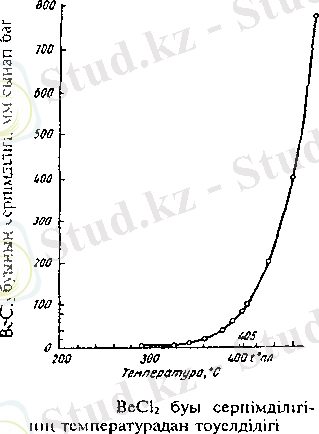
ВеСl 2 түссіз кристалдар, ылғалтартқыш, суда жақсы ериді, балқу температурасы 405, қайнау температурасы 487°С. Төменде ВеС1 2 -нің әр түрлі температурадағы серпімділігі шамалары көрсетілген. Суретте осы тәуелділік графикалық түрде көрсетілген.
Суреттен ВеСl 2 - буының серпімділігі оның балқу температурасына дейін байқалады және жоғары температурада тез өсе бастайды. ВеС1 2 -ні оңай айдау мүмкіншілігі үшін практикада кеңінен қолданады.
Сусыз ВеСl 2 -ні газ тәрізді хлормен бериллий оксидін көміртек қатысында 700°С-да әрекеттестіру арқылы алады:
BeO+C+Cl 2 →BeCl 2 +CO
Бірақ басқа да хлорлаушы сегменттер - фосген, төртхлорлы көміртек қолдануға да болады.
ВеСl 2 суда жақсы ериді және сулы ерітіндіден төрт молекуласымен кристаллогидрат ВеС1 2 -4Н 2 О түрінде кристалданады, қыздырғанда бұл тұз бериллий хлороксидіне (негізгі тұз) айналады, ол суда өте қиын ериді.
Құрамында калий және литий хлориді және 10% бериллий хлориді бар балқыманы электролиздегенде (электродтар - бериллий мен молибден) молибденді электродтың потенциалы уақытқа байланысты өзгеруі байқалды.
 Бұл жағдай Ве
2+
/Ве тотығу-тотықсыздану жүйесіндегі Ве
+
иондарының пайда болуына байланысты. Ве+Ве
2+
↔︎ Ве
+
реакциясы қайтымды және балқыманың температурасын төмендеткенде немесе Ве
2+
иондарына байланыстыратын фтор иондарын қосқанда сол жаққа ығысады. Осындай жағдайда бериллийдің бір валентті болатыны дәлелденді деп есептеуге болады, бірақ тек жоғары температурада.
Бұл жағдай Ве
2+
/Ве тотығу-тотықсыздану жүйесіндегі Ве
+
иондарының пайда болуына байланысты. Ве+Ве
2+
↔︎ Ве
+
реакциясы қайтымды және балқыманың температурасын төмендеткенде немесе Ве
2+
иондарына байланыстыратын фтор иондарын қосқанда сол жаққа ығысады. Осындай жағдайда бериллийдің бір валентті болатыны дәлелденді деп есептеуге болады, бірақ тек жоғары температурада.
Көміртекпен қосылыстары
Бериллийдің екі карбиді белгілі - Ве 2 С және ВеС 2 . Біріншісі электрлік пеште бериллий оксидін қыздырғанда алынады, сумен метан бөле отырып ыдырайтын қызыл түсті зат. ВеС 2 -ні 450°С-та металдық бериллийді ацетиленмен әрекеттестіріп алады.
Күкіртпен қосылыстары
Бериллий тұздарының ерітіндісіне күкіртсутек жібергенде тұнба бөлінбейді, себебі бериллий сульфиді сумен бірге жүре алмайды. Ол сумен күкіртсутек бөле отырып ыдырайды:
BeS+2H 2 O→Be(OH) 2 +H 2 S
Берилий сульфидін құрғақ күйде бериллий ұнтағын күкірт буымен әрекеттестіргенде алынады. ЬІлғалды ауада сульфид ыдырайды, қыздырғанда SO 2 бөле отырып тотығады.
Азотпен, фосформен және бормен қосылыстары
Металдық бериллий 700-1400°С-да азотпен 2200° балқитын және өте қатты Be 3 N 2 нитрид түзеді. Нитрид басқа да түрлі әдістермен де, мысалы, металдық ұнтақ бериллийді 1000°С-да аммиакпен әрекеттестіргенде немесе 1250°С-та бериллий карбидін азотпен әрекеттестіргенде алу мүмкін. Бериллий нитриды минералды қышқылдармен аммиак бөле отырып ыдырайды.
Фосформен бериллий бір қосылыс фоссфид Ве 3 Р 2 түзеді, оны металдық бериллий ұнтағын фосфор буымен әрекеттестіріп алады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz