Бензол молекуласының электрондық құрылысын МПДП әдісімен есептеу және талдау


Бензол молекуласының электрондық құрылысын МПДП әдісімен есептеу
МАЗМҰНЫ
Реферат . . . 3
Кіріспе . . . 4
1. ӘДЕБИЕТТІК ШОЛУ . . . 6
1. 1. Органикалық қосылыстардың электрондық күйлерін эерттеу өдістері . . . 6
1. 2. Бензол молекуласының кеңістіктік құрылымы . . . 7
1. 3. Бензол молекуласының электрондық құрылысы π электрондық жуықтауда . . . 9
1. 4. Бензолдың сіңіру спектрлері . . . 11
1. 5. Бензолдың физикалық- химиялық қасиеттері . . . 12
2. Бензол молекуласының электрондық құрылысын есептеу . . . 15
2. 1 Квантты химияның есептеу әдістері . . . 15
2. 2. Жартылай эмпирикалық МПДП әдісі . . . 18
2. 3. Бензол молекуласының есептелген негізгі нәтижелері . . . 19
2. 4. Бензол молекуласының молекулалық орбитальдарын талдау . . . 21
Қорытынды . . . 23
Пайдаланылған әдебиеттердің тізімі . . . 24
Қосымша 1. Бензол молекуласының МПДП әдісімен есептеу нәтижелері. . 26
Қосымша 2. Зерттеу жұмысындағы негізгі қысқартулар . . . 39
Реферат
Дипломдық жұмыстың көлемі беттен, кестеден, суреттен, кіріспеден зерттеу жұмыстарыннан, қорытындыдан және 22 пайдаланылған әдебиеттер тізімінен тұрады.
Негізгі терминдер: атомдық орбитал, молекуалық орбитал, төменгі бос молекулалық орбиталь (ТБМО) жоғарғы толған молекулалық орбиталь (ЖТМО), модифицированный метод пренебережения двухатомным дифференциальным перекрыванием (МПДП), модифицированный метод частичного пренебрежения дифференциальным перекрыванием (МЧПДП) .
Жұмыстың мақсаты: жартылай эмперикалық квантты химиялық МПДП әдісімен бензол молекуласының электрондық құрылысын есептеп, алынған нәтижелерді эксперименталдық мәліметтермен салыстыру және талдау.
Зерттеудің әдістері: модификацияланған екі атомды дифференциялдық астасуды ескермеу әдісі ( модифицированный метод пренебережения двухатомным дифференциальным перекрыванием ), (МПДП),
Зерттеудің ғылыми жаңалығы: бензол молекуласының электрондық құрылысы есептелді.
Алынған нәтижелер: бензол молекуласының күйін сипаттайтын квантты химиялық шамалар алынып, нәтижелер мәліметтермен салыстырылды.
К І Р І С П Е
Квантты химия пәнінің негізгі мақсаты - ол әртүрлі жүйелерге Шредингердің стационар күй теңдеуін шешіп, жүйенің күйін сипаттайтын толқындық функциялар жиынын және энергетикалық күйлердің энергия мәндерін алу. Немесе бұл мәселені квантты химия тілінде Гамильтон операторының меншікті мәндері және меншікті функцияларын табу деп те атайды.
Квантты химияның теориялық мәселелерін бекітуде молекулалардың электрондық құрылысын есептеп зерттеудің маңызы зор.
Зерттеу жұмыстарын орындау барысында квантты химиялық әдістерді қолданып, қарастырылатын молекулалардың электрондық құрылыстары есептеледі. Нәтижелерді талдап квантты химиялық есептеу нәтижелерін эксперименттік мәліметтермен салыстырады. Молекулалық орбитальдарға талдаулар жүргізеді.
Есептеулерден молекуланың геометриясы (байланыс ұзындықтары, байланыс аралық бұрыштар, кеңістіктік бұрыштар) молекулалық орбитальдардың энергиялары және молекулалық орбитальдардың атомдық құрамы, молекуланың толық энергиясы, түзілу жылуы, электрлік дипольдық моментінің шамасы, атомдардағы зарядтардың таралу мәндері т. б. алынады.
Молекулалық орбитальдардың энергиялары заттардың молекулалық спектрлерін зерттеуде қолданылады.
Химиялық мәселелерді шешуде шегаралық молекулалық орбитальдардың маңызы өте зор. Қарама - қарсы таңбамен алынған ең жоғарғы молекулалық орбитальдың энергиясы молекуланың иондау энергиясын береді, ал ең төменгі бос молекулалық орбитальдың энергиясы молекуланың электрон тартқыштығымен (сродство к электрону) салыстырылады.
Бензол каучукты және лак шайырларын еріткіш ретінде қолданады. Бензол стиролды синтездеуге қолданылады. Ал стирол полистиролды өндіруде пайдаланылады. Бензол кумолды (фенол мен ацетон өндіруде қолданылады), циклогександы (циклогексанол, капролактама және полиамидтерді өндіруде қолданылады), нитробензолды (аниллинді, бояғыштарды, фармацевтикалық препараттарды өндіруде қолданылады), хлорбензолды және (инсектицид өндірісінде қолданылады), малеин ангидридін (полиэфирлі шайырлар өндірісінде қолданылады) өндіруде шикізат ретінде қолданылады.
Қосылыстардың физикалық-химиялық қасиеттері олардың электрондық құрылысымен анықталады.
Біз бұл жұмысымызда бензол молекуласының электрондық құрылысын МПДП әдісімен есептеп, нәтижелерге талдаулар жүргіздік.
Жұмыс екі бөлімнен тұрады. Бірінші бөлімінде бензолдың физикалық-химиялық қасиеттері, алыну жолдары, қолдану бағыттары және зерттеу жұмыстарының нәтижелері келтірілген ғылыми әдебиеттер мен мақалаларға шолулар жасалған. Осы бөлімде есептеу әдістерінің мүмкіншіліктері және оны қолданып шешілген химиялық мәселелер қарастырылған.
Жұмыстың екінші бөлімінде негізінен бензол молекуласының электрондық құрылысының есептеу нәтижелері келтіріліп, оларға талдаулар жүргізілген. Зерттеу нәтижелерінің қолдану бағыттары көрсетіліп, экспериментальдық мәліметтермен салыстырылған.
Зерттеу жұмысы қорытындыланып, пайдаланылған әдебиеттер тізімі келтіріліп, жұмысқа қосымшалар берілген.
1. Әдебиеттік шолу
1. 1. Органикалық қосылыстардың электрондық күйлерін эерттеу әдістері
Органикалық қосылыстардың электрондық күйлерін эерттеуге соңғы кезеңде көптеген жаңа физикалық әдістер, атап айтқанда инфрақызыл спектроскопия, ядролық магниттік резонанс, масс-спектрометрия т. б. көптеп қолданылады. Химик-органиктер көп қолданатын электрондық абсорбциялық спектроскопия әдісі кеңінен таралған. Органикалық қосылыстардың жұтылу (сіңірілу) спектрлері, олардың құрылысын зерттеуде және мөлшерлік талдауда маңызды роль атқарады.
Жұтылу электрондық спектрлері заттардың электромагниттік сәулеленумен өзара әрекеттескен кезінде пайда болады.
Заттар сәулелунумен өзара әрекеттескенде энергия квантталып жұтылатыны және шығарылатыны белгілі. Жарық квантының энергиясы Планк формуласымен анықталатыны белгілі:
ε = h ν (1), мұндағы һ =6, 62·10 -34 Дж·с, Планк тұрақтысы, ν - жарық толқынының жиілігі, сәулеленудің сіңірілуі энергиясы зат молекуласының екі энергетикалық күйінің айырымына тең болған жағдайда ғана орын алады.
Органикалық қосылыстардың молекулаларының электрондық деңгейлерін молекулалық орбитальдар теориясы тұрғысынан қарастырған ыңғайлы. Әр түрлі кластардың молекулаларының иондау потенциалдарын салыстыра келіп және молекулалық орбитальдарға электрондарды орналастырып мынандай қатардың орын алатыны белгілі болды: σ < π< n. σ - молекулалық орбитальда қаныққан молекулалардың байланыстыратын электрондары орналастырады, π - орбитальда қос және үш байланыстың байланыстыратын электрондары орналастырады, ал n - орбитальда азот, оттегі сияқты гетероатомдардың бөлінбеген электрондық жұптары орналасады.
Органикалық қосылыстарды қоздырған кезде бұл электрондар энергиясы бойынша жоғары жатқан босаңдататын π* және σ* молекулалық орбитальдарға өтеді. Сонымен, барлық қосылыстарда келесі электрондық өтулер орын алады. Олардың ішіндегі ең маңыздылары:
n→ n* (карбонилдік қосылыстар)
π→ π* (алкндерде, алкиндерде, карбонилдік қосылыстар және азоқосылыстар)
σ → π* (карбонилдік қосылыстар)
σ → σ* (алкандар) .
Ароматты молдекулалардағы электрондық деңгейлердің энергиялары өте күрделі.
Органикалық қосылыстар қозған кезде электрондар ең жоғарғы толған молекулалық орбитальдан ең төменгі бос молекулалық орбитальға өтеді, бұл өтуге сәйкес келетін спектрде сіңірілу жолағы пайда болады.
1. 2. Бензол молекуласының кеңістіктік құрылымы
Гибридтену теориясы тұрғысынан бензол молекуласының кеңістіктік құрылымын қарастырайық. Бензол молекуласының сақинасы sp 2 - гибридтелген алты көміртегі атомы атомдық орбитальдарымен түзілген. Әрбір көміртегі атомы үш гибридтелген орбитальдары арқылы көрші екі көміртегі атомымен және бір сутегі атомымен байланыс түзеді(1- сур. ) . Сонымен бірге әрбір көміртегі атомының гибридтелмеген p z - атомдық орбитальдары бар. Көрші атомдардың p z - атомдық орбитальдары астасуы арқылы π - байланыс түзіледі.
І және ІІ құрылымдары D 3h симметриялы, дара және қос байланыстағы көміртегі атомдары физикалық қасиеттері бойынша (мысалы байланыс ұзындығы) бір - бірінен айрықша болады. Дегенмен, экспериментальдық мәліметтерден бензол молекуласындағы көміртегі - көміртегі байланыстары бірдей екндіктері және ол байланыстар дара байланыс және қос байланыстан айрықша болатындығы белгілі болды. Мысалы, этан молекуласындағы дара
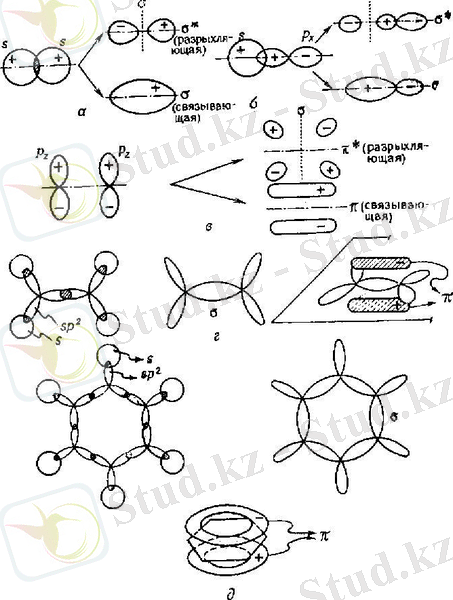
1-сурет. Органикалық қосылыстардағы әр түрлі байланыстардың түзілуі.
С - С байланыс ұзындығы 0, 154 нм, ал этилен молекуласындағы С = C байланыс ұзындығы 0, 134 нм болатын болса, бензол сақинасындағы көміртегі - көміртегі арақашықтықтары 0, 140 нм. Бензол молекуласындағы барлық көміртегі - көміртегі байланыстарының өзара теңдігі бензол молекуласының симметриясын D 6h болатындығын көрсетеді. Бұл біршама экспериментальдық мәліметтермен дәлелденеді.
1. 3. Бензол молекуласының электрондық құрылысы π электрондық жуықтауда
Бензол молекуласын ең қарапайым молекулық орбиталь атомдық орбитальдардың сызықтық комбинациясы (МО АОСК) тұрғысынан қарастырайық. Бұл әдісте π электрондық жуықтау қолданылады. Мұндай есептеу әдісін Хюккельдің қарапайым әдісі (МОХ) деп атайды. Хюккельдің қарапайым әдісімен қарастырылған жұмыстар Стрейтвизер, Хигаси және Базилевский монографияларында көптеп келтірілген. Қазіргі кезеңде бұл әдіспен есептелген жұмыстар өзінің маңыздығын жойғанын айта
кеткеніміз жөн. Дегенмен, Хюккельдің қарапайым әдісі көптеген химиялық мәселелерді шешуде дұрыс нәтижелер бергенін айтқан дұрыс.
Молекулалық орбитальды көміртегі атомдарының p z - атомдық орбитальдары сызықтық комбинациясы түрінде қарастырайық:
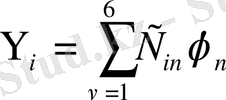
мұндағы: ψ і - молекуланың күйін сипаттайтын молекулалық орбиталь,
φ ν - көміртегі атомдарының 2p z - атомдық орбитальдары,
С іν - шамалары энергияның минимум болатын шартынан табылатын тұрақтылар.
π электрондар барлық алты көміртегі атомдарын қамтитын молекулалық орбитальдарға орналасады.
2 - суретте бензол молекуласының қарастырылған жуықтаудағы энергия мәндері келтірілген. Е 0 оқшауланған көміртегі атомының 2 p z - атомдық орбитальының энергиясы. Ең төменгі деңгейдің мәні Е 1 = Е 0 + 2β, мұндағы β - екі көрші көміртегі атомдарының резонанстық интегралдары.
 Резонанстық интегралдың шамасы теріс екендігін айтуымыз керек.
Резонанстық интегралдың шамасы теріс екендігін айтуымыз керек.
 - π электрондардың эффективті Гамильтон операторы немесе оны толық энергияның операторы деп те атайды. Келесі деңгейлердің энергиялары былай анықталады
- π электрондардың эффективті Гамильтон операторы немесе оны толық энергияның операторы деп те атайды. Келесі деңгейлердің энергиялары былай анықталады
E 2, 3 = Е 0 + β;
Е 4, 5 = Е 0 - β;
Е 6 = Е 0 - 2β;
E 2, 3 және E 4, 5 екі ретті туындаған. Бензол сақинасының алты π электрондары қалыпты жағдайда ең төменгі молекулалық орбитальдарға Паули прицпіне сәйкес орналасады. Ең төменгі деңгейде екі электрон ал екі ретті туындаған E 2, 3 - төрт электрон орналасады. Бұл молекулалық орбитальдар байланыстыратын МО болып есептелінеді, өйткені олардың энергиясы Е 0 энергиясынан төмен.
Сонымен, 6 π электрондардан энергияларының қосындысы берілген жуықтауда былай анықталады:
2(Е 0 + 2 β) + 4(Е 0 + β) = 6 Е 0 + 8 β
Егер электрондар белгілі бір байланыстарға шоғырланған болса, онда π электронның энергиясы Е 0 + β болар еді, ал барлық 6π электронның энергиясы 6Е 0 + 6β болар еді. Бұл энергия шоғырланбаған электрондардың энергиясынан ∆E = -2 β шамасына артық. Соңғы шаманы бензол молекуласының делокализация энергиясы деп атайды.
Делокализацияланған орбитальдарды басқаша келтіруге болады. Оның кескіні 1- суретте келтірілген. Ол дұрыс екі алты бұрыш сияқты кескінделеді. Олардың бірі ядролар жазықтығының үстінде, ал екіншісі жазықтықтың астында жатады. Осының нәтижесінде электрондар дұрыс алты бұрыштың бойымен қозғалады, сондықтан олар толық делокалданған. Мұндай тұжырымның дұрыстығы көптеген экспериментальдық мәліметтермен дәлелденеді. Е
2 - сур. Бензол молекуласының энергетикалық деңгейлері.
2 - суретте бензол молекуласының π - электрондық жуықтаудағы энергетикалық деңгейлері келтірілген. Суреттен молекуланың ЖТМО және ТБМО деңгейлері екі ретті туындағаны көрінеді. Бұл молекулалық орбитальдардың атомдық құрамына, құрылымына және химияда алатын орындарына кейінірек тоқталатын боламыз.
1. 4. Бензолдың сіңіру спектрлері
Бензол және оның туындыларының жұтылу спектрлері, химиялық қасиеттері сәйкес алифатты қосылыстардың спектрлерінен айрықша болады. Сондықтан оларды жекелеп қарастырайық.
Бензол ароматты жүйелердің ең қарапайымы, оның спектрлерінде үш жұтылу жолағы байқалады. Олардың екі жолағының интенсивтілігі жоғары: біріншісінің максимумы 55 500 см -1 (180 нм) аймақта, екіншісі 49 000 - 52 000 см -1 (193 - 204 нм) аймақта байқалады. 33 000 - 43 500 см -1 (230 - 270 нм) аймақта байқалатын үшінші жолақтың интенсивтілігі алдынғыларға қарағанда әлде қайда төмен.
Бензол молекуласының спектрі 3- суретте келтірілген және ол молекуланың сызықты аналогы гексатриен - 1, 3, 5 молекуласының спектріне қарағанда өте айрықша. Бұдан молекуладағы химиялық байланыстардың және бұл қосылыстардың реакцияға қабілеттіліктері әр түрлі болатындығы көрінеді.
1. 5. Бензолдың физикалық- химиялық қасиеттері
Бензол сипаттамалы иісі бар түссіз сүйық, еру температурасы 5, 4 о С, ал қайнау температурасы 80, 1 о С. Жанғанда түтінді жалын шығарады. Іс жүзінде суда ерімейді, бірақ көптеген органикалық еріткіштермен жақсы араласады. Бензолдың булары - улы. Бензол химиялық реакцияларға негізінен орнықты. Нитрлеу реакциясы (өнімі - нитробензол), сульфонирлеу (өнімі - бензолсульфоқышқыл) реакциясына қарағанда жеңіл жүреді.
Бензолдың хлормен реакция механизмі және алынатын өнімдер реакцияны жүргізу шарттарына байланысты. Катализатор ретінде темір галогенидтерінің қатысында хлор орынбасар ретінде болып хлорбензол түзіледі, басқа катализатор қолданғанда немесе ультракүлгін сәулелермен сәулелендіргенде қосып алу реакциясы жүреді, нәтижесінде стереоизомерлік қоспасы түзіледі.
Фридель - Крафтс реакциясы жәрдемімен бензолды басқа арендерге немесе ароматты кетондарға түрлендіруге болады.
Бензолдың алыну жолдары
Бензолды алғаш рет 1825 ж. ағылшын физигі Фарадей бөліп алған. Бензолды алудың келесі жолдарын атап көрсетуге болады:
- риформинг, экстракция және фракциялық айдау жолдарымен мұнайды айдау барысында бензин фракцияларынан бензолды бөліп алуға болады;
- бензинді пиролиздеу кезінде қосымша өнім ретінде бензол түзіледі;
- кокстік газдан немесе таскөмірлік шайырлардан алуға болады;
- ацетиленді қыздырылған түтік арқылы өткізгенде 3С2Н2→ С6Н6;
- фенилдиазонның тұздарын қалайы(ІІ) хлоридінің жәрдемімен тотықсыздандыру кезінде бензол бөлінеді;
Бензолдың қолданылуы
Бензол каучукты және лак шайырларын еріткіш ретінде қолданады. Бензол стиролды синтездеуге қолданылады. Ал стирол полистиролды өндіруде пайдаланылады. Бензол кумолды (фенол мен ацетон өндіруде қолданылады), циклогександы (циклогексанол, капролактама және полиамидтерді өндіруде қолданылады), нитробензолды (аниллинді, бояғыштарды, фармацевтикалық препараттарды өндіруде қолданылады), хлорбензолды және (инсектицид өндірісінде қолданылады), малеин ангидридін (полиэфирлі шайырлар өндірісінде қолданылады) өндіруде шикізат ретінде қолданылады.
Бензол және бензол туындыларын синтездеудің бір жолы ретінде Фридель - Крафтс реакциясын қарастырайық. AlCl 3 немесе BF 3 каталитикалық әсерінен бензол алкилгалогенидтерімен, алкендермен немесе ацилгалогенидтерімен өзара әрекеттесіп нәтижесінде бензол ядросына алкин радикалы енеді.
+ Cl─CH 2 ─CH 3 → ─ CH 2 ─CH 3 +HCl
этилхлорид этилбензол
+ CH 2 =CH 2 → ─ CH 2 ─CH 3
этилен этилбензол
+ Cl ─CO ─ CH 3 → ─CO ─ CH 3 + HCl
ацетилхлорид ацетофенон
Бұл реакциялар өндірісте кеңінен қолданылады.
Ароматты қосылыстардың ең қарапайымы болып саналатын бензолдың химиялық формуласы С 6 Н 6 . Молекуладағы алты көміртегі атомдары өзара байланысып сақина құрайды.
Бензол молекуласының моделі және есептеуге қажетті атомдардың номерленуі
Н 11 Н 9
С 4
С 2
С 6 С 1
Н 12 Н 7
С 3
С 5
Н 10 Н 8
Суретте есептеуге қажетті бензол молекуласындағы атомдардың номерленулері келтірілген.
2. Бензол молекуласының электрондық құрылысын есептеу.
2. 1. Квантты химияның есептеу әдістері.
Химияның теориялық мәселелері квантты химияда қарастырылады. Квантты химияның негізгі мақсаты қарастырылатын жүйеге (молекула, ион, радикал және т. б. ) Шредингер теңдеуін жуықтап шешіп, жүйені сипаттайтын толқындық функциялар мен МО жиынын алу. Егер жүйенің осы шамалары белгілі болған жағдайда, онда жүйені сипаттайтын барлық физикалық-химиялық шамаларды толығымен анықтауға болады (қарастырылған жуықтауда) .
Квантты химиялық есептеу әдістері негізінен 2 үлкен топқа бөлінеді:
1) эмпирикалық емес есептеу әдістері (неэмпирические методы, «ав initio»)
2) жартылай эмпирикалық есептеу әдістері .
Есептеу әдістерінің бірінші тобында Шредингер тендеуін жуықтап шешу үшін ешбір экспериментальдық мәліметтер қолданылмайды. Бұл топ әдістерінің аз атомды жүйелерді қарастыруға ғана мүмкіншіліктері бар. Сонымен бірге өте ұзақ уақыт есептеуді қажет етеді. Көп жағдайда эмпирикалық емес әдістермен алынған нәтижелер эксперименттік материалдармен сәйкес келмеуі де мүмкін. Қазіргі кезеңде есептеу әдістерінің бұл тобы даму сатысында, сондықтан болашақта бұл бағытта көп жетістіктер күтуге болады.
Есептеу әдістерінің екінші тобы яғни жартылай эмпирикалық әдістерінде есептеулерді жеңілдету үшін шамалары өте аз болғандықтан кейбір интегралдарды елемей кетеді, ал кейбір мүшелерді экспериментальдық мәліметтермен (атомның иондау энергиясы, электрон тартқыштығы) ауыстырылады. Сонда есептеулер әлдеқайда жеңілденеді.
Химия салаларында есептеудің осы әдістері көптеп қолданылады. Біз бұл жұмысымызда есептеу әдістерінің мүмкіншіліктеріне шолулар жасап, талдаулар жүргізіп, олар қолданылған жұмыстарды қарастырып, кванттық химия есептеу әдістерінің мүмкіншіліктеріне шолулар жүргіземіз.
Квантты химия есептеу әдістерінің теориялық негіздерімен, жуықтау және параметрлеу әдістерімен көптеген арнаулы әдебиеттерден және монографиялардан танысуға болады [1-7, 9] .
Квантты химияның есептеу мүмкіншілігі молекулалық орбитальдар әдісіне немесе валентті байланыс әдісіне негізделген. Молекулалық орбиталь
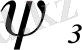 ядролар мен қалған электрондар туғызатын бір эффективті өрісте электронның қозғалысын сипаттайтын бірэлектронды толқындық функциямен анықталады. Молекулалық орбитальды молекуланы құрайтын атомдардың атомдық орбитальдарының сызықтық комбинациясы ретінде қарастыруға толық негіздеме бар:
ядролар мен қалған электрондар туғызатын бір эффективті өрісте электронның қозғалысын сипаттайтын бірэлектронды толқындық функциямен анықталады. Молекулалық орбитальды молекуланы құрайтын атомдардың атомдық орбитальдарының сызықтық комбинациясы ретінде қарастыруға толық негіздеме бар:
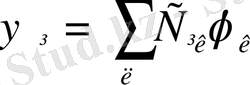
Молекулалық орбитальдар атомдық орбитальдардың сызықтық комбинациясы (МО АОСК) әдісі қазіргі кезенде кең қолданылады. Молекулалық жүйені сипаттайтын көп электронды толқындық функция
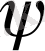 бір электрондық толқындық функциялардың антисимметрияланған көбейтіндісі түрінде келтіріледі. Ол жабық электронды қабатты жүйелер үшін Слейтер детерминанты (анықтауышы) түрінде келтіріледі. Шектелген Хартри-Фок әдісі осыған негізделген.
бір электрондық толқындық функциялардың антисимметрияланған көбейтіндісі түрінде келтіріледі. Ол жабық электронды қабатты жүйелер үшін Слейтер детерминанты (анықтауышы) түрінде келтіріледі. Шектелген Хартри-Фок әдісі осыған негізделген.
Хартри-Фок әдісінің негізгі кемшілігі электрондардың кулондық корреляциясын есепке алмайды. Бұл кемшілік конфигурациялық өзара әрекеттесу (КӨӘ) әдісінде есепке алынады [6, 7] .
Квантты химиялық есептеу әдістерін дұрыс қолдана білген жағдайда олардың химиялық мәселелерді шешуде беретін мүмкіншіліктері мол екендігі тағайындалған.
Жартылай эмпирикалық квантты химиялық есептеу әдістерін пайдаланып зерттелетін жүйе үшін келесі шамаларды анықгауға болады:
І. Молекуланың толқындық функциялар жиынын және меншікті мәндерін аламыз.
2. Атомдардағы зарядтар немеее электрон тығыздығы.
З. Молекуланың геометриясын (байланыс ұзындықгары, байланыс аралық бұрыштар) .
4. Егер полярлы молекула болса, онда оның дипольдық моментін анықтауға болады.
5. Квантты химиялық есептеулердің ең бір артықшылығы реакциялардың кезінде түзілетін аралық өнімдердің, аралық комплекстердің электрондық құрылыстарын есептеп, олардың сипаттамаларын анықтауға мүмкіншілік береді.
б. Квантты химия әдістері реакция механизмін тағайындауға мүмкіншіліктер жасайды.
7. Адсорбциялық комплекстердің электрондық құрылысын зерттеуге, адсорбцияның табиғатын тағайындауға мүмкіншілігі бар.
Химия үшін маңызды болып, ЖТМО және ТБМО энергиялары мен олардың атомдық құрылысы болып табылады. ЖТМО энергиясы (қарама-қарсы таңбамен) молекуланың иондау энергиясын береді. ТБМО энергиясының мәні молекуланың электрон тартқыштығымен салыстырылады [8-11] .
2. 1 - кестеде полярлы молекулалардың дипольдық моментінің шамалары жартылай эмпирикалық ППДП/2, эмпирикалық емес (ab initio) әдістермен есептелген нәтижелері олардың экспериментальдық нәтижелерімен салыстырылған.
2. 1 - кесте. Молекулалардың дипольдық мометтері, D
2. 2 - кесте. Молекулалардың экспериментальдық және ППДП/2 әдісімен есептелген геометриясы нәтижелерін салыстыру
2. 2 - кестеде кейбір молекулалардың геометриясының (байланыс ұзындықтары және байланыс аралық бұрыштар) есептелген нәтижелері және олардың экспериментальдық мәліметтері өзара салыстырылған.
Есептеу әдістерімен алынған нәтижелердің экспериментальдық мәліметтермен жақсы сәйкестігі зерттеу жұмыстарына квантты химиялық есептеу әдістерін алуға толық негіздеме болады.
2. 2. Жартылай эмпирикалық МПДП (MNDO) әдісі
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz