Пептидтер: құрылымы, синтезі және биологиялық белсенділігі


Мазмұны:
Кіріспе
1. Негізгі бөлім
1. 1 Пептидтік байланыстар
1. 2 Пептидтердің химиялық синтезі
1. 3 Олигопептидтер
1. 4 Полипептидтер тізбегінің құрылысы
1. 5 Биологиялық активті пептидтер
Қорытынды
Пайдаланған әдебиеттер тізімі
Кіріспе
Пептидтер (гр. πεπτος - құнарлы) - амин қышқылдарының қалдықтарынан тұратын органикалық заттар. Амин қышқыл қалдықтарының санына қарай ди-, три-, тетра пептидтерге, олигопептидтерге және полипептидтерге бөлінеді. Пептидтер молекулалары әдетте бір шетінде аминтобы, бір шетінде карбоксил тобы бар ұзын тізбек. Кейде олар тұйық түрде де кездеседі -циклопептидтер (көпшілік токсиндер, гормондар, антибиотиктер) . Пептидтер биологиялық қасиеттері бар заттардың көбісі жатады. Тірі торшада олар амин қышқылдарынан түзіледі немесе белоктардың ферментті ыдырауынан туады. Пептидтер ең алғаш ақуыз гидролизатынан, фермент ация арқылы алынған болатын.
Пептид деген терминді 1905 жылы пептидтерді синтездеудің жалпы әдісін ойлап тапқан Эмиль Герман Фишермен ұсынылған болатын.
1953 жылы Дю Виньо окситоцинді синтездеп алды, ол ең алғашқы полипептидті гормон.
1963 жылы қатты фазалы пептидті синтездің (Р. Меррифилд) негізгі концепциясы арқасында пептидтің автоматты синтезаторлары құрастырылды. Полипептид синтезі әдісін қолдану арқылы синтетикалық инсулин мен кейбір ферменттерді алуға жол ашты.
Қазіргі таңда 1500-ден астам пептидтер белгілі, олардың қасиеттері мен синтездеу әдісі де қалыптасқан.
Пептидтік байланыстар
Амин қышқылдардың поликоңденсациялануы нәтижесінде пептидтер түзіледі.
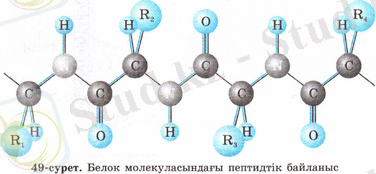
Пептидтер - дегеніміз полимерлі қосылыстар, кұрылым бірлігі ретінде амин қышқылдар қалдықтары алынады.
H 2 N-CH-CO-NH-CH-CO-NH-CH-CO-NH-CH-CO-NH-CH-CO- . . .
│ │ │ │ │
R 1 R 2 R 3 R 4 R 5
Полипептид
Бұлардың бүйір радикалдары әр түрлі, ал пептидтік байланыс универсалды. Екі амин қышқылы қосылатын болса, онда дипептид түзіледі, үш амин қосылатын болса - трипептид түзіледі. Осылайша көптеген амин қышқылдары қосылуынан полипептид пайда болады. Амин қышқылдары қалдықтарының арасында байланыс:
- С - N -
׀ ׀׀
O H
түзіледі, бұл пептидтік байланыс деп аталады.
Табиғи белок полипептид болып саналады, ол бірнеше жүздеген амин қышқылдары буындарынан тұрады. Полипептидтер кейбір қасиеттері бойынша белоктарға жақындайды, бірақ белоктардың қасиетін толық қайталамайды, мысалы, полипептидтер шөгіп тұнбаға түспейді және денатурация құбылысына ұшырамайды, себебі полипептидтерде кеңістік құрылым болмайды.
Пептидті байланысты түзуге тек α - амино-және α -карбоксилді топтар катысады, пептидтер тармақталмаған.
Полипептидтің қаңқасы (хребеті) үнемі қайталанып отыратын кұрылымдық элементтерден тұрады.
- NH - CH - CO -
│
R
Пептидті тізбекте олар ретпен орналаскан N- соңы мен С- соңына байланысты, пептидтер векторлы болып келеді. N-соңында бос амин тобы, ал, С-соңында бос карбоксил тобы орналасқан. Тізбек N - соңынан → С - соңына қарай бағытталған.
Поликонденсация коэффициенті пептид құрамына кіретін амин қышқыл калдықтарының санын көрсетеді. К=2 (олигопептидтер) 1-ден 20-ға дейін (ди, три, тетра), 20-50 дейін (полипептидтер) . Пептидтердің мол массалары 200-ден 6000 диапазонда, орташа массасы 110.
1888 ж орыс ғалымы - биохимик А. Я. Данилевский өз тәжірибелері бойынша белок молекуласындағы амин қышқыл қалдықтарының арасында пептид байланысының болуы туралы болжам айтты. Кейінірек, ХХ ғасырдың басында неміс ғалымы Э. Фишер пептид байланысының болуын тәжірибе жүзінде дәлелдеді. Ол 19 амин қышқылдарының қалдығынан тұратын полипептидті синтездеп алды.
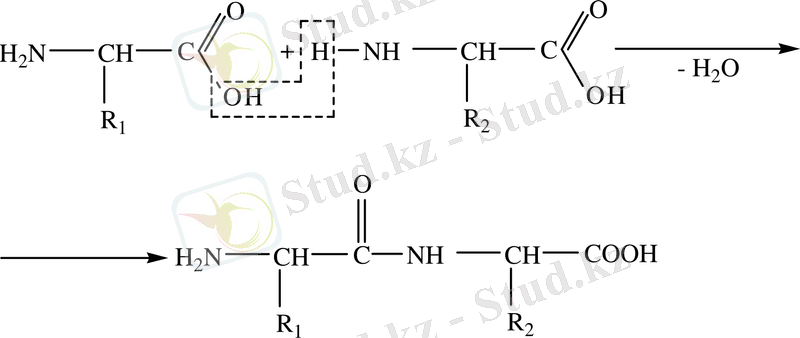
Белоктар - бұл α - амин қышқылдарынан түзілген күрделі үлкен молекулалы табиғи қосылыстар. Казіргі түсініктер бойынша: белоктарда α - амин қышқылдары өзара пептидті (амидті байланыстар - NH - CO -) арқылы пептид тізбектеріне біріккен. Бір амин қышқылының карбоксилімен келесі амин қышқылының амин тобымен әрекеттесуі нәтижесінде пептидті байланыстар түзіледі. Мұнда екі α-амин қышқылынан бір су молекуласы бөлініп пептидтер түзіледі:
O O
H 2 N CH 2 C + NH CH C
OH H OH
CH 3
глицин
O
O
H 2 N CH 2 C NH CH C + H 2 O
OH
C 3 H
дипептид (глицил - аланин)
Түзілген дипептид молекуласының шеттерінде әрбір амин қышқылынан функциональдык топтар - карбоксил және аминтоп қалып қояды. Сондықтан дипептид өзінің бір шетімен үшінші амин қышұылымен әрекеттесіп трипептид түзеді. Осылайша төрт аминқышқылынан тетрапептид, ал көп амин қышқылынан - полипептидтер пайда болады.
Пептидтік байланыс өзінің химиялық табиғаты бойынша ковалентті болып табылады және ақуыз молекуласының І-реттік құрылымына өте жоғары дәрежелі беріктік береді.
Ақуыз молекуласының құрылысының полипептидтік теориясын 1902-1919 жылдары Э. Фишер тәжірибе жасап қалыптастырды.
Пептидтердің аталуы оның құрамына кіретін аминқышқылдар атауларына байланысты болады, мысалы: глицин және аланин аминқышқылдарынан құрылған дипептидті-глицил-аланин; глицин, аланин және лизин аминқышқылдарынан түратын трипептидті -глицил-аланил-лизин деп атайды.
Пептидтік теория ақуыздардың көптеген физикалық-химиялық және биологиялық қасиеттерін дұрыс түсіндіруге мүмкіндік берді. Сонымен қатар, ол қалайша физикалық-химиялық касиеттері, атқаратын қызметтері түрліше болып келетін ақуыздардың табиғатта сан алуан формаларының кездесетінін де дәлелдеді. Мысалы, 2 аминқышқыддар-глицин және аланин, екі түрлі дипептид пайда ете алады: глицил-аланин және аланил-глицин. Оларды изомерлер деп атайды. Аминқышқылдар бірізділігінің түрліше болуына байланысты изомерлердің физикалық-химиялық қасиеттері, қызметгері де әртүрлі болады.
Бірізділік тізбегінде түрліше комбинациялануы салдарынан 3 аминқышқылынан (глицин, аланин, лизин) 6 түрлі трипептид түзіледі:
1) глицил-аланил-лизин; 2) глицил-лизил-аланин; 3) аланил-глицил-лизин; 4) аланил-лизил-глицин; 5) лизил-аланил-глицин; 6) лизил-глицил-аланин.
Ақуыз молекуласында 20 аминқышқылдардың болатындығын ескерсек, онда орлардың түрліше комбинациялануы нәтижесінде, қасиеттері әртүрлі болып келетін қаншама изомерлердің түзілетінін есептеу қиын емес (20") .
Тізбек ұзындығына қарай табиғаттағы барлық ақуыздық заттарды пептидтер (олигопептидтер) (2-10 аминқышқылдарынан құрылған), полипептидтер (10-40 аминқышқылдарынан түрады) және акуыздар (40 тан көп аминқышқылдардан түрады) деп бөледі. Мысалы, ішек бактериясында 3000 әртүрлі акуыздар кездессе, адам ағзасында 5 милиионға жуық ақуыздар табылған. Сонымен бірге, ішек бактериясының бірде-бір ақуызы адам ақуыздарына ұқсамайды.
Пептидтік тізбектің көптеген фрагменттері алғашқа ширатпа не құрылым күйінде болады. Ақуыз молекуласының кеңістікте мұндай қарапайым жинақталуын II реттік құрылым деп атайды.
Глобулалы ақуыз молекуласында әртүрлі екінші реттік құрылымдар және құрылымсыз (яғни екінші реттік құрылымдары болмайтын) учаскелер кездесуі мүмкін. Мысалы, миозин, тропомиозин, а-керотин тек а-ширатпадан, фиброин, R -кератин-тек р кұрылымнан тұрады.
-a-Ширатпада-полипептид тізбегінің қаңкасы ширатылып, аминқышқылдардың радикалдары сыртқа қарай бағытталған болады Бұл құрылым аминқышқылдар арасындағы сутектік байланыс арқылы түрақтанады.
Аминқышқылдарының бүйір радикадары бұл құрылымдардың тұрақтануына тікелей қатынаспағанымен, олар полипептид тізбегінің қалайша оралуын және ол орала ала ма, жоқ па осы мәселелерді анықтайды.
Ақуыз молекуласының үшінші реттік (глобулалық) құрылымы дегеніміз-полипептид тізбегінің а-ширатпасының, құрылымының және құрылымсыз учаскелерінің кеңістікте глобула (шумақ) конформациясына жинақталып, табиғи (нативті) құрылымының түзілуі. Бұл үдерісті фолдинг деп атайды.
Ақуыздың екінші реттік құрылымынан ерекше, үшінші реттік құрылымы аминқышқылдардың радикалдары арасыңдағы байланыстар негізінде пайда болады және тұрақтанады. Бұл байланыстардың нақтылы түрлері радикалдар ерекшеліктеріне тікелей байланысты болады.
Үшінші реттік құрылымы қалыптасқаннан кейін ақуыз молекуласы өзіне тән қызметтік белсенділікке ие болады. Осы құрылымда ақуыз молекуласыңда белгілі бір лигандалармен әрекеттесуге қабілетгі, бірнеше радикалдар тобынан түратын, белсенді орталықтар пайда болады. Бүұ радикалдар полипептид тізбегінде (І-ретгік құрылымда) бір-бірінен қашық орналасады, ал олардың жақындасуы фолдинг үдерісінде жүзеге асады.
Кейбір ақуыздардың IV реттік құрылымы да белгілі, мысалы гемоглобин. Оның молекуласы 4 субъединицалардан (екі, 2 тізбектерден) құрылған.
Пептидтердің химиялық синтезі
Пептидтерді химиялық жолмен ең алғаш синтездеп алған Э. Фишер болатын. Э. Фишер алған пептид 18 амин қышқылы қалдығынан тұрады. Бұл жаңалық жиырмасыншы ғасырда ғылымдағы белок жөніндегі қол жеткен аса үздік табыс еді. Бұдан кейін құрамы 19 амин қышқылы қалдығынан тұратын пептидтер (оны тапқан Фишердің шəкірті Абдерхальден) жəне құрамы 20 амин қышқылы қалдығынан тұратын пептидтер (Бергман) синтездеді. Бұл ғалымдардың белокты синтездеп алуға қатысты əдістерінің, тиімділігі онша үлкен емес. 1960 жылдар шамасында Меррифельд белок синтездеудің болашағы зор əдісін жəне өте ұзын пептидтерді синтездеу əдісін тапты.
Инсулин химиялық жолмен осы əдіс бойынша синтезделіп алынды. Ол химиялық жолмен (пробиркада) алынған алғашқы белок болатын. Бұл жаңа əдістің негізін қалауға себеп болған идея мынадай: белок синтезі оның, қатты фазада тұрған кезінде жүзеге асырылады, соның нəтижесіңде синтездің əр кезеңінен аралық өнім бөлінбейді жəне полипептидтік тібектің ұзаруымен мүмкіндік береді. Мұндай синтез кезінде қорғалған амин тобы бар бірінші амин қышқылы қатты ұстауыш (носитель) полистиролдық смоланың ион алмастырушының С1СН2- тобымен қосылып якоръ байлаушысы дегенді түзеді. Осыдан кейін смола арқылы амин қышқылдарын ерітіндімен өткізе отырып, пептид тізбектерін ұлғайта түседі. Синтездің соңында жинақталған қажетсіз топтарды бөліп шығарады да, пептидті қатты ұстауыштан (носительден) ажыратады. Дисульфид байланысының қалыптасуын химиялық жолмен жүзеге асырады. Молекулалық массасы біршама үлкен пептидтерді синтездеуде бұл автоматтандырылған тəсілдің маңызы зор.
Олигопептидтер
Олигопептидтер - бірнеше амин қышқылдарынан тұратын кішігірім полипептидтер. Олардың құрамына кіретін аминқышқылдардың санына байланысты мысалы :дипептид, трипептид, пентапептид және т. б.
Кейбір антибиотиктер мен гормондар олигопептидтер болып табылады.
Медициналық әсер бойынша олигопептидтер физиологиялық регулятор және организмнің активатор қызметін атқарады. Бұл компоненттер құрамына байланысты (сирек кездесетін аминқышқылдар жиынтығынан) адамның барлық ішкі жүйесін реттеуге қабілетті.
Адамда сырткы жане ішкі шарттарға жылдам бейімделуіне жауап беретін реттеуші жүйе бар. Мысалы физикалық жұмыс ауырлығы үдеген кезде мынандай командалар беріледі: тыныс алуының жиілеуі, өкпе жұмысының күшеюі, қантамырлардың кеңеюі-бұл дене енбегімен әрі қарай айналысуға көмектеседі, организмның барлық клеткаларын тепе-теңдікте керек заттармен камтамасыз етіп дененің кызып кетуінен сақтайды.
Кәрілікке қарсы эксклюзивті дәрілерді олипептидтер деп атайды. Олар жасуша жұмысын бакылайды бірақ олар қорек көзі болып табылмайды. Олигопептидтер - бұл табиғи амин кышкылдарының байланысы, химия және ГМО азық-түліктері косылмаған. Бұл заттар, организмнин өзі шығаратындықтан, дәл сондықтан олигопептидтердің кері әсері және қарсы көрсетілімдері жоқ
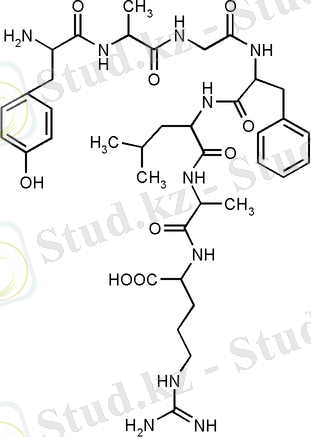
Полипептид тізбегінің құрылысы
Полипептидтер дегеніміз - амин қышқылдарынан түзілген қосылыстар. Екі амин қышқылы өзара бірімен-бірі əрекеттескен кезде суды бөліп шығарады да, дипептид түзеді:
I
CH-
II
C-OH + H-NH-
I
CH-
II
C-OH ®
I
CH-
II
C-NH-
I
CH-
II
C-OH + H2O
Ақуыздардың құрылысы өте күрделі. Ақуыз молекуласы құрылымын: бірінші реттік, екінші реттік, үшінші реттік және төртінші реттік деп бөліп қарастырады.
Полипептидтік тізбектегі аминқышқылдары қалдықтарының қатаң тәртіппен бірінен кейін бірінің орналасуын бірініші реттік құрылым анықтайды. Ақуызды құрайтын жүздеген, мыңдаған, миллиондаған а-аминқышқылдарының қалдықтары өзара пептидтік байланыс (- CO - NH -) арқылы жалғасады.
Полипептид тізбегіндегі аминқышқылының бір қалдығының басқасымен ауысуы немесе оның орнының алмасуы осы ақуыздың қызметін бұзады. Мысалы, адам гемоглобиніндегі 564 аминқышқылдары қалдықтарынан құралған полипептид тізбегіндегі бір қышқылдың қалдығы екіншісіне ауысса, адам ауыр сырқатқа ұшырайды.
Табиғатта ақуыздардың кейбіреуі тек созылыңқы полипептидтік тізбекте болады. Мысалы, табиғи жібек талшығы - фибрионның құрылымы осындай.
Ақуыздардың көбінің кеңістікте спираль тәрізді оратылуы екінші реттік құрылым деп аталады. Бұл құрылым, негізінен, спираль оралымдарында орналасқан - CO . . . HN- арасындағы сутектік байланыстар арқылы іске асады. Шиыршықтың бір орамында 3 және 5 аминқышқылдарының қалдықтары болады. Оралымдардың арақашықтықтары 0, 54 нм шамасында.
Ақуыздық оралма тектес молекуласы биологиялық процестердің әсерінен, молекула арасындағы сутектік байланыс, -S-S- дисульфид көпіршесі, күрделі эфирлік көпірше және бүйір тізбектегі анион мен катиондар арасындағы иондық байланыстар арқылы өзара байланысады да, өте күрделі үшінші реттік құрылым түзіледі. Бұл кезде оралма құндақталып, шумаққа айналады (52-сурет) . Үшінші реттік құрылым ақуыздың өзіне тән қасиеттері мен белсенділігіне жауап береді.
Ақуыз молекуласы тек қана бір полипептидік тізбектен тұрса, оның құрылымдары бірінші, екінші және үшінші реттік болады. Ал ақуыз молекуласы екі және одан да көп полипепидік тізбектен құралса, онда төртінші реттік құрылым түзіледі. Төртінші реттік құрылым - кейбір ақуыздарда бірнеше полипептидтік тізбектердің бір-бірімен күрделі кешенді комплекстерге бірігуі. Мысалы, гемоглобин құрамына 141 аминқышқылының қалдығы кіретін төрт полипетидтік тізбектен және құрамында темір атомы бар ақуызды емес бөлшек гемнен комплекс түзеді. Гемоглобин тек осы құрылымда ғана оттекті тасымалдай алады.
Нәруыздардың күрделілігіне қарай 4 реттік құрылымы болады: бірінші реттік, екінші реттік, үшінші реттік және төртінші реттік құрылымдар.
1. Амин қышқылдары, бір амин қышқылының СООН тобының және екінші амин қышқылының NH 2 тобының есебінен су молекуласын бөліп шығарып, пептидтік байланыс арқылы өзара байланысып, пептид түзеді.
дипептид
Пептидтік байланыстың бар екендігін биурет реакциясы арқылы дәлелдеуге болады.
(CuSO 4 + NaOH + белок) күлгін көк түсті ерітінді. Пептидтік байланыс арқылы бірнеше амин қышқылдары бірімен-бірі байланысып трипептид, тетра-, пента-, . . . полипептид түзеді. Белоктың полипептид тізбегі жалпы түрде:
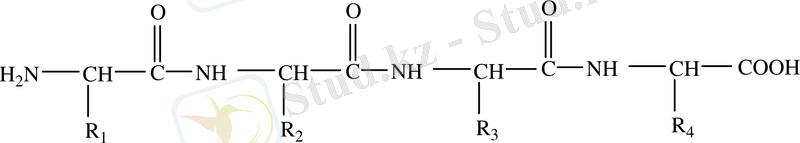
деп көрсетуге болады.
Сонымен белок дегеніміз өзара пептидтік байланыспен байланысқан L-, α- амин қышқылдарынан тұратынан полимер.
Егер дипептидке үшінші амин қышқылы қосылатын болса, онда трипептид түзіледі. Осылайша көптеген амин қышқылдары қосылуынан полипептид пайда болады. Полипептидтегі амин қышқылы қалдықтары арасында мынадай байланыс
O
II
-C-
H
I
N-
түзіледі, ол байланыс пептидтік байланыс деп аталады. Пептид байланысы дегеніміз - амин қышқылдарының бір қалдығындағы >С=0 тобы мен екінші қалдығындағы >N-Н
O
II
-C-
H
I
N-
Екі электроннан құралған коваленттік байланыс тобы арасындағы өзара коваленттік байланыс, оның ұзындығы 0, 132 нм. Екі электроннан түзілген коваленттік байланысқа бір электрон карбонил >С=0 тобындағы көміртегінен, екінші электрон имин >N-Н тобындағы азоттан келеді.
Пептидтердің атауы амин қышқылдары атауынан шығады. Өзінің карбоксил тобымен реакцияласқан амин қышқылына - ш жалғауы қосылады, ал карбоксил тобы бос күйінде қалатын сонғы амин қышқылы, өзінің бұрынғы атауын сақтап қалады. Мысалы, жоғарыда келтірілген дипептид аланилтреонин деп аталады. Полипептидтерді кейде қарапайым түрде пептидтер деп атайды. Олардың құрылымы тізбектелген болады, сөйтіп полипептид тізбегін түзеді. Шындығында, полипептидтер - амин қышқылдарынан құралған полимерлер. Полипептидтердің құрамында жоғарыда аталған жиырма амин қышқылының кез-келгені болуы жəне олар кез-келген ретпен жалғасып байланысуы мүмкін. Соңдықтан полипептидтердің саны орасан көп. Мысалы, əр түрлі 10 амин қышқылынан ғана 109 (1 млрд) алуан түрлі полипептидтер алуға болады.
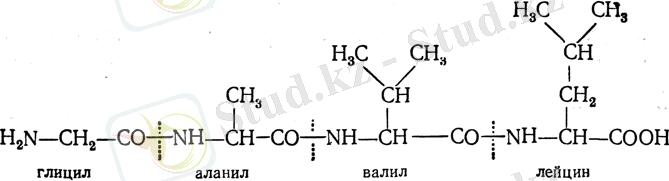
Полипептидтер өздерінің қасиеттері бойынша белоктарға жақындайды. Бірақ оларда белоктың өзіне ғана тəн қасиет болмайды, кеңістіктік құрылым кездеспейді осының салдарынан денатурация құбылысына ұшырамайды жəне шөгіп тұнбаға түсе алмайды. 1. 1- cуретте 9 аминді қышкылдарынан құралған полипептидтік тізбектің химиялық формуласы жөне кеңістіктік пішіні көрсетілген. Белок молекуласын түзетін полипептидтер арасындағы байланыстар Егер белок молекуласы бірнеше полипептидтік тізбектен құралған болса, олардың арасындағы байланыс түрлері мына төмендегідей болуы мүмкін.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz