Өсімдіктердегі су алмасуының физиологиясы: судың молекулалық құрылысы, қасиеттері және клеткадағы осмос


ӨСІМДІКТЕГІ СУ АЛМАСУ ФИЗИОЛОГИЯСЫ
2. 1. Судың өсімдік тіршілігіндегі маңызы
Өсімдіктер денесінің басым көпшілігі (70-85%) судан тұрады. Өзінің өте ғажайып қасиеттеріне байланысты су барлық тіршілік әрекеттерінде негізгі орын алады.
Тұтас организмдегі судың маңызы орасан зор және алуан түрлі деуге болады. Тіршіліктің ең алғашқы түрлері сулы ортада пайда болған, кейін осы орта организмдер клеткаларыңда тұйықталған күйге айналады. Жер бетіндегі белгілі тірі организмдердің барлық түрлері сусыз тіршілік ете алмайтындығы кімге болса да түсінікті.
Қазіргі кездегі ғылыми мәліметтерге сүйене отырып, барлық био-логиялық жүйелердегі судың маңызын төмендегіше бейнелеуге болады. Сулы орта организмдердің клеткадағы молекулалардан бастап ұлпа және мүшелерге дейінгі бөліктерін біртұтас жүйеге біріктіреді. Өсімдіктер денесіндегі су топырақтан енетін ылғалдан бастап жапырақтың ауамен шектесетін бетіне дейінгі аралықты түтастыратын орта болып есептеледі.
Су ең жақсы, күшті еріткіш және тіршілік әрекеттеріне байла-нысты биохимиялық реакциялар жүзеге асатын негізгі орта болып есептеледі.
Су клеткадағы қүрылымдық бөліктерді қалыптастыруға қатыса-ды. Белок молекулаларындағы су олардың күрылысын анықтайды. Егер белоктың қүрамындағы суды түрлі әдістермен бөліп алса, ол үйып (коагуляцияланып) түнбаға айналған болар еді.
Су биохимиялық процестердің тікелей сыңары. Ол фотосинтез процесінде электрондар доноры болса, тыныс алуда тотыгу - то-тықсыздану реакцияларына қатысады. Су көптеген заттардың ыды-рау және синтезделу процестеріне қажет.
Су жоғары сатыдағы өсімдіктердегі ксилема және флоэмадағы симпласт пен апопласт арқылы заттардың таралуын жүзеге асыра-тьщ тасымалдау жүйесінің негізгі мүшесі болып есептеледі.
Жылу сиымдылығының және меншікті булану жылылығының өте жоғарылығына байланысты су ұлпалар температурасының күрт өзгеруінен сақтайды.
Су жақсы амортизатор ретінде организмдерді механикалық әсер-лерден қорғайды.
Осмос және тургор қысылымдарына байланысты су өсімдік клет-каларының, ұлпаларының және мүшелерінің серпімділік күйін қам-тамасыз етеді.
Үдемелі эволюция барысында өсімдік организмінде судан салыс-тырмалы тәуелсіздік қалыптасты. Балдырлар үшін су өліге дейін негізгі тіршілік ортасы болып қалды. Жер бетіндегі споралы өсімдіктерде көбею кезеңінде судан тәуелділік сақталды. Тозаңдану арқылы жыныстық жолмен кобейетін өсімдіктер бүл процеске суды қажет етпейді. Олардың тіршілік әрекеттеріне қажетті суды қабыл-дап және үнемді шығындайтын тетіктері күрделеніп, жетіліп келеді.
2. 2. Судың молекулалық құрылысы мен қасиеттері
Табиғаттағы су - газ (бу), сүйық және қатты (мүз) күйде болуы мүмкін. Судың осы күйлердегі құрылысы біркелкі болмайды. Ішіндегі заттардың құрамына байланысты суда жаңа қасиеттер пайда болады. Судың қатты күйінің өзі кем дегенде екі түрлі болады. Оларды кристалды мұз және кристалсыз шыны тәріздес аморфты (пішінсіз) деп бөледі. Мысалы, суды сұйық азоттың көмегімен тез мұздатқанда молекулалары кристалдық тор түзуге үлгермей, қатты шыны тәріздес күйге айналады. Судың бұл қасиеті организмдерді - бір клеткалы балдырларды, мүк жапырақшаларын тез мұздатуға мүмкіндік береді.
Судың физикалық қасиеттеріне оның тығыздығы, қайнау және қату нүктелері (температурасы), балқу жылылығы, жылу сиымдылығы, беттік кернеуі және жұғу қабілеті жатады.
Барлық заттар қыздырғанда көлемін ұлғайтып, тығыздығын кемітеді. Судың ең жоғарғы тығыздығы 4 градустық температурада байқалады. Осы температурадағы 1 см 3 судың салмағы 1 г-ға тең болады. Мұздағанда судың көлемі ұлғайып, ерігінде күрт азаяды.
Температура 100°С-ға дейін көтерілгенде судың тығыздығы 4 %- ке кемиді.
Қысым 0, 1013 МПа-ға (1 атм) тең болған жағдайда су 0°С-да қатып, 100°С-да қайнайды. Судың бұл қасиеті химиялық құрамы жағынан өзіне жақын қосындылардан ерекше екендігін көрсетеді. Бұл айтылғанды мынандай салыстырумен бейнелеуге болады: СН 4 , NН, Н 2 О, НҒ, Ие Бұл қатардағы әр молекуланың 10 протоны және 10 электроны бар, метаннан неонга дейін сутек атомдар саны біртіндеп кемиді. Осы заттардың балқу температурасы тиісінше - 161, -33, 100, -19, -246° С.
Мұздың балқығандағы жасырын жылылығы өте жоғары - 335 Дж/г шамасында болады. Судың буға айналғандағы жасырын жылылығы (2, 3 КДж/г) балқудағы жылылығынан 7 есеге жақын артық.
Судың жылу сиымдылығы (температурасын 1°С-ға көтеру үшін жұмсалатын жылылық) басқа заттарға қарағанда 5-30 есе жоғары. Судың 16°С температурадағы сыбағалы жылу сиымдылығы басқа заттармен салыстыру үшін пайдаланатын өлшем болып есептеледі.
Судың бұл қасиеттері өсімдік денесінің ішкі температурасының бірқалыпты сақталуына әсер етеді.
Балқу және қайнау температурасының, жылу сиымдылығының өте жоғарылығы су молекулаларының өзара тартылу күшінің мықтылығын, соған байланысты сұйық судың ішкі ілінісу күші де жоғары екендігін дәлелдейді.
Су деңгейінде, молекулалардың өзара ілінісуі толық болмағандықтан, беттік кернеу пайда болады. Су гравитациялық күштерге қарсы көтерілгенде оның жұққыштық қасиеті байқалды. Қылтүтіктердің ауамен шектесетін қабаттағы су молекулаларының ілінісу күші қылтүтіктер қабырғасында жұғу күшімен бірігеді. Осының нәтижесінде қылтүтіктегі судың деңгейі ойықтау болып келеді.
2. 2. 1. Судың молекулалық қүрылымы
Су молекуласында сутек пен оттек ядроларына ортақ екі жұп электрондар бар. Оттегі теріс зарядты болғандықтан оң зарядталған.
Құрамындағы аттас емес зарядтардың кеңістікте алшақ орналасуы су молекуласының дипольдығын (полярлығын) бейнелейді. Оттегі ядросы мен сутегі атомының жеке ядроларының аралығындағы қашықтық шамамен 0, 099 нм, олардың байланысу аралығындағы бұрыш шамамен 105° тең.
Су молекуласында оттегі атомының айналасыңдағы электрондар тэтраэдрлік құрылым жасап орналасқан. Осы молекула басқа төрт молекуламен электростатикалық өрекеттесу арқылы байланыса алады. Бұл әлсіз сутекті байланысты ажырататын энергияның мөлшері шамамен 18, 84 кДж/мольге тең. (Судағы коваленттік Н-0 байланыс энергиясы 460, 4 кДж/моль) .
Су молекуласывдағы электрондар оттегі атомымен мықтырақ бай-ланысқандықтан протондар бөлінеді. Нәтижесінде су молекуласы сутек (Н + ) және гидроксил (ОН~) иондарына диссоциацияланады. Бірақ, бос сутек ион тұрақты дербес бола алмайды. Ілезде су молекуласымен гидраттанып гидроксонит ионға айналады: Н + Н 2 О = Н 3 О. Жалпы реакция нәтижесінде судың бір молекуласындағы протон екінші молекулаға ауысып гидроксонит және гидроксил пайда болады:
Н 2 О + Н 2 О = Н 3 О + + ОН".
Айтуға ыңғайлы болу үшін гидроксонит (Н 3 О ) әдетте Н деп бейнеленеді.
Сұйық судың құрылысын мұздың құрылысымен салыстырғанда мынандай айырмашылықтарды байқауға болады. Қалыпты қысым жағдайыңда пайда болған мүздың құрылысында әрбір жеке молекуласы тэтраэдрлік басқа төрт молекуламен қоршалған. Осы құрылымының ортасындағы су молекуласы төрт сутектік байланыс арқылы тэтраэдр төбесіндегі су молекуласымен байланысады. Түгел алғанда мұздың гексагональды кристалдык, құрылысы пайда болады.
Мұз құрамындағы оттегі атомдарының ара қашықтығы шамамен 0, 276 нм-ге тең. Мұз балқығанда бұл қашықтық ұлғаяды. Сонымен бірге сутектік байланыстардың шамамен 15 %-і ғана ыдырайды. Сұйық судьщ молекулалық құрылысы туралы болжамдарды екі топқа бөлуге болады. Бірінші топтағылардың ұйғаруынша (Самойлов) сүйық судың құрылысы мұзға ұқсас, оның бос қуыстарында судың мономерлік молекулалары орналасқан. Судың мұз тәріздес қаңқасы молекулалардың жылулық қозғалуымен және қуыстар көлемінен ірірек иондардың өсерінен (К + , КЬ + , Сз + ) бұзылып, А1 3+ , Іл' + , ОН, S О 4 2 ~ иоңцары судың біркелкі құрылысын бекітеді.
Екінші топтағы болжамдар бойынша су мұз тәріздес құрылымдар мен мономерлік молекулалардың тепе-тең мөлшерлерінің қоспасы деп ұйғарылады (2. 3-сурет) .
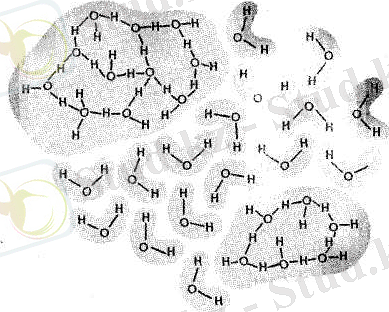
2. 3-сурет. Сұйық судың кластерлік құрылысының желісі (В. В. Полевой, 1989) .
Сұйық судың ішінде сутектік байланыстардың қатысуымен пайда болған тұтас бөліктер (кластерлер, топтар) сутектік байланыстары жоқ, немесе өте аз аймақтармен кезектесіп араласқан сияқты болады. Бұл екі болжамдардың арасында айтарлықтай айырмашылық жоқ сияқты. Оларды біріктіретін ұғымдарға мыналар жатады: екі түрлі құрылымның молекулалары ретгеліп жайғасқан (мұз төріздес құрылымдар, кластерлер) және сутектік байланыстары өте аз, ретсіз араласқан молекулалар аймағының болуы; су құрылысында молекулалардың жылулық қозғалысының бүлдіргі әсер ететіндігі.
2. 2. 2. Судың ерітінділердегі күйі
Судың молекулалық құрылысының тағы бір ерекшелігіне оның өте жоғары диэлектрлік өткізгіштігі жатады. Сұйықтықта байкалатын электрлік әсерлерді мынадай мысалмен сипаттауға болады. Зарядтары (С^ және (2 2 ) бар және белгілі ара қашықта г орналасқан бөліктердің арасындағы зарядтардың әрекеттесуінен пайда болатын электрлік күш Кулон заңы бойынша анықталады:
Электрлік күші =

Мұндағы, Е - пропорционалдық тұрақты (вакуум өткізгіштігі деп аталады) ; Б - диэлектрлік өткізгіштік (вакуум үшін 1-ге тең, О° С-дағы және 760 мм с. б. ауа үшін 1, 00058-ге тең) .
Судың 20° С температурадағы диэлектрлік өткізгіштігі 80, 2 және 25°С-да - 78, 4. Бұл сұйықтық үшін өте жоғарғы көрсеткіш. Полярсыз сұйықтық - гексанның (СН 3 - (СН 2 ) 4 - СН 3 ) диэлектрлік өткізгіштігі 1, 87-ге тең. Оның өте аз мөлшері көптеген органикалық еріткіштерге тән. Мысалы, гексан ерітіндісіндегі Na + және СI иондарының өзара электрлік тартылу күші судағыға қарағанда 43 есе жоғары. Сондықтан гександағы NaС1-дың диссоциациялану деңгейі судағы ерітіндідегіден анағұрлым төмен. Осыған байланысты органикалық еріткіштерде иондардың көп мөлшері диссоциацияланбай қалады.
Су зарядты бөліктер үшін жақсы еріткіш, ал полярсыз молекулалар үшін нашар еріткіш. Кейбір заттардың, мысалы, белоктардың, фосфатидтердің молекулаларында полярлы және полярсыз топтары болады. Бұл заттардың судағы ерітінділерде полярсыз топтары орталығында, полярлы топтары сырт жағында орналысып, сумен әрекеттесетін мицеллалар (жіпшелер) түзеді. Мицеллалардың бұндай ерекшеліктері биологиялық мембраналардың клеткаға жөне органоидтарға суды ендіру және олардан оны шығару қабілеттігін тежейді.
Электролиттер ерітіндісі. Ішінде еріген иондары бар судың қүры-лысы біраз өзгеріске ұшырайды. Сұйық (қанықпаған) ерітіндіде ол өзгеріс зарядталған иондарға байланысты. Заряд тығыздығы жоғары иондар таза судың құрылысына заряд тығыздығы төмен ірі иондарға қарағанда, күштірек өсер етеді. Бұлардың екеуі де судың қалыпты құрылысын бұзады: біріншілері су молекуласын өзіне тартса, екіншілері суға енгенде көлемінің ірілігінен мұз тәріздес қанқасын бұзады. Бұнда ерітіңдінің тұтқырлығы өзгеруі мүмкін: ірі иондардың әсерінен ерітінді тұтқырлығы таза судыкінен төмендейді де (Іі + , Na + , Мg 2+ , Ғ), ал майда гидраттанған иондардың (К+, Rb + , NН 4 + , Сs + , С1, ОН, N0 т. б. ) әсерінен жоғарылайды.
Катионның электрлік өрісіндегі судың барлық жақын молекулалары теріс полюстермен ішке қарай бағытталып, аниондар айналасындағы судың молекулалары ішке қарай оң полюстермен бағытталады. Осы ішкі ионмен тығыз байланысқан су молекулаларының қабатын бірінші, немесе жақын гидратация деп атайды. Бұл қабаттың сыртында қашықтау орналасқан молекулалар қабатын екінші, немесе қашық гидратация деп атайды.
Бірінші гидратация күйіндегі су молекулаларының жылжымалылығы төмен және көршілес жақын молекулалармен алмасу тепе-теңдігінде болады. Ал екінші гидраттық қабықтағы молекулалар жылжымалылығын сақтап, судың алғашқы құрылысын бұзады. Осы қабаттың сыртындағы су құрылысы өзгеріссіз қалады.
Иондармен байланысқан суды осмостық байланысқан су деп те атайды. Ол өсімдік клеткасыңдағы осмостық қысымның негізгі бөлігі. Ерітіндінің концентрациясы жоғарылаған сайьш (1, 5-2 моль/л-ге дейін) екінші гидратты қабықтар жабылады да, судың құрылысы бұзылады: таза су құрылысы кристалл - шартты күйге ауысады. Ерітіндідегі иондар саны көбейген сайын судың құрылысы да көбірек бұзылады. Демек, қалған сутектік байланыстарды ыдыратуға және ерітіндінің температурасын жоғарылатуға қажеггі энергия мөлшері азаяды.
Белоктар ерітінділері. Белоктардың гидраттануы судың гидрофшъдік (ионды және электробейтарапты) және гидрофобтық (полярсыз) топтармен әрекеттесуіне, оның (судың) макромолекулалардың ішіндегі бос кеңістіктерде тұйықталып қалуына байланысты.
Иондық (NН + , СОО ) және электробейтарапты (-СООН, -ОН, ~СО, -NH, -NH,, -С(NН 2 -) топтармен өрекеттескеңде су молекулалары бірінші гидраттық қабат түзеді (электростатикалық байланыс) . Белок молекуласындағы ионданған топтардың саны ортаның реакциясына (рН) байланысты. Изоэлектрлік нүктедегі белок өте нашар гидраттанады және нашар ериді. Аланиндегі - СН 3 , валиндегі -СН-(СН 3 ) 2 , лейциндегі - СН 2 -СН-(СН 3 ) 2 сияқты гидрофобты топтар судың құрылыстылығын арттырады. Белок молекуласындағы топтардан басқа, мембраналардың гидрофобты липидтік бөлігі де судың құрылыстылығына әсер етеді.
Макромолекулалардың ішіндегі тұйықталған су бірінші гидраттық қабаттың пайда болуына қатысып, қалған бөлігі көдімгі судың Қасиетін сақтап қалуы мүмкін.
Белоктардың суда ерігіштігі өте құбылмалы келеді. Олардың гидраттануы мен ерігіштігінің арасында тікелей байланыстылық жоқ деуге болады.
Мысалы, құрғақ коллаген белогы, альбуминге қарағанда суды көбірек байланыстырады да, суда ерімейді, альбумин - жақсы ериді.
Сонымен макромолекулалар өздерін қоршаған суға түрліше әсер етеді. Олардың физикалық, химиялық қасиеттеріне, құрылыстық күйіне және сыртқы жағдайларға байланысты судың көп немесе аз байланысуы, мұз тәріздес тұрақты құрылысы қалыптасуы мүмкін.
2. 3. Судың өсімдік клеткасында алмасуы
2. 3. 1. Клеткадағы судың күйлері
Өсімдік ұлпаларындағы судың мөлшері өте өзгергіш және құбылмалы болып келеді. Ол өсімдік түрлеріне, органдарына, маусымдық және тәуліктік жағдайларға байланысты ұдайы өзгеріп тұрады.
Клеткалар мен ұлпалардағы суды бос және байланысқан деп екі түрге бөледі. Байланысқан су осмостык (еріген заттарды - иондарды, молекулаларды гидраттайтын), коллоидтық және қылтүтікті байланысқан деген түрлерге бөлінеді.
Өсімдік ұлпаларындағы бос су оңай жылжып, таралғыш келеді. Егер ауыр суды (Н 2 18 О) тамырды қоршаған ортаға енгізсе 1-10 минут шамасында оның қоршаған ортадағы және тамырдың ішкі ұлпалары құрамындағы мөлшері бірдей болғандығы байқалады. Бүл жағдай тамыр клеткасының плазмалеммалар арқылы судың кедергісіз өте алатындығын дәлелдейді. Бидайдың жас тамырындағы судың 3/4 вакуольде, 1/4 клетка қабықтарында және 1/20 бөлігі ғана цитоплазмада болады екен. Бірақ, вакуольдері қалыптаспаған меристемалық клеткалардағы судың негізгі бөлігі цитоплазманың құрамында болады.
Клеткадағы су осмос және биоколлоидтардың бөріту күшімен ұсталып тұрады. Судың жалпы мөлшері өте азайған кезде де оның мөлшері гидратганған коллоидтардың бөліктерімен, иондар және молекулалармен байланысқан күйде қалып қояды. Клеткадағы байланысқан судың мөлшері де әртүрлі жағдайларға, өсімдіктің түрлеріне, мүшелерінің орналасу орнына, жалпы судың мөлшеріне байланысты өте құбылмалы келеді.
Клетка қабықтары өзінің ылғал тарткыштығы (гигроскопиялығы) және пектинді, целлюлозалы бөліктерінің гидрофильдігіне байланысты біраз суды өз бойында ұстап тұра алады. Олардың қылтүтіктері аралықтарындағы қуыстарында және целлюлозаның талшықтарында сутектік байланыстарымен ұсталып тұратын судың жылжымалылығы өте нашар болса, майда талшықтары арасындағы кеңірек қуыстардағы су оңай жылжиды. Клетка суға толық қаныққан жағдайда оның қабығындағы су мөлшері 50%-ке жетеді. Судың өткізгіш шоқтардан тыс жылжуы негізінен клетка қабықтары арқылы жүзеге асады, және ондағы жалпы су ағынын сыртқы гидростатикалық кысымды пайдалану арқылы жеделдетуге болады.
Цитоплазмадағы судың мөлшері клетка қабығындағыға қарағанда көбірек, кейде цитоплазма салмағының 95%-іне дейін жетуі мүмкін. Ондағы гидрофильді коллоидтардың негізгі түрлеріне белоктар жатады. Белоктық құрылымдардың ішінде де біраз мөлшерде су болады. Белок молекулаларының тікелей бетінен 1 мкм-ге дейінгі аралықтағы су өте тығыз байланысқан және гидрофобтық аймақтардағы судың құрылысы мұздың құрылысына жақын болады. Цитоплазмадағы қанттар, тұздар, липидтер және басқа қосындылар да судың күйіне үлкен әсер етеді.
Клеткадағы пластидтер, митохондриялар және ядро өз мембраналары арқылы цитоплазмадан бөлінген күйде болады. Олардың көлемі осмостық күштерге байланысты өзгеріп тұрады. Хлоропластардағы судың мөлшері цитоплазмаға қарағанда азырақ болады, бүл олардың құрамында көп мөлшерде липидтердің және липофильді қосындылардың көптігіне байланысты. Митохондриялар туралы да осыны айтуға болады.
Клеткадағы ең суы көп бөлік вакуоль болып есептеледі. Оның сөлінде қанттар, органикалық қышқылдар және олардың тұздары, минералдық катиоңдар мен аниоңдар (К + , СІ), ферменттер, белоктар және басқа азотты қосындылар, шырындар, танниндер, пигменттер болады. Тұздар, канттар және органикалык қышқылдар еріген күйде болса, белоктар, танниндер және шырындар вакуольдің гидрофильді коллоидтық бөлігін құрайды. Вакуоль сөлін тонопластың таңдап өткізгіштігіне байланысты, суды осмостық күшпен үстап тұратын нағыз ерітінді деп қарауға болады.
2. 3. 2. Судың осмостық сіңуі
Кез келген организмнің тіршілік әрекеттері қалыптағыдай жүзеге асуы үшін сыртқы ортадан жеткілікті мөлшерде судың енуі қажет. Өсімдік клеткасына судың енуіне биоколлоидтардың бөрту, гидраттану күштері әсер етеді. Судың осындай күштердің әсерінен сіңуі тұқымдарды суға малғанда, немесе ылғал топыраққа отырғызғанда байқалады. Бірақ, тірі клеткаға судың енуі негізінен осмостық күшке байланысты болады.
Кез келген ортадағы заттар бөліктерінің бір орыннан басқа орындарға үздіксіз қозғалып араласуын ірігу (диффузия) деп атайтындьіғы белгілі. Еріткіштің өзінен жартылай өткізгіш мембрана арқылы бөлінген ерітіндіге өтуін осмос деп атайды.
Осы кұбылысты бірінші рет француз физиологы Г. Дютроше 1826 жасанды осмометр арқылы зерттеді. Ол ішіне шыны түтік орнатқан жартылай өткізгіш кабыршақтан жасалған (пергамент, мал қуығы) қалташықты қант немесе басқа заттың ерітіндісімен толтырды. Осы қалтаны таза су құйылған ыдысқа малып қойғанда түтіктегі сұйықтық деңгейі жоғарылағанын байқады. Бірақ, оның қолданған қабыршақтары нағыз жартылай өткізгіш болмағандықтан, қанттың жайлап енуі осмостық қысымның шамасын өлшеуге мүмкіндік бермеді.
Осмометрдің жетіліңкіреген түрін В. Пфеффер ұсынды. Ол ұсақ саңылаулы фарфор ыдысқа сары қан тұзының К 4 [Ғе(С1И) 6 ] ерітіндісін қүйып, оны СиSО 4 ерітіндісіне малып қойды. Осы ерітінділердің өзара өрекеттесуінен ыдыстың саңылауларында жартылай өткізгіш қасиеті бар Си[Ғе(СІN) 6 ] тұзының қоймалжың қабыршағы пайда болды.
Осындай осмостық қуысқа судың енуінен сұйықтықтың манометрлік түтіктегі деңгейі сұйықтың гидростатикалық қысымы ерітінді көлемінің ұлғаюына кедергі жасағанша тоқталмайды. Осылай жартылай өткізгіш мембрана арқылы судың ерсілі-қарсылы жылжуы да теңеседі. Бүл жағдайдағы гидростатикалық қысым Р потен-циалдық осмос қысымына тең болады.
Вант-Гофф осмостық заңдылықтар Бойль-Мариоттың газдың заң-дылықтарына сәйкес екендігін дөлелдеді. Ол потенциалдық қысымды есептеу үшін мына теңдеуді ұсынды:
п= 1-С-К-Т
мұңдағы, С - ерітіндінің мольдік концентрациясы, Т - абсолюттік температура, К - газ тұрақтысы, 1 - изотоникалық коэффицент.
Сонымен тұрақты температуралық жағдайда қанықпаған ерітінділердің осмостық қысымы еріген зат бөліктерінің (молекулалар, иондар) мөлшерімен анықталады. Потенциалдық осмос қысымы Паскальмен белгіленіп, қанықтығы белгілі ерітіндшің суды сіңірудегі ең жоғары мүмкіңдігш сипаттайды.
Белгілі заттың ірігу жылдамдығымен белгіленетін молекулаларының энергетикалық деңгейін осы заттың химиялык, потенциалы деп атайды. Таза судың химиялық потенциалы су потенциалы (СО Н ? О) деп аталады. Ол судың араласу, булану, немесе сіңу қабілеттілігін сипаттайды және Паскальмен белгіленеді. Химиялық таза судың потенциал іпамасы ең жоғары және нөлмен белгіленеді. Сондықтан кез келген ерітіндінің жөне биологиялық сұйықтықтардың су потенциалы теріс мәнді болады. Ол еріген заттың мөлшерімен анықталатын осмостық потенциалдың жөне гидростатикалык, қысыммен байланысты потенциалдың жиынтығы болып есептеледі.
Егер өзі арқылы тек қана суды өткізетін жартылай өткізгіш қабыршақтан жасалған, ішіне сахароза ерітіндісі қүйылған қалташықты таза суға малып қойса, су молекулалары оның ішіне қарай енеді. Ерітіндідегі еріген заттар су ырықтығын кемітетіндіктен қалташықтан судың сыртқа шығуы ішке енуінен аз болады. Сондықтан сахароза ерітіндісінің көлемі ұлғайып, осмометрлік түтіктегі деңгейі жоғарылайды. Осмостық қысымды анықтау үшін таза еріткіш бөлшектерінің ырықтығын тойтаруға, соған байланысты су молеку-лаларының ерсілі қарсылы жылжуын теңестіруге қажетті өлшеу керек болады.
2. 3. 3. Өсімдік клеткасы - осмостық жүйе
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz