Ақуыздар мен нуклеин қышқылдары тақырыбындағы сабақтың оқушылардың ынтасы мен белсенділігін арттыру әдістемесі


Аннотация
Курстық жұмыстың тақырыбы «Оқушыларға сабаққа деген ынтасын, белсенділігін арттыру мақсатында «Ақуыздар мен нуклеин қышқылдары» тақырыбында сабақ өту әдістемесі. Курстық жұмыс 32 беттен тұрады.
«Кіріспе» бөлімінде курстық жұмыс тақырыбына қысқаша шолу жасалған.
«Ақуыздар мен нуклеин қышқылдары туралы түсінік» бөлімінде ақуыздар мен нуклеин қышқылдарының құрылысы, құрамы, қызметі мен түрлері қарастырылған.
«Ақуыздар мен нуклеин қышқылдары» тақырыбында сабақ өту әдістемесі» бөлімінде сабақта қолданылатын қазіргі заманғы технологиялар жайлы және сабақ өту жоспары келтірілген.
Курстық жұмыс қорытындыдан және 16 пайдаланылған әдебиеттен тұрады.
Мазмұны
Кіріспе . . . 3
1 Ақуыздар мен нуклеин қышқылдары туралы түсінік
1. 1 Ақуыздар, құрылысы, физикалық және химиялық қасиеттері . . . 4
1. 2 Ақуыздардың атқаратын қызметі . . . 13
1. 3 Ақуыздардың жіктелуі . . . 14
1. 4 Нуклеин қышқылдарына жалпы сипаттама . . . 15
1. 5 ДНҚ және РНҚ . . . 18
2 «Ақуыздар мен нуклеин қышқылдары» тақырыбында сабақ өту әдістемесі
Қорытынды . . . 28
Пайдаланылған әдебиеттер . . . 29
Қосымша . . . 30
Кіріспе
Курстық жұмыстың көкейкестілігі: Мектепте балалар кездескен қиыншылықтарды шешуге және алдарына қойған мақсаттарына жетуге тырысады. Мұндай жағдайлар, өздерін дұрыс ұстай білуге, ішкі және сыртқы жағдайларды бағалауға және мінез-құлқы мен танымдық өрістерін дамытып, қалытастырады.
Өсімдік жасушасының химиялық құрамы аса бай және алуан түрлі. Онда көптеген реакцияларға қатысып метаболизм түзетін әр түрлі заттар бар. Мұндай алмасу нәтижесінде заттар үздіксіз өзгеріп ыдырайды және осының арқасында жаңа заттар түзіледі. Алмасу реакциялары белгілі бір қатаң тәртіппен өтеді және ферменттердің әсерімен реттеліп отырады. Тірі жасушада болатын ерекше жағдайлардың арқасында реакциялар жоғары жылдамдықпен өтеді. Жасушаның немесе протопластың химиялық құрамына талдау жасағанда, біріншіден, ондағы заттардың аса көптігі мен алуан түрлілігіне, екіншіден, талдау барысында тірі жасушаға тән емес заттардың пайда болуына байланысты көптеген қиындықтар туады. Академик В. И. Вернадский жер қыртысындағы элементтердің барлығы да (тіпті сирек кездесетін элементтер де) өсімдіктерде белгілі бір мөлшерде кездеседі деп санайды. Алайда тірі заттың құрамына бар болғаны 22-27 элемент кіреді. Тірі затқа жасуша қабықшасының ішкі көлемінде тұратын барлық сұйық, қоймалжың протопласт жатады. Оның қабатында органоидтер: вакуоль, цитоплазма, ядро, т. с. с. орналасқан. Тірі зат құрамына кіретін элементтерді үш топқа бөлуге болады. Бірінші топқа көміртек, сутек, оттегі, азот, фосфор, күкірт жатады. Ион түрінде кездесетін элементтер: натрий, калий, магний, кальций, хлор. Үшінші топқа микроэлементтер кіреді: темір, мыс, қалайы, мырыш, марганец, кобальт, иод, молибден, ванадий, никель, хром, фтор, селен, шақпақ тас, бор, мышьяк. Көрсетілген элементердің 16-сы барлық организмдерде кездеседі. Тірі зат құрамындағы элементтердің түрлері міне осындай. Жалпы табиғатта кездесетін элементтер саны 92 болса, тірі зат құрамына кіретін 22-27 элементтерді биоэлементтер деп атайды. Бұл элементтер өзара әрекеттесе тұрып, күрделі органикалық заттар түзеді [5] .
Курстық жұмыстың мақсаты - ақуыздар мен нуклеин қышқылдарының құрылысымен, түрлерімен, химиялық және физикалық қасиеттерімен, қатысатын реакцияларымен, қолданылуымен танысу.
Курстық жұмыстың міндеті - оқушылардың білімдік дағдысын дамыту, өмірден көрген деректерді пайдалана білуіне және шығармашылықпен жұмыс істеуге дағдыландыру, сабақта алған білімдері мен ақпараттарын шынайы өмірде пайдалану.
Практикалық қолданылымы: Мектеп барысында оқушыларда ақуыздар мен нуклеин қышқылдарының түсініктерін қалыптастыру және сабақ барысында олардың зейінінің шоғырлануын қамтамасыз ету және дамыту жолдарына мүмкіндік жасау.
1 Ақуыздар мен нуклеин қышқылдары туралы түсінік
1. 1 Ақуыздар, құрылысы, физикалық және химиялық қасиеттері
Тірі организмдердің негізін құрайтын ақуыздың маңызды ролін Ф. Энгельс: "Тіршілік - ақуызды денелердің тіршілік ету әдісі" - деп көрсеткен болатын.
Ақуыз - организмдегі заттардың ішіндегі ең күрделісі, ал оның элементтік құрамы айтарлықтай қарапайым болып келеді. Онда 51-53%-ы көміртегі, 16-18%-ы азот, 7%-ы сутегі, 21-23%-ы оттегі, 0, 7-1, 3%-ы күкірт болады. Кейбір ақуыздарда бұған қосымша фосфор да кездеседі. Үрмебұршақ, соя, күнбағыстың тұқымында көптеген мөлшерде ақуыз болады. Бұл өсімдіктер тұқымының үгілген массасын сумен, тұзды, спиртті және әлсіз сілтілі ерітінділермен тұндыру жолымен олардан ақуызды бөліп алу қиын емес.
Күшті қышқылдармен және сілтілермен бірге қайнатқан кезде, сондай-ақ ферменттердің әсерімен ақуыз амин қышқылдарының қоспасына ыдырайды.
Амин қышқылдары өсімдікте кетон қышқылдарын тікелей аминдеу немесе қайта аминдеу деп аталатын екі негізгі реакция арқылы синтезделеді. Бұл реакциялар өсімдіктерде арнаулы ферменттердің әсерімен орындалады. Мысалы: қарапайым пирожүзім қышқылы тікелей аминдеу реакциясында амин тобын қосып алып аланин деп аталатын амин қышқылын түзеді.
NH 2
СН 4 СОСООН + NH 3 + 2H → CH 3 CH-COOH + Н 2 О
пирожүзім қышқылы аланин
Сөйтіп, амин қышқылдарының құрамында карбоксил тобынан басқа амин тобы да болады. Тікелей аминдеу реакциясы бактерияларда, бидай, жүгері, ас бұршақ, ас қабақ өсімдіктерінде бақыланған. 20 шақты амин қышқылдары ақуыздар құрамына кіреді. Сонымен бірге өсімдіктерде бос амин қышқылдары да кездеседі. Олардың саны 150-ге тең. Бос аминқышқылдар негізгі амин қышқылдарының туындысы. Олардың көбісі фотосинтез кезінде немесе топырақтан азотты қабылдау кезінде, жалпы метаболизм процесінде түзіледі. Адам организміне қажетті амин қышқылдары азықпен бірге қабылданады. Олардың ішінде валин, лейцин, изолейцин, метионин, треонин, фенилаланин, лизин және триптофан ерекше қажет. Азық-түліктің құрамында осы амин қышқылдарының болуы азық-түліктің қоректік құндылығын арттыра түседі. Олар міндетті түрде қабылданатын амин қышқылдары деп аталады.
Кесте 1 - Ақуыздар құрамына кіретін амин қышқылдарының радикал (R) топтарымен байланысты жіктелуі.
кластарға
жіктелуі
1-класс:
R-топтары
2-класс:
R-топтары
3-класс:
R-топтары
4-класс:
R-топтары
Аспарагин
қышқылы
Глутамин
қышқылы
Аланин молекуласындағы СН 3 тобы бүйірлік радикал болып табылады. Жеке амин қышқылдарының бүйірлік радикалдары түрліше болып келеді. Сонымен байланысты амин қышқылдары 4 класқа бөлінеді. Ақуыздар құрамына кіретін негізгі амин қышқылдары, олардың бүйірлік радикалдарының түріне қарай жіктелуі 1-кестеде келтірілген. I класқа гидрофобты амин қышқылдары аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан, метионин жатады. II класқа поляризацияланған, электр заряды жоқ амин қышқылдары серин, треонин, тирозин, цистеин жатады. Бұл амин қышқылдары сумен Н-байланыс түзуге қабілетті. III класқа плюс зарядты лизин, аргинин, гистидин амин қышқылдары жатады. IV класс минус зарядты аспарагин және глутамин амин қышқылдарын біріктіреді.
Амин қышқылдарының тірі организмдер үшін физиологиялық маңызы бар екі қасиетіне назар аударайық. Оның бірі амфолиттік, екіншісі оптикалық активтік [8] .
Сулы ерітінділерде амин қышқылдарының СООН және NH 2 топтары ортадағы реакцияға карай диссоциацияланады. Мысалы, сілтілі ортада амин қышқылының карбоксил тобы диссоциацияланғанда минус заряд, қышқыл ортада NH 2 тобы диссоциацияланғанда плюс заряд пайда болады.
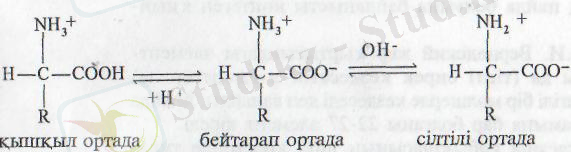
Сөйтіп, амин қышқылы ортадағы реакцияға байланысты бірде қышқыл, бірде сілті ретінде қызмет атқарып, амфолиттік қасиет көрсетеді. Бейтарап ортада олар қос зарядты цвиттерион түрінде болады.
Амин қышқылдарына оптикалық активтік тән. Олардың ерітіндісі арқылы полярланған сәулені өткізгенде сәуленің поляризация бағыты өзгереді. Оптикалық активтік кеңістіктік изомерияға, яғни хиралды көміртегі жағдайында атомдар тобының әркелкі орналасуына байланысты. Мысалы, аланин амин қышқылы екі түрлі болып кездесуі мүмкін. Хиралды көміртек жұлдызшамен белгіленген,

Мұның біріншісі L-қатарына, екіншісі D-қатарына жатады. Қосылыстардың D және L-формалары энантиомер деп аталады. Айналу бағыты плюс немесе минус таңбаларымен белгіленеді. Ақуыздың құрамына кіретін барлық "натуралды" амин қышқылдары L-формалары болып табылады. Амин қышқылдарының оптикалық активтігі мен заряд түзу қасиеттерінің биологиялық маңызы зор. Тек глицин құрамында хиралды көміртек болмағандықтан, оның оптикалық активтігі жоқ. Төменде кейбір кең таралған амин қышқылдарына сипаттама берілген.
L-аланин көптеген метаболизм реакцияларына қатысып, көмірсулар, майлар, ақуыздар алмасуында аралық зат ретінде роль атқарады. Бұл топырақтан азотты сіңіру кезінде өсімдіктің тамырында синтезделетін алғашқы амин қышқылдарының бірі. Оның формуласы: СН 3 •СН NH 2 •СООН.
L-серин, L-цистеин және басқа амин қышқылдарының құрамында SH, ОН топтары бар. Сол себептен олар ақуыздың құрамына кіре отырып, оның реакциялық активтілігін күшейтеді. L-сериннің формуласы:
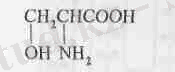
L-цистеин барлық ақуыздардың құрамына кіреді. L-цистеиннің формуласы:
СН 2 СН•СООН
SH NH 2
L-цистеинннің екі молекуласының арасында дисульфидтік байланыс түзіліп цистеин цистинге айналады. Цистиннің формуласы:
S-CH 2 CHNH 2 COOH
S-CH 2 CHNH 2 COOH
Дисульфидтік байланыс түзуінің арқасында цистеин ақуыз молекуласында зор структура түзушілік роль атқарады.
Аспарагин және глютамин амин қышқылдарының құрамында екі карбоксил тобы бар. Олар барлық өсімдік ақуыздарының құрамына кіреді немесе бос түрде жинақталады.
Өсімдіктер жасушаларында осы амин қышқылдары тағы бір амин тобын қосып алуға және сөйтіп аспарагин, глютамин деп аталатын екі амид түзуге қабілетті. Амид синтездеу реакциялары бірңеше ферменттердің жәрдемімен өтеді.
Амид түзу арқасында осы екі амин қышқылы жасушадағы азотты жинақтап, сақтап, ретті жұмсалуына себепші болатындығын атақты ғалым Д. Н. Прянишников көрсеткен.
Барлық өсімдіктер жасушаларында көптеген мөлшерде L-аргинин және L-лизин кездеседі. Басқа амин қышқылдарынан өзгеше, олардың құрамында екі амин тобы болады.
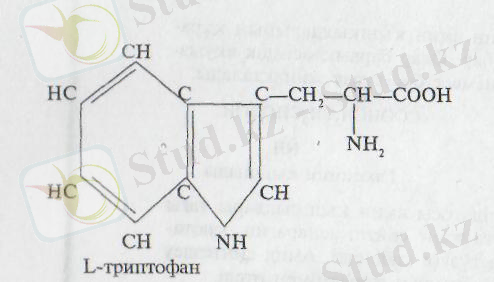
L-триптофан жануарлар организмінде синтезделмейді, ол міндетті түрде қабылданатын амин қышқылы болып табылады. Одан РР витамині түзілетіидіктен, оның зат алмасуын-да маңызы зор.
Жүгері дөнінен алынған зеин деп аталатын ақуыздын, құрамында триптофан мен лизин болмайды. Міндетті түрде қабылданатын осы екі амин қышкылының болмауы жүгерінің қоректік және азықтық қүндьшығын кемітеді.
L-гистидин ақуыздар құрамына кіреді. Оның имидазол шеңбері бүйірлі радикал ретінде ақуыз құрамына кіре отырып, оның электрлік зарядын, химиялық реакцияға бейімділігін күшейте түседі. Оның формуласы төменде жазылған.
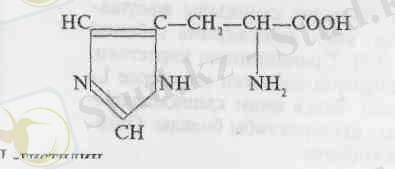
L-гистидин
Өсімдіктерде көп таралған немесе зат алмасуында белгілі бір роль атқаратын амин қышқылдарына қысқаша алғанда осылайша сипаттама беруге болады. Олардан басқа бос түрде немесе ақуыздың құрамына кіретін көптеген амин қышқылдары да бар. Қазіргі кезде 150-ден астам амин қышқылдары белгілі, алайда олардың 20-22-сі ғана ақуыздардың құрамына кіреді деп, жоғарыда айтылды.
Ақуыз молекуласының құрылымы. Ақуыз молекуласындағы амин қышқылдары бір-бірімен пептидтік байланыс арқылы қосылады, ол бір амин қышқылының карбоксил тобы мен екінші амин қышқылының амин тобының есебінен түзіледі (Сурет 1) .
Бұл екі амин қышқылдары өзара СООН және NH 2 топтарымен әрекеттесіп қосылғанда пайда болатын топты пептидтік топ, оның құрамындағы көміртегі мен азот арасындағы байланысты пептидтік байланыс деп атайды. (формуласында пептидтік топ қоршауға алынып көрсетілген) .
Пептидтік байланыс ковалентті, осының арқасында амин қышқылдарының түрлі мөлшері өзара қосылып, полипептидтік тізбек деп аталатын түзу тізбек түзеді. Полипептидтік тізбектің бір ұшында бос NH 2 тобы, екінші ұшында бос СООН тобы орналасады. Осыған орай тізбектің ұштары N-ұшы және С-ұшы деп аталады. Полипептидтік тізбек ақуыз молекуласының негізін құрайды. Ақуыз молекуласының құрылымы төрт деңгейлі болады. Линдерстрем-Ланг бойынша ақуыз молекуласының бірінші деңгейлі құрылымы пептидтік байланыстың арқасында түзілген полипептидтік тізбек болып табылады.
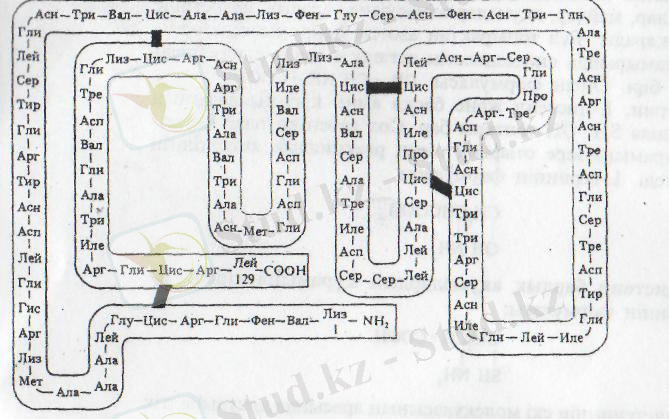
Сурет 1- Лизоцим атты ақуыз адам, өсімдік, жұмыртқа құрамынан табылған.
Бұл ақуыз - фермент молекуласында 129 амин қышқылы қосылып полипептид тізбегін құрайды. Тізбектегі цистеиндер өзара әрекеттесіп, тізбектің төрт жерінде дисульфидтік байланыс түзеді. Полипептид тізбегі, ондағы аминқышқылдарының саны, сапасы, қатарласу тәртібі ақуыздың бірінші деңгейлі құрылымы болып табылады.
Ақуыздың түрлері бір-бірінен тізбектегі амин қышқылдарының кезектесіп орналасу тәртібі, саны және олардың сапалық құрамы арқылы ерекшеленеді. Табиғатта ақуыздың алуан түрлі болып кездесуі ең алдымен полипептидтік тізбектің құрамына байланысты (Сурет 2) . Жоғарыда айтқанымыздай, ақуыздың құрамына бар болғаны 20-22 амин қышқылы және айтарлықтай сирек кездесетін ондаған амин қышқылы енеді. Олар түрліше тәртіппен кезектесе келе, полипептидтердің сансыз варианттарын түзе алады. Сонымен қатар, полипептидтік тізбекте кейбір амин қышқылдары әлденеше рет ұшырасуы немесе болмауы да мүмкін.
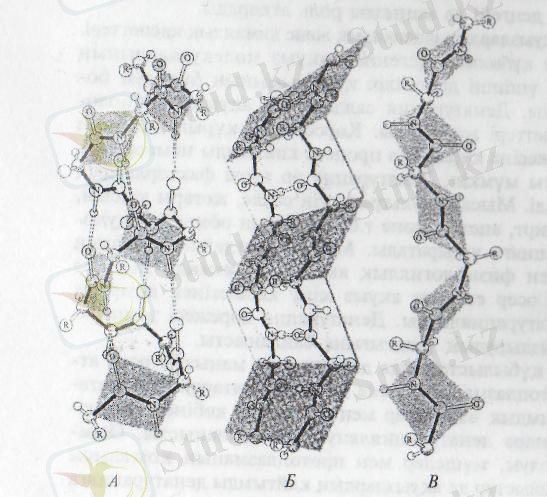
Сурет 2 - A - оңға бұрылған α-спираль. Б - β-қатпаршадағы екі антипараллельді тізбектер. В - солға бұрылған спираль. (Ирвинг Гейс суреті, Ч. Кантор, П. Шиммелден алынған) . Ақуыз молекуласының екінші деңгейлі құрылым түрлері.
Ақуыз молекуласында бір немесе бірнеше полипептидтік тізбек болуы мүмкін. Мысалы, рибонуклеазада ақуызында бір, инсулиннің молекуласында екі, ал гемоглобиннің молекуласында төрт, вирус мозаика ақуызының құрамында 2130 полипептидтік тізбек болады. Молекуланың құрамына кіретін жеке тізбектер амин қышқылдарының бүйірлік радикалдарының жәрдемі арқылы бір-бірімен дисульфидтік байланыспен жалғасуы мүмкін. Дисульфидтік байланыстарды екі тізбекке жататын цистеин түзеді.
Ақуыз молекуласындағы полипептидтік тізбектер жазық түрде сақталмайды. Бірінші мен бесінші, бесінші және тоғызыншы және т. с. с. пептидтік топтардың өзара тартылуы есебінен ақуыз молекуласының ішінде сутектік байланыстар түзіледі. Осының арқасында пептидтік тізбек спираль тәрізденіп оралады. Пептидтік тізбектің мұндай спираль тәрізді күйі ақуыз молекуласының екінші деңгейлі құрылымы деп аталады. Пептидтік тізбектің кейбір бөлігі спиральды құрылымға кірмейді.
Лайнус Полинг және Роберт Корри XX ғасырдың 40-50 жылдары ақуыз молекуласының α-спиральді құрылымының моделін салып, оны ұстап тұратын негізгі күш Н-байланыстар екенін көрсетті. Екінші деңгейлі құрылымның Н-байланыс арқылы түзілуі тек α--спираль емес, сондай-ақ β-құрылым, қатпарлы құрылым, 3 10 -спираль, π-спираль сияқты құрылым туғызады. Олардың схемалары суретте көрсетілген.
Полипептидтік тізбектің жиынтық шумақ болып орналасуы үшінші двңгейлі құрылымды қалыптастырады. Ақуыздың үшінші деңгейлі құрылымы түзілгенде кейбір ақуыздар молекуласы жіп сияқты созылыңқы, басқа ақуыздар глобула сияқты пішінге келеді. Оларды тиісінше фибриллалы немесе глобулалы ақуыз деп атайды. Осы екі негізгі пішін арасында көптеген аралық формалар бар.
Рентген құрылымдық анализ әдісін қолдану арқылы 1961 жылы алғаш рет миоглобин деп аталатын ақуыздың үшінші деңгейлі құрылымы дәл анықталды. Миоглобин молекуласының құрамында 153 амин қышқылының қалдықтары 8 α-спиральді учаске түзеді, олар өзара тығыз жанасып, топ түзеді (Сурет 3) . Бұл топтың ішкі ортасында гидрофобты амин қышқылдары орналасқан, ал гидрофильді амин қышқылдарының қалдықтары молекуланың сыртына орналасқан. Ішкі ортаға орналасқан амин қышқылдарының қалдықтары Н-байланыс және гидрофобты күштер арқылы өзара әрекеттеседі. Бұл байланыстар әлсіз болғандықтан, оңай, үзіледі, сондықтан молекуланың конформациясы өзгеруге бейім тұрады.
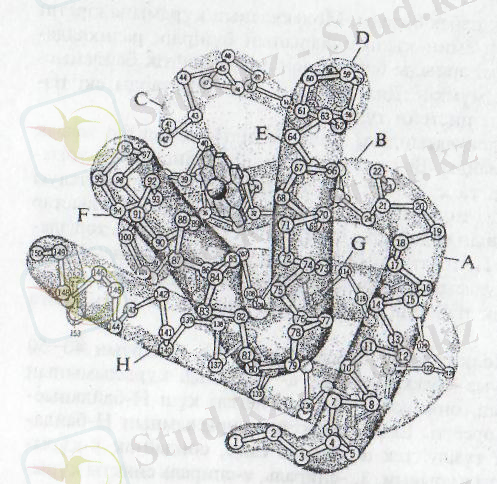
Сурет 3 - α - спираль бөліктері А-дан Н - әріптерімен белгіленген. (Ирвинг Гейс суреті Ч. Кантор, П. Шиммелден алынған) . Ақуыз миоглобиннің үшінші деңгейлі құрылымы.
Ақуыз молекуласы бір конформациядан екінші конформацияға өтіп, өзгеріп отырады. Молекуланың құрамындағы атом топтарының кеңістікте орналасуын конформация деп атайды. Сөйтіп, ақуыздың үшінші деңгейлі құрылымы өзгере келе, түрлі модификациялар туғызады. Молекуланың орталығы көбіне осы секілді шумақталып, тығыз орналаскан α-спираль және β-құрылым учаскелерден тұрады. Оны домен деп атайды.
Ақуыз конформациясы өзгеріп отыруының зор биологиялық маңызы бар. Осындай өзгергіштіктің арқасында төртінші деңгейлі құрылым түзіледі. Бұл құрылым күрделі ақуыздарға ғана тән. Олардың молекулалары өзара байланысқан бірнеше белшектен тұрады. Байланыс жасайтын учаскелері бір-біріне комплементарлы болуға тиісті. Бөлшектерді молекулааралық әлсіз күштер біріктіріп тұрады, олар - вандервальс күштері, электростатикалық тартылу, гидрофобты әрекеттесу күштері. Жеке бөлшектер суббірлік немесе протомер деп аталады да олардың қосылысын макромолекула немесе олигомер деп атайды. Жекеленген протомерлер біріге келе, дөңгелек, спираль, куб тәрізді құрылым түзеді. Мысалы, вирустардың сыртын қаптаған ақуыз қабаты көбіне 60 протомерден тұратын куб - икосаэдр болып табылады.
Протомерлердің конформациясы мүлде симметриялы болмаған жағдайда да олар біріге алады. Осындай қосылыстағы протомердің бірі өзінің конформациясын өзгертіп қосылуға бейімделеді. Мұндай олигомерді квазиэквивалентті олигомер деп атайды, олардың биологиялық маңызы бар. Ақуыз қызметінің активтілігін арттыруда молекула құрылымының барлық төрт деңгейі де маңызды роль атқарады.
Ақуыздардың физикалық және химиялық қасиеттері. Денатурация құбылысы дегеніміз ақуыз молекулаларының екінші және үшінші деңгейлік құрылымының бұзылуы болып табылады. Денатурация салдарынан ақуыздың биологиялық қасиеттері жойылады. Көрсетілген құрылымдардың бұзылу дәрежесіне қарай бұл процесс қайтымды немесе қайтымсыз болуы мүмкін. Денатурация әр түрлі факторлардың әсерімен өтеді. Мысалы, ультракүлгін сәуле, жоғары қысым, қыздыру, спирт, ацетон және т. б. заттардың әсер етуі ақуызды денатурацияға ұшыратады. Мұндай жағдайда ақуыздың ерігіштігі мен физиологиялық, активтілігі кемиді. Жоғары температура әсер еткенде ақуыз ісіну қабілетінен айырыла отырып денатурациялайды. Денатурация дәрежесі температура мен қыздырудың ұзақтығына байланысты.
Тіршілік құбылыстарында денатурация маңызды роль атқарады. Цитоплазма мен басқа да органоидтарда өтіп жататын құрылымдық өзгерістер мен процестер көбінесе ақуыздардың ішінара денатурациялануымен байланысты. Өсімдіктердің солуы, мүшелер мен протоплазманың қозғалысы секілді құбылыстар да ақуыздардың қайтымды денатурацияға қабілеттілігімен байланысты болуы мүмкін.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz