Ле-Шателье принципі, әсерлесуші массалар заңы және химиялық тепе-теңдіктің ығысуы


Ле-Шателье принципі
Жоспар
І. Кіріспе
IІ. Негізгі бөлім
1. Химиялық тепе-теңдік.
2. Әсерлесуші массалар заңы.
3. Химиялық тепе-теңдіктің ығысуына әсер ететін факторлар. Ле-Шателье принципі.
ІІІ. Қорытынды
Кез келген химиялық реакция 2 бағытта жүреді . Мысалы, гомогенді фазада өтетін А+В ↔︎ С+Д. Химиялық реакция нәтижесінде жаңа өнімнің алынуы - оң жаққа қарай жүретін реакцияға жатады. Тура реакцияның жылдамдығы: υT=Кт[А] •[В] теңдеуімен беріледі. Реакцияның бастапқы кезінде тура реакцияның жылдамдығы жоғары, яғни өнімдердің түзілуі қарқынды өтеді. Біраз уақыттан соң, яғни реакция өнімдері (С, Д) қажетті мөлшерде жиналғанда, кері реакцияның, демек бастапқы заттардың түзілу де едәуір артады. υT=Кт[C] •[D] Реакция қайтымды болғандықтан, белгілі мезеттен соң химиялық тепе-теңдік орнайды. Бұл жағдайда қоспа құрамы (конценрациялары, қалыпты қысымдары) тұрақты болады, тура және кері реакцияның жылдамдықтары теңеседі. Химиялық тепе-теңдік жағдайында болатын, тура және кері бағытта өтетін реакциялар қайтымды реакциялар деп аталады. Термодинамикалық тұрғыдан химиялық тепе-теңдік кезінде изобаралы-изотермалы потенциалдың мәні өзгермейді (G = соnsт,

 G=0) . Химиялық реакцияға қатысатын барлық заттардың Гиббс энергиясының өзгеруі химиялық ынтықтылық мөлшерін көрсетеді. Демек, изобаралы - изотермалы потенциалдың өзгерісі үдерістің қозғаушы күші ретінде саналады.
G=0) . Химиялық реакцияға қатысатын барлық заттардың Гиббс энергиясының өзгеруі химиялық ынтықтылық мөлшерін көрсетеді. Демек, изобаралы - изотермалы потенциалдың өзгерісі үдерістің қозғаушы күші ретінде саналады.

 G=0 болған сайын, жүйе тепе-теңдік күйден алшақтау және соғұрлым реакцияласуға қабілетті.
G=0 болған сайын, жүйе тепе-теңдік күйден алшақтау және соғұрлым реакцияласуға қабілетті.
Тепе-теңдік күйде

Ал реакция кері жүріп, әуелгі қосылыстардың қайта шығуы кері бағыттағы реакция болады. Сондай-ақ жылу бөліне жүретін реакция экзотермиялық реакцияларда тура бағыттағы десе сырттан жылу қабылдайтын эндотермиялық реакцияларды кері реакция деді. Белгілі бір уақыт өткен соң реакциялар теңеседі. Егер осы тепе-теңдік орнағанда Т, Р сияқты параметрлер өзгермесе, химиялық тепе-теңдік орнап, реакцияға түсетін заттардың концентрациялары тұрақталады. Химиялық қайтымды реакциялар химиялық тепе-теңдік орнағанша жүреді. Термодинамикалық тұрғыдан олар қайтымсыз және жұмысы тиімді емес. Әйтседе тура және кері бағыттағы химиялық реакцияларды үздіксіз қозғалыстағы бөлшектер түрінде қарастыратын болсақ оны термодинамикалық қайтымды процеске жақындатуға, ұқсатуға болады. Егер осы айтылған ой шартқа айналса, онда бұған термодинамикалық тепе-теңдік шартын қолданып, ондағы барынша пайдалы, тиімді жұмысты есептеуге болады және ол жұмысты А’
m
=-
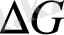 ұқсастық өлшемі дейді. Тура реакцияның жылдамдық тұрақтысының кері реакцияның жылдамдық тұрақтысына қатынасы тепе-теңдік тұрақтысы (Кт-т) деп аталады.
ұқсастық өлшемі дейді. Тура реакцияның жылдамдық тұрақтысының кері реакцияның жылдамдық тұрақтысына қатынасы тепе-теңдік тұрақтысы (Кт-т) деп аталады.
Соңғы теңдеу әсерлесуші массалар заңының математикалық теңдеуі болып саналады. Бұл теңдеуден қайтымды химиялық реакциялардағы тепе-теңдік реакция өнімдерінің және бастапқы заттардың концентрациялары көбейтінділерінің қатынасы тұрақты шамаға тең болған кезде орнайтындығын көреміз. Тепе-теңдік тұрақтысы (К с ) қайтымды реакциялар үшін классикалық деп аталады, ол әсерлеуші заттардың табиғатына тәуелді, бірақ олардың концентрацияларына тәуелсіз. Температура өзгергенде тепе-теңдік тұрақтысы жылдамдық тұрақтыларына қарағанда аз өзгереді, себебі Кт/Кк қатынасы температураға байланысты мүлдем өзгермейді.
Біз заттардың стехиометриялық коэффициенттері 1-ге тең қарапайым, қайтымды реакцияны қарастырдық.
Егер теңдеудегі стехиометриялық коэффициенттер сәйкес а, в, с, d-ға тең болса, онда қайтымды химиялық реакцияның теңдеуін былай жазамыз:
аА+вВ

 сС+dД
сС+dД
Мұндай жалпы жағдай үшін химиялық тепе-теңдік теңдеуі (басқаша айтсақ, әсерлесуші массалар заңы) былай жазылады.

Бұл заңды басқаша жазуға болады. Мысалы, әсерлесуші заттар газ күйінде болса, теңдеудегі концентрация орнына олардың парциалды қысымдарын келтіріп, өрнектейміз. Онда тепе-теңдік тұрақтысын Кр деп белгілейміз.
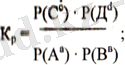
Реалды жүйелер үшін концентрация орнына заттардың тепе-теңдік күйдегі белсеңділіктері (а) қолданылады, бул жағдайдағы Ка-химиялық тепе-теңдіктің термодинамикалық түрақтыеы деп аталады. Кр мен Кс арасындағы байланысты табу үшін Менделеев-Клайперонның идеал газ күйінің теңдеуін қолданайық:
рV = nRТ, осыған р = (n/V/) RТ
n/V=С (моль) концентрация болғандықтан, р А =[А] RТ деп жазамыз.
Теңдеуді парциалды қысымдар мәндерінің концентрациялары арқылы
өрнектелік:
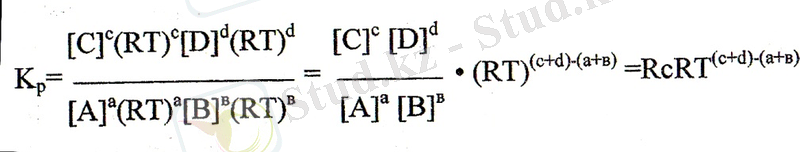 l
l
немесе, Кр=Кс(RТ) Δn мұнда, n=(с+d) -(а+b), яғни Δn реакциядағы заттардың стехиометриялық коэффициенттердің алгебралық қосындысы, немесе реакциядағы молекула санының (көлемінің) өзгерісін көрсетеді. Молекулалар сандары өзгермейтін реакциялар үшін, яғни с+д=а+в жағдайда, Кс және Кр мәндері өзара сәйкес келеді, Кр= Кс.
Әсерлесуші массалар заңының маңызды қорытындысы реакцияға қатысатын заттардың концентрацияларының немесе парциалды қысымдарының өзара байланыстылығын көрсетеді.
Тепе-теңдік жүйедегі р, Т=соns жағдайда әсерлесуші заттардың біреуінің концентрация өзгерісі міндетті түрде басқа заттардың сәйкес концентрация
өзгерісіне әкеледі, бірақ тепе-теңдік тұрақтысы өз мәнін сақтайды.
Гетерогенді реакцияларда химиялық тепе-теңдік тұрақтысының өрнегіне реакцияға қатысатын тек газ күйдегі заттардың парциалды қысымдары (немесе концентрациялары) енеді. Сұйық немесе қатты күйдегі заттардың парциалды қысымдары" (немесе концентрациялары) 1-ге тең деп алынады, себебі олардың химиялық потенциалдары тұрақты.
Мысалы, 2С( амор ф) + О 2 ( Г ) = 2Сons реакциясы үшін

2. 1. Химиялық тепе-теңдіктің ығысуы.
Химиялық тепе-теңдіктің теңдеуіне сәйкес, тепе-теңдікте тұрған жүйедегі кез келген зат концентрациясының өзгерісі тепе-теңдіктің қандай да бір ығысуына әкеледі. Бастапқы заттардың концентрацияларының артуы реакция өнімдері ағымының өсуіне әкеледі, ал реакция өнімдерінің концентрациясының артуы бастапқы заттардың түзілу ықтималдылығының арттырады. Химиялық тепе-теңдікке температура мен қысым өзгерісі де әсер етеді. Демек, химиялық тепе-теңдік күйі сыртқы жағдайлар (концентрация, қысым, температура) өзгеріссіз болғанда сақталады. Бұл Сыртқы шарттардың өзгерісі тепе-теңдік күйді бұзады. Сыртқы жағдайларға байланысты жүйенің бір тепе-тендік күйден екіншісіне өтуін химиялық тепе-теңдіктің ығысуы деп аталады.
Әр түрлі сыртқы жағдайлардың өзгерісінің тепе-теңдіктің бағытына әсері Ле-Шателье (1885ж. ), Браузи (1886ж. ) ережесімен беріледі. Егер термодинамикалық тепе-теңдікте тұрғын күйеге сырттан әсер етіп, тепе-тендікті анықтайтын қандайда бір сыртқы шартты (концентрация, қысым,
температура) онда жүйеде осы әсерді әлсіретуге тырысатын өздігінен жүретін үдерістер пайдаболады.
Химиялық тепе теңдік жағдайында тура және кері реакциялардың жылдамдықтары өзара тең болады, сырттжі әсер ету осы жылдамдықтардың әртүрлі өзгеруіне әкеледі. Тура және кері реакциялардың жылдамдықтарының тепе - теңдігінің бұзылуы химиялық тепе-теңдіктің ығысуына, мұнан соң, жылдамдықтары бірдей болатын жаңа химиялық тепе-теңдіктің орнауына әкеледі, бұл бұрынғы тепе-теңдік күйден сипаты бойынша өзгеше.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz