Термодинамиканың бірінші және екінші заңдары


ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ БІЛІМ және ҒЫЛЫМ МИНИСТІРЛІГІ
СЕМЕЙ қаласының ШӘКӘРІМ атындағы МЕМЛЕКЕТТІК УНИВЕРСИТЕТІ
Инженерлік-технологиялык факультеті
(факультет)
«Техникалық физика және жылу энергетика»
(Кафедраның атауы)
Мамандыққа кіріспе
(Мамандық атауы)
СӨЖ
(жұмыс түрі)
Жылудинамиканың бірінші және екінші заңы.
(Жұмыс тақырыбы)
Орындаған: Абушахманов А. М.
Тексерген: Сейсенбаева М. Қ.
2015ж
Мазмұны
Кіріспе3
1. Термодинамиканың негізі4
1. 1 Ішкі энергия4
1. 2. Термодинамиканың бірінші заңы. 5
1. 3 Изопроцесс үшін термодинамиканың бірінші заңын қолдану. 7
2. Термодинамиканың екінші заңы9
Қолданылған әдебиет12
Кіріспе
Термодинамика
- энергияның трансформация реттейтін заңдар ғылым.
Термодинамиканың негіздері қаланды XIX ғасырда қашан дамуына байланысты жылу қозғалтқыштары REQ пайда трансформация заңдарын зерттеуге арналған. Жұмысқа жылу айналу. Бірақ содан кейін, Термодинамиканың әдісі трансформация жандандырды
жылу техникасының шектері және кеңінен физика көптеген салаларында қолданылады, химия және басқа да ғылымдар. Термодинамика Сіз орнатуға мүмкіндік береді, қай бағытта орын алуы мүмкін. Түрлі физикалық және химиялық пайызы әр түрлі жүйелерде. Біз, сондай- біз кейінірек, термодинамика қараңыз тиіс. Түрлі арасындағы Vath, терең байланыстары заттың үкіметтік қасиеттері; негізі бұл, мысалы, жайғастыруды мүмкіндік береді, заттар, жылу қуаты туралы деректер, термодинамикалық әдістермен заттың тығыздығы, және керісінше есептеу. Физика көптеген облыстарында айырмашылығы термодинамика және химия жұмыс істемейді кез келген құрылымы модельдер зат тікелей қосылған жалпы және емес, аралдары
материалдың микроқұрылымы идеясы байланысты. Бұл және күші мен термодинамика әлсіздігі. Өзі емес, термодинамика қасиеттері туралы кез келген ақпаратты беруге болатын заттар. Бірақ біз кейбір білсеңіз
заттардың қасиеттері туралы деректер, про немесе жүйелер, термодинамикалық әдістері өзара алуға мүмкіндік береді және маңызды қорытындылар. Термодинамика мәселені құрылысының принципі. Термодинамика лауазымына негізі екі ірі заңның әйелі орнатылған айтады эмпирикалық. Термодинамиканың бірінші заңы спикер сандық сипаттайды энергия трансформациясы процестер және екінші заң қарай сапасын белгілейді.
Жүйесінде бөлшектердің кездейсоқ жылу қозғалысы энергиясын - молекулалардың, атомдары мен олардың өзара іс-қимыл энергетикалық кез келген термодинамикалық жүйенің маңызды ерекшелігі оның ішкі энергиясы. Ішкі энергиясын тұтастай жүйесі мен сыртқы салалардағы жүйесін әлеуетті энергиясын кинетикалық энергиясы болып табылады. нақты мемлекетте жүйесінің ішкі энергия жүйесі деп мемлекет (яғни, өтпелі) келді, және тек осы мемлекеттерде термодинамикалық параметрлердің мәндері анықталады қалай байланысты емес. Термодинамика, бұл талаптарды қанағаттандыруға өзге де функциялар бар, олар мемлекеттік жүйесінің функциялары деп аталады. Осылайша, ішкі энергия - мемлекеттің функциясы.
Одан әрі талқылау үшін, біз еркіндік дәрежесі тұжырымдамасы керек - толығымен кеңістікте жүйесінің жағдайын анықтау, тәуелсіз айнымалы (координаттары) саны. Мысалы, monatomic газ молекуласы үдемелі қозғалыс (координаттары х, Y, Z) (сурет 1. 1. А) үш дәрежелі бостандығынан бар материалдық нүкте ретінде қарастыруға болады. Қатаң бір-біріне қосылған екі материалдық ұпай жиынтығы ретінде классикалық механика қаралады двухатомных газ молекуласы, еркіндік 5 градус болды. Ол (Cурет. 1. 1. B) ϕ бұрыштарда бұрылыстар байланысты айналмалы бұқаралық және 2 дәрежелі орталығының үдемелі қозғалыс бостандығы 3 дәрежесі бар θ және. Бұл бұрыштар молекулалық осіне бағдарын анықтау, полярлық бұрышы θ және азимутальной бұрышы φ болып табылады. Бұл жағдайда, бірінші қарағанда ол өз осі туралы айналу ψ молекуласының бұрышын орнату үшін, сондай-ақ қажет көрінеді. Бірақ өз осі туралы двухатомных молекуласының айналуы сондықтан бұл бұрышы осындай молекуласының кеңістікте ұстанымын орнату үшін қажет емес, атомдар материалдық нүктелер құрылымында ретінде молекуласының орнын өзгерту және жоқ. Қосымша бұрышы ψ қажет қазірдің өзінде бар, өйткені атомдары бір-бірімен қатаң байланысты онда Үш атомды молекулалар (сур. 1. 1. c), еркіндік 6 дәрежесі бар.
Атомдары өзгеруіне арасындағы қашықтық болса, яғни молекуласының Діріл атомдары, онда бұл қашықтықты, қосымша координаталарын анықтау үшін - еркіндік тербелмелі градус, және еркіндік дәрежелі жалпы саны градус саны 6 әлдеқайда болуы мүмкін көп атом молекулаларының 6. артық.
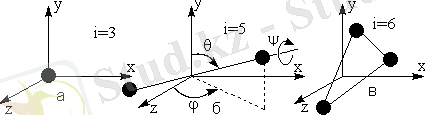
Сурет 1. 1. Еркіндік дәрежесі: а) бір атомды молекулалар
б) екі атомдымолекула
в) үш - және көпатомды молекулалардың.
Бұрын біз Идеал газдың бір-атом молекуласының келесі өрнек үдемелі қозғалыс орташа кинетикалық энергиясы үшін формуланы бар. Бірақ бір-атом молекула үдемелі қозғалыс бостандығы үш дәрежесі бар және бірде-бір басқа да жоғары болып табылады. <Ε1> = Kt / 2: Сондықтан, орта есеппен әрбір деңгейінде жалпы 1/3 тең энергетика, үшін болуы тиіс. Ол еркіндік барлық градус тең екенін анық болғандықтан, онда классикалық статистикалық физика бостандығынан Больцман энергетикалық градус біркелкі бөлу туралы заң бар. Төмендегідей Ол тұжырымдалған: термодинамикалық тепе-теңдік күйінде статистикалық жүйесі үшін, еркіндік әр трансляциялық және вахталық градус Kt / 2 тең орташа кинетикалық энергиясын бар, және бостандығы әрбір колебательных дәрежесін алу үшін - Кт. Еркіндік тербелмелі градус ол кинетикалық сонымен қатар өзара іс-қимыл әлеуеті энергия ғана емес, қажетті екі есе көп энергия бар. Осылайша, кез келген молекуласының орташа энергия <ε> = IKT / 2, мұндағы і - айналмалы, трансляциялық сомасы болып табылады, және еркіндік колебательных дәрежелі екі рет саны.
Осыған заң, біз Идеал газдың бір моль ішкі энергетикалық U UM = ikTNA / 2 = IRT / 2, және U = ikTN / 2 = iRTm / 2M тең газ бұқаралық м ішкі энергетикалық U (мұнда біз ескере өзара іс-қимыл әлеуеті энергиясын қабылдауға табамыз, бұл молекулалардың 0 тең, бір моль молекулалардың жалпы саны) Н. А., N = mNA / М және KNA = R тең.
1. 2. Термодинамиканың бірінші заңы.
Жұмыстың орындалу арқылы және жылу алмасу жолымен: термодинамикалық жүйе мен сыртқы қоршаған орта арасындағы энергия алмасу екі сапалы түрлі тәсілдермен жүзеге асырылуы мүмкін.
Өлшенген жұмыс әсерінен жүреді энергетикалық жүйені, өзгерту. Термодинамикалық жүйе сыртқы күштердің қарсы жұмыс істейді, онда жұмысы оң (> 0) болып саналады. Жүйесі бойынша болса жұмыс, сыртқы күштер жасауға, ол (А <0) теріс болып саналады.
Аударылған немесе жылу орган жүйелері жылу байланыста болуы қажет болғанда Q. алып жылу мөлшеріне анықталады жылу беру нәтижесінде жүреді энергетикалық жүйені, өзгерту, яғни Осы жүйелердің молекулалары оның қозғалысы кезінде тап және олардың кинетикалық энергиясын бөлісуге қабілетті болуы тиіс. Ол содан кейін Q <0, алыс жүйесінен алынады, егер энергетикалық (жылу) Q> 0, содан кейін жүйесіне беріледі болса. Сондықтан, жұмыс және жылу - басқаларға бір денеден энергиясын беру екі нысандары болып табылады. Ішкі энергиясының жылдан бастап - оның барлық өзгерістер энергияның сақталу заңдарға бағынуы тиіс отырып, молекулалардың механикалық энергия болып табылады. Осы заңның термодинамикалық процесін қатысты тәжірибелік мәліметтерді қорыту нәтижесінде құрылған, термодинамиканың бірінші заңы болып табылады. Тәжірибе мемлекет 1 мемлекетке 2 көшу кез келген әдісі жүйесі ΔU = U1 ішкі энергиясының өзгеруі көрсетті, бұл үшін - жүйе мен сыртқы күштердің қарсы керемет жүйесінің жұмысын өндірілген, U2 жылу Q мөлшерінде анықталады (соның нәтижесінде жылу жүйесін энергиясын және жұмысын арттырады қоршаған ортаны қорғау жүйесі), оны азайтады:
 ΔU = Q - A немесе Q = ΔU + A
(1)
ΔU = Q - A немесе Q = ΔU + A
(1)
Былайша дифференциалды нысанда (құндылықтар шағын өзгерістер үшін) жазылған:
δQ = dU + δA (2)
мұндағы δQ - жылу шексіз сомасы, DU - ішкі энергия шексіз өзгерісі †, - қарапайым жұмыс. Бұл теңдеу термодинамиканың бірінші заңын білдіреді: жүйесіне жеткізілетін жылу оның ішкі энергиясының өзгеруіне жұмсалады және сыртқы күштерге қарсы жұмыстарды орындауға. ΔQ және †, жылы Δ белгісі деректер бастауыш үстемелердің толық дифференциал емес, және, демек, А және Q мемлекеттің функциялары емес екенін көрсетеді.
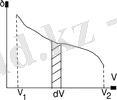
Поршеньдік қозғалысы - газ поршень, дл әсер етеді, ол күш - Let цилиндрлік контейнерлерде Қоса беріліп отырған газ, оңай жылжымалы поршеньді ауданы С. бізге газ көлемінің †, = Fdl = pSdl = pdV, F арттыру жұмыс істеуге мүмкіндік жабық. Р (V), х осінде және тікелей V = V1 және V = V2 (суретте 2. 2. ) Шектелген ауданға тең V1 doV2 қайраткері бастап көшкен кезде тәуелділігі р (V) графикалық, жалпы жұмыс көлемі болса. Графикалық ол ғана мүмкін тепе процестерді білдіреді, және термодинамиканың барлық сандық қорытындылар тек тепе процестерді қатаң қолданылады. Нақты процестерді жеткілікті төмен ағыны тепе шамамен деп санауға болады. Термодинамиканың бірінші заңы энергетика және өндіруші жұмыс алмасу байланысты барлық процестерді жүзеге асырылады.
1. 3 Изопроцесс үшін термодинамиканың бірінші заңын қолдану.
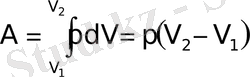
 Термодинамикалық процестер келесі түрлері:
Термодинамикалық процестер келесі түрлері:
1. Изохора
- тұрақты көлемі жүреді процесс. V = Const. (р, Т) диаграмма ол изохора (сурет 1. 3. ) деп аталатын түзу сызықты, бейнелейді. Изохора барысында газ = 0 DV-ақ сыртқы органдардың жұмыс істемейді. Газға дағдыландыру Барлық жылу, оның ішкі энергиясын және изохора процесс δQ = Du үшін Термодинамиканың демек, мен заң арттыру болып табылады. Бір моль δQm = Dum Dum = SVdT үшін. Гельмгольц карбюраторлық қозғалтқышы отын жану процесі болып табылады.
2. Изобаралық
- тұрақты қысым кезінде пайда болатын процесс. Координаттар (V, T) процесін көрсететін тікелей, (сурет. 1. 4. ) Изобар деп аталады. үшін термодинамиканың бірінші заңы
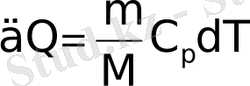 изобарических процесі δQ DU + †, =. Қысым өзгерте алмайды бастап, V1-ден V2 газ көлемі артады операция болып табылады
изобарических процесі δQ DU + †, =. Қысым өзгерте алмайды бастап, V1-ден V2 газ көлемі артады операция болып табылады
 Изобарических процесінде газ жаппай м бөлісті жылу
Изобарических процесінде газ жаппай м бөлісті жылу
оның ішкі энергиясын арттырады, ал
температурасы айқындаған Идеал газдың ішкі энергиясы, қысым және көлемі тәуелсіз болып табылады. Изобарических жылыту жүйесі жылу газ кеңейтеді ретінде, δQ> 0 және †, > 0. Бірге процесінің изобарических қысу бағыты өзгереді, және қазір жылу жүйесі, яғни жойылады, δQ <0 және †, <0, газ бойынша жұмыстар сыртқы күштер жасауға бері. DU, сондай-ақ нөлден кем болады. Изобарических процесінің мысал қазандықтың немесе әуе-реактивті қозғалтқыштарда отын жану бу қалыптастыру ретінде қызмет ете алады.
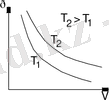 3. Изотермиялық
- тұрақты температурада орын алады процесс. (Р, V) салынған қисық, изотерма деп аталады. Бұл диаграммада (1. 5-сурет) бар гипербола болып процесс жүреді, онда температура неғұрлым жоғары, жоғары. T = const кезінде Идеал газдың ішкі энергиясын өзгерту емес, бері, Du = 0 және изотермиялық процесс үшін термодинамиканың бірінші заңы нысанын қабылдайды: δQ = †, . жылу изотермиялық процесінің ST = δQ / Дт = δQ / 0 = ∞ қуаты, және ол ешқандай мағынасы. Изотермиялық процесс термостат (сол температурада орналасқан ішкі энергиясының үлкен маржа, бар қоршаған немесе орган) қатысуымен жүзеге асырылады.
3. Изотермиялық
- тұрақты температурада орын алады процесс. (Р, V) салынған қисық, изотерма деп аталады. Бұл диаграммада (1. 5-сурет) бар гипербола болып процесс жүреді, онда температура неғұрлым жоғары, жоғары. T = const кезінде Идеал газдың ішкі энергиясын өзгерту емес, бері, Du = 0 және изотермиялық процесс үшін термодинамиканың бірінші заңы нысанын қабылдайды: δQ = †, . жылу изотермиялық процесінің ST = δQ / Дт = δQ / 0 = ∞ қуаты, және ол ешқандай мағынасы. Изотермиялық процесс термостат (сол температурада орналасқан ішкі энергиясының үлкен маржа, бар қоршаған немесе орган) қатысуымен жүзеге асырылады.
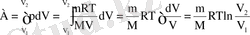 Бізге барлық екенін ескерсек газ изотермиялық кеңейту, жұмыс істеуге мүмкіндік
Бізге барлық екенін ескерсек газ изотермиялық кеңейту, жұмыс істеуге мүмкіндік
газға дағдыландыру жылу мөлшері оларға сыртқы күштердің қарсы жұмыс жасауға тұтынылатын, және оның температурасын өзгерте алмайды. Жұмыс үшін формуласы және Менделеев-Клапейронның теңдеуі ескере отырып, біз алуға
Изотермиялық процестерді мысалдары оларды дайындау кезінде болаттарды шынығып, жасыту. Вагондар мен вагон бар - тоңазытқыштар бұзылатын өнімдерді тасымалдау үшін қызмет ететін. Олар тасымалдау процесінде тұрақты температураны сақтау үшін тоңазытқыштар мен денесін оралғанына, сондықтан мұндай жағдайларда өнімдері изотермиялық деп атауға болады.
2. Термодинамиканың екінші заңы
Ешқандай өзгерістер бар, онда ол алға және артқа бағытта да, қоршаған ортаға және жүйесінде орын алуы мүмкін, егер термодинамикалық процесс қайтымды деп аталады. Осы талаптарға жауап бермейді, кез келген процесс, қайтымсыз болып табылады.
Жүйе мемлекеттердің бірқатар арқылы өтетін болса, Ысырылғаннан, процесс циклдік процесс немесе цикл деп аталады. Ішкі жану қозғалтқыштары, бу және газ турбиналары, тоңазытқыштар - циклдары барлық жылу машиналар негізі болып табылады. Газ кеңейту, сондай-ақ 2-1 процесі - (P, V) технологиялық диаграммада 1-2 процесі қисық, бір тұйық ұсынылған (Сур. 2. 1) қысу процесі. Нәтижесінде, жүйенің дөңгелек процесс ретінде алуға және беруге қыздыра алады. Біз жылу Q1 сомасын жәйттерді, мен берді - Q2. қисық 1-2-1 шектелген қайраткері ауданы бойынша анықталады цикл астам газ атқарған жұмыс. Нәтижесінде, цикл жүйесі өзінің бастапқы күйіне қайтарады, сондықтан, газ ішкі энергиясының толық өзгерту нөлге тең, ал цикл бір атқарылған жұмыс жылу Q = Q1 Q2 = А. алынған
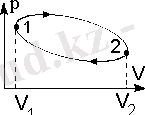
Сурет 2. 1 Дөңгелек процесс (цикл) .
Термодинамиканың екінші заңы саналатын қорытынды Қарно-ның 1824 жылы “Оттың (жылудың) қозғаушы куші және сол күш-ті үдететін машина туралы ойлану” деген еңбегінде алғаш ғылы-ми тұрғыдан көрсетілді. Осы ойды 1850 жылы Клаузиус математи-калық өрнекпен дәлелдей келіп, жылу салқын денеден өздігінен ыстық денеге ауыспайды деген пікір айтты. Ал, 1854 жылы Кель-вин кез келген денедегі жылуды басқа қосымша эрекет етпестен, тек салқындату салдарынан ғана жұмысқа айналдыруға болмайды десе, Оствальд екінші тектегі мэңгілік двигательді жасау мүмкін емес деді.
Жоғарыда келтірілген тұжырымдардың әрқайсысының термо-динамиканың екінші заңына пара-пар екенін дәлелдеу қиын емес. Егер олардың біреуін негізгі постулат ретінде алса, қалғандары соньщ салдары болып шығады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz