Протолиттік (Бренстед-Лоури) теория бойынша қышқылдар мен негіздердің анықтамасы және медико-биологиялық маңызы


Жоспар:
1. Қышқыл мен негіз туралы түсінік.
2. Қышқыл мен негіз туралы теориялар.
3. Протолиттік теория тұрғысынан қышқылдарға анықтама.
4. Протолиттік теория тұрғысынан негіздерге анықтама.
5. Медико-биологиялық зерттеулер үшін қышқыл мен негіздің маңызы.
Тақырыбы : Протолиттік теория тұрғысынан қышқыл мен негізге анықтама.
Қышқыл дегеніміз - сутегі ионынан және қышқыл қалдығынан тұратын күрделі қосылыс.
Қышқыл дегеніміз - элекролиттік диссоциация процесі кезінде тек сутегі ионына ғана диссоциацияланатын электролит. Мысалы:
HCI
 H
+
+CI
-
H
+
+CI
-
H
2
SO
4
 2H
+
+ SO
4
2-
2H
+
+ SO
4
2-
H
3
PO
4
 3H
+
+ PO
4
3-
3H
+
+ PO
4
3-
H
2
ZnO
2
 2H
+
+ ZnO
2
2-
2H
+
+ ZnO
2
2-
Қышқылдардың аталуы :
- Оттекті қышқылдарда ең бірінші бейметаллдардың аты, содан кейін қышқыл.
- Оттегісіз қышқылдарда ең бірінші қышқыл қалдығының аты, содан кейін қышқыл деген сөз . Қышқылдар суда ерігіштігіне байланысты екіге бөлінеді.
А суда еритін
Б суда ерімейтін
- Қышқылдар
А. Тұз түзетін
Б. Тұз түзбейтін болып бөлінеді.
3. Құрамындағы сутегі атомының санына байланысты : А. Бірнегізді: HCI, HNO 3 .
Б. Екінегнізді: H 2 SO 4, H 2 СO 3 .
В. Үшнегізді: H 3 PO 4 , H 2 CrO 3
4. Қышқылдар:
А. Оттекті қышқылдар
Б. Оттексіз болып бөлінеді.
Оттекті қышқылдарға құрамында оттегі бар қышқылдар жатады:
H 2 SiO 3 , H 2 SO 3, HNO 3 .
Оттексіз қышқылдардың құрамы тек сутегі атомынан және қышқыл қалдығынан тұрады. Оларға негізінен галогендердің қышқылдары жатады:
HCI, HBr, HI, HF, H 2 S.
Қышқылдардың алыну жолдары:
- Қышқылдық оксидтердің сумен реакциясы:
P 2 O 5 + 3 H 2 O
2 H 3 PO 4,
СO 2 + H 2 O
H 2 СO 3 .
Суда жақсы еритін қышқылдық оксидтер сол қышқылдардың ангидриді деп аталады.
- Оттексіз қышқылдар сутегі атомымен галогендердің тікелей қосылуы арқылы алынады.
H 2 +CI 2
2 HCI
H 2 +Br 2
2 HBr
3. Алмасу реакциясы арқылы оксиді суда ерімейтін қышқыл алу.
SiO 2
H 2 SiO 3
Суда ерімейтін оксидтердің қышқылын алу үшін сол қышқылдардың суда жақсы еритін тұзына күшті қышқылының біреуімен әсер ету керек.
Nа 2 SiO 3 +2 HCI=
H 2 SiO 3 + 2NаCI
Қышқылдардың ішінде тотығу тотықсыздану реакциясы арқылы өндірісте H 2 SO 4 алынады.
2FеS 2 +11О 2
Equation. 3 2Fе 2 О 3 +8О 2+ Q
2 SO 2 + О 2
Equation. 3 2 SO 3
SO 3 + H 2 O
H 2 SO 4
FеS 2 +
SO 2
SO 3
H 2 SO 4
Химиялық қасиеттері.
- Қышқылдар металлдармен реакцияға түседі. Егер ол металлдың активті қатарында сутегіге дейін орналасса, онда сутегі бөлінеді.
Fе+ H 2 SO 4
Fе SO 4 + H 2
Сu + 2H 2 SO 4 (конц) = СuSO 4 + SO 2 +2H 2 O
- Қышқылдар негіздік оксидтермен әрекеттесіп, тұз және су түзеді.
H 2 SO 4 + СаO= Са SO 4 + H 2 O
- Қышқылдар амфотерлі оксидтермен реакцияға түседі.
H 2 SO 4 + ZnO=Zn SO 4 + H 2 O
- Қышқылдар алмасу реакциясы бойынша тұздармен реакцияға түседі.
СН 3 СООNa +HCI= СН 3 СООH+NaCI
Негіздер дегеніміз - құрамында металл ионы мен тек гидроксил тобынан және ионынан тұратын электролиттер. Мысалы:
Fе(OH) 2
Fе 2+ +2ОН -
NH 4 OH
NH 4 + +OH -
NaOH
Na + +OH -
РН>7 С н+ <C он-
Негіздердің ішінде сілтілік және сілтілік жер металлдардың гидроксидтері сілті деп аталады. Негіздерді негізінен негіздік оксидтер түзеді.
Негіздердің алыну жолдары:
Негіздер екі топқа бөлінеді:
- Суда еритін
2Na+ 2H 2 O
2NaOH+ H 2
- Суда ерімейтін
Сілтілік және сілтілік жер металлдардың гидроксидтері суда жақсы ериді.
Бұлар күшті электролиттер, иондарға жақсы ыдырайды, бірақ тері мен киімді күйдіреді. Бұлармен жұмыс істегенде қауіпсіздік ережелерін сақтау керек. Оны күйдіргіш натрий және калий деп аталады.
Суда ерімейтін негіздер - сол негіздердің суда жақсы еритін тұзына сілті қосу керек. Мысалы:
Cu SO 4 +2 NaOH=
(CuOH) 2 + Na 2 SO 4
Негіздердің химиялық қасиеттері
Негіздер - күшті электролиттер сондықтан олардың химияық қасиеттір алуан түрлі.
- Суда ерімейтін негіздерді қыздырғанда олар суға және оксидке ыдырайды. Мысалы:
(CuOH) 2
CuO+ H 2 O
- Негіздер қышқылдық оксидтермен реакцияға түсіп тұздар түзеді.
Мысалы: NaOH+ СO 2
NaHСO 3
Негіздердің ең негізгі қасиеттерінің бірі бейтараптау реакциясы. Мысалы,
NaOH+HNO 3
NaNO 3 + H 2 O
С н+ =С он- =10 -7 моль/л, РН=7
Амфотерлі негіздер.
Амфотерлі негіздерге жатады: Zn(OH) 2, Al(OH) 3, Cr(OH) 3 .
Амфотерлі негіздерге қышқылдық және негіздік қасиеттер тән.
ZnO
Zn(OH) 2<
H 2 ZnO 2
- Zn(OH) 2+ H2SO4ZnSO4+ H2O (бейтараптау реакциясы)
Бұл теңдеуде Zn(OH) 2 негіздік қасиет көрсетіп тұр.
2. Zn(OH) 2 + 2 NaOH= Na 2 ZnO 2 + H 2 O

Na 2 [ZnOH 4 ]
Натрий цинкаты.
Бұл теңдеуде Zn(OH) 2 қышқылдық қасиет көрсетіп тұр.
ҚЫШҚЫЛ ЖӘНЕ НЕГІЗ ТУРАЛЫ ТЕОРИЯЛАР
АРРЕНИУС ТЕОРИЯСЫ
Швед ғалымы Сванте Аррениус 1887 жылы гипотеза ретінде электролиттік диссоциациялану теориясын ұсынған. Бұл ең алғашқы қышқыл, негіз және тұз ерітінділерінде, олардың молекулаларының оң және теріс зарядты иондарға ыдырайтындығын көрсететін теория болды.
Қышқыл - суға ерігенде сутек иондарына (Н + ) ыдырайтын заттар, ал дәлірек айтсақ кышқылдық дәм, индикаторға әсерін, химиялық касиеттерін сипаттайтын гидроксоний
ионын (Н з О + ) түзетін заттар.
Мысалы: HNO 3 + Н + + NO 3 -
яғни: HNО 3 + Н 2 О НзО + + NO 3 -
Негіз - суда ыдырағанда гидроксил ионын түзетін заттар.
NaOH Na + +ОН -
Суда ыдырағанда әрі сутек ионын (Н + ), әрі (ОН - ) гидроксил ионын түзетін заттарды амфотерлік заттар не амфолиттер деп атайды
Мысалы: H 2 O Н + + OН -
Амфотерлік заттар үшін, қышқылдық ыдырау механизмін:
R-ОН RО
-
+H
+
, негіздік ыдырау механизмін:
R - ОН R
+
+ ОН
-
деп көрсетуге болады.
Аррениус теориясының көптеген кемшіліктері бар:
- Еріткіш тек су болғанда ғана бұл теория орындыболады, ал басқа еріткіш алынса, қандай затты қышқылне негіз деп алуға болатыны түсініксіз.
- Көптеген заттар ОН--ионын түзбей-ақ негіздікқасиеттер көрсетеді. Мысалы: органикалық амидтер менаминдер, аммиак:
R-C =O
NH 2 R- NH 2 NH 3
ҚЫШҚЫЛДАР МЕН НЕГІЗДЕРДІҢ ПРОТОЛИТТІК ТЕОРИЯСЫ.
Жоғарыда көрсетілген Аррениустың электролиттік диссоциация теориясы түсіндіре алмаған мәселелерді Дания ғалымы Дж. Бренстед пен ағылшын химигі Т. Лоури ұсынған қышқылдар мен негіздердің протолиттік теориясы түсіндіре алады. Бүл теория Бренстед-Лоури теориясы деп те аталады. Бұл теория қышқылдар мен негіздерді, заттар-дың протонға қандай байланысы бар екендігімен анықтайды.
Қышқылдар мен негіздерді бүл теория бойынша протолиттер деп, ал олардың бірімен-бірі әрекеттесуін протолиттік тепе-теңдік дейді. Протолиттік, яғни Бренстед - Лоури теориясы бойынша, қышқылдар дегеніміз сутек ионын (Н + ) беретін молекула не ион (донор) .
Сонымен, электролиттік теория түрғысынан қышқылдар қатарына жататын заттар, Бренстед-Лоури теориясы бойынша да қышқылдар қатарына жатады, тек соңғы теория бойынша кеңірек мағынада қолданылады, яғни тек қана молекулалар емес, иондар да қышқыл бола алады.
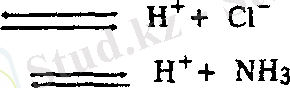
молекула -
катион -
анион -НСО - 3
Н + +СО 2- 3
Негіздер дегеніміз сутек ионын Н + қосып ала алатын молекулалар не иондар (акцептор) .
Мысалы: молекула C 6 H 5 - NH 2 + Н + = С 6 Н 5 -N + Нз
(амин - анилин)
молекула - :NНз + Н + NН 4 +
анион ОН - + Н + Н 2 0
Арреннустың электролиттік теориясынан негізгі ерекшелігі қышқылдар мен негіздер бірімен-бірі өте тығыз байланысты заттар. Қышқылдан протонның бөлінуі негіздің түзілуіне әкеп соқтырады. Мысалы:
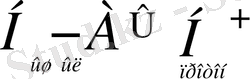
+
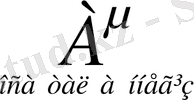
+
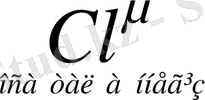
+
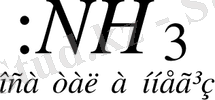
Әрбір кышқыл протонды бөліп шығару арқылы тиісті негіз түзеді, ал әрбір негіз протон қосып алып, өзіне тиісті қышқыл түзеді.
Мысалы :
+

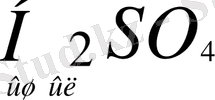
яғни H 2 SO 4 үшін SO 4 2- негіз болып табылады. Сонымен, қышқыл және негіз дегеніміз қандай да бір абсолюттік қасиет емес, салыстырмалы қасиет: заттардың қышқылдык қасиеті негіздер қатынасканда, негіздік қасиеттері қышқылдар қатынасқанда ғана жүзеге асады. Демек қышқыл мен негіз қосақталған жұп болып табылады. Қышқылдар мен негіздердің бірімен-бірінің әрекеттесуін жалпы мына схема түрінде көрсетуге болады:

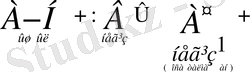
-
Қышқыл неғұрлым күшті (әлсіз) болса, онымен косақталған негіз соғүрлым әлсіз (күшті) болады:
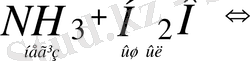
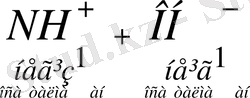
Амфолиттерді де осылай көрсетуге болады.
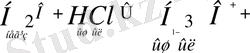

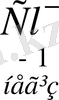
Қорыта келгенде, Бренстед-Лоури теориясы бойынша неорганикалық қосылыстардың арасына қышқылдарға: H 2 S, НСІ, НNОз, H 2 S04. Н з Р04 т. б., Н 2 О, әлсіз негіз бен күшті қышқылдың тұздарын (NH 4 C1), қышқыл тұздарды (NaHCO 3 , NaHS0 4 ), органикалық заттардан құрамында сутек ионы бар барлық заттарды (карбон қышқылдарын R - СООН, фенолды - С 6 H 5 ОН, спирттерді R - ОН, амин қышқылдарын) жатқызуға болады.
Негіздерге - бейорганикалық заттардың қатарынан NaOH, КОН, NH 3 , H 2 O, негіздік тұздарды Аl(ОН) (СНзСОО) 2 , протонды қосып алуға қабілеті бар көптеген органикалық заттар жатады. Қышқылдар мен негіздердің әлсіздігі не күштілігі, протонды беру не қабылдау қасиетіне тәуелді. Қышқылдар мен негіздердің күшті не әлсіз екендігінің сандық шамасын диссоциациялану реакциясының тепе-теңдігінің константасы арқылы анықтауға болады. (К а - қышқылдар контантасы, К в - негіздер константасы) .
Әрекеттесуші массалар заңы бойынша А+В
_С+Дреакциясының тепе-теңдік константасы:

Мысалы
+

Бұл реакцияның тепетеңдік константасы:
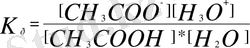
[СН 3 СОО - ], [Н 3 О + ], [СН 3 СООН] - реакцияға қатысқан және реакция нәтижесінде түзілген заттардың тепе-теңдік кезіндегі концентрациялары.
[Н 2 О] = const, сондықтан Кр * [Н 2 О] = const, яғни қышқылдық константасы-К а, басқаша жазғанда:
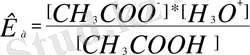
сандық шамасы неғұрлым көп болса, соғұрлым қышқыл күшті.
К а сірке қышқылы = 1, 75-10 -5 ; К а көмір қьииқылы- 5-10 -11
Көбінесе К а сандық шамасы теріс таңбамен алынған лога-рифммен анықталады: -lgК а = рК а
көмір қышқылының - рК а = 10, 32.
сірке қышқылының - рК а = 4, 75.
C
6
H
5
OH 9, 9
Н
2
О 15, 7
С 2 Н 5 ОН 18, 0
рК а сандык шамасы неғұрлым аз болса, соғұрлым кышқыл күшті қышқылдар қатарына жатады. Мысал ретінде кейбір заттардың рК а сандық шамасын көрсетейік:
фенол
су
этанол
сірке қышқылы СН з СООН 4, 7
Төменнен жоғары қарай бұл заттардың қышқылдық қасиеті артады. Негіздер үшін, қышқылдар сияқты тепе-теңдік константасын табады [К в ] және бұл тепе-тендік константасының ондык логарифмінің теріс таңбасы - l gK в = рК в болып анықталады.
Льюистің теориясы
Бренстед-Лоури теориясымен салыстырғанда мағынасы кеңірек. Г. Льюис ұсынған электрондық теория бойынша, қышқыл деп электрон жұбын қосып, коваленттік байланыс түзе алатын зат. Ал негіз электрон жұбын беретін зат.
Қышқыл мен негіздің әрекеттесуі, бұл теория бойынша донорлы-акцепторлық тип бойынша коваленттік байланыс түзе жүреді. Льюистің түсінігі бойынша қышқыл мен негіз арасындағы әрекеттесу аддукт деп аталатын комплексті қосылыс түзеді. Мысалы:
а/
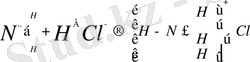
негіз кышкыл II- аддукт
(донор ē) (акцептор ē)
б/ Аg+ + [:Сl:] ө
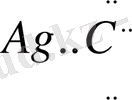
Льюис теориясының кемшілігі сутекті қышқылдардың бәрін қамти алмайды, өйткені олардың құрамында электрон қосағы жетпей тұрған атомдар жоқ, сондықтан олар өзіне электрон қосағын қосып ала алмайды. Ал кейбір қышқылдар мен негіздер реакция нәтижесінде комплексті қосылыстар емес, берік қосылыстар түзеді.
Мысалы: Ва 2+ + SO 4 2-
-BaS0 4қышқыл
Ал барий хлориді, бромиді және иодиді суда өте жақсы ериді. Табиғи рудаларда көптеген металдар оксидтер, карбонаттар, сульфаттар түрінде кездессе, кейбір металдар сульфиттер түрінде кездеседі. Бүл құбылысты Пирсонның принципі бойынша түсіндіруге болады. Пирсонның принципі бойынша қышқылдар мен негіздер - «қатты» (ағыл, - hard - жесткий) және «жұмсақ» (ағыл. - soft - мягкий) деп екі топқа бөлінеді. Қатты негіздер қатарына электртерістігі жоғары, полюстігі төмен, оңай тотықпайтын молекулалар не иондар жатады. Мысалы: НО - , H 2 O, R-ОН, NН з , R-NH 2 , Сl - , F - , NO з - - S0 4 2-
... жалғасыЖұмсақ негіздер қатарына электртерістігі төмен, полюстегі жоғары, тотығуға оңай молекулалар не иондар жатады.
Мысалы, J - S 2- R-SH
-RS - +H +
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz