Атмосферадағы оттегінің эволюциясы және фотосинтез


Қазақстан Республикасы Білім және ғылым министірлігі
Семей қаласының Шәкәрім атындағы мемлекеттік университеті
СРО
Такырыбы: Атмосферадағы оттегі эволюциясы. Фотосинтез.
Орындаған: Есркенова А. Б
Тобы: Бл-209
Тексерген: Татенов А. Б
«Семей-2015»
Атмосфера
- жердің ауа қабығы. Атмосфера - ауа, химиялық қоспалар мен су буынан тұратын күрделі жүйе. Ол биосферадағы физико-химиялық және биологиялық процестердің жүріуінің шарты және метеорологиялық режимнің маңызды факторы. Атмосферадағы жекелеген құрамдастардың қатынасы оның радиатцияға, жылу және су режиміне, өздігінен тазартуға қабілетін анықтайды. Атмосфераның газдық құрамы, су буы және әр түрлі қоспалар жер бетіне күн радиациясының өту деңгейін және жер маңы кеңістігіндегі жылуды ұстап тұруды анықтайды. Егер атмосферада қоспалар болмаса, онда жер бетіндегі орташа жылдық температура +15º С емес, -18ºС болар еді. Атмосфераның орташа қалыңдығы - 150 км. Атмосфераның төменгі шекарасы жер беті болып табылады. Оның төменгі қабаты азот, оттегі мен сирек кездесетін көміртегінен, аргоннан, сутегіден, гелийден тағы басқа газдардан тұрады. Бұған су буы да араласады. Атмосфера түсінің көк болып келуі газ молекулаларының жарық сәуле шашуына байланысты. Жоғарылаған сайын атмосфера бірте-бірте сирей береді, қысымы төмендеп, оның құрылысы да өзгереді.
Оттегі (латынша Oxygenium), O - элементтердің периодты жүйесінің VI-тобындағы химиялық элемент. Реттік нөмірі 8, атом массасы 15, 999. Оттегі -химияның ең маңызды элементі және Жер бетіндегі көптеген тірі ағзалардың тыныс алуын қамтамасыз етеді. Оттегісіз біз бірнеше минут қана өмір сүре аламыз. Жасушалар мен талшықтар өмір тіршілігіне қажетті өздеріндегі энергияны босата отырып, органикалық заттарды тотықтыру үшін оттегіні пайдаланады. Оттегінің физиологиялық әсері өте көп қырлы, алайда, оның емдік әсерінде маңызды рөлді ағза талшықтардағы оттегі жетіспеушілігін орнына қайта келтіру қабілеті атқарады.
Адам ағзасының барлық мүшелері мен талшықтары қалыпты жұмыс істеуі үшін біздің айналамыздағы ауаның құрамында кем дегенде 21% таза оттегі болуы керек. Үлкен қала - бұл өте жылдам өмір ырғағы (біз күн сайын энергия жоғалтамыз), газдалған ауа (созылмалы гипоксия) ! Ірі мегаполис тұрғындарының оттегіне мұқтаждықтары орасан зор. Экологиялық ахуалдың жалпы деңгейде нашарлауы ірі қалаларда ауадағы таза оттегі мөлшері кейде 10-12%-дан артпауына алып келді. Осының салдарынан гипоксия (оттегі жетіспеушілігі) туындайды.
Оттегінің алынуы
Оттегін өнеркәсіпте ауаны қысып сұйылтады да, азот пен оттегінің қайнау температураларының айырмашылығына қарай буландырып бөліп алады. Осылайша алынған оттегі көгілдір түсті баллондарда сақталады, себебі сұйық оттегі ашық-көгілдір түсті болады. Ал зертханалық алу әдістері кейбір оттегіге бай күрделі қосылыстарды айыруға негізделген (8-сурет) .
- Тұрмыста жиі қолданылатын «марганцовканы» айыру. Ол үшін құрғақ сынауыққа аздаған түйірлерін салып, оның аузын газ шығатын түтігі бар тығынмен жауып қыздырамыз. Сонда мына реакция жүреді:
Шоқтанған шырпыны түтіктің аузына апарсақ, ол лап етіп жанады, себебі оттегі жануды қолдайтынын сендер бұрыннан білесіңдер.
- Калий хлоратын айыру. Бұл реакцияның жүруін тездету үшін марганец (IV) диоксидін (өршіткі) қосамыз, сонда оттегі көп мөлшерде бөліне бастайды:
Өршіткі - реакцияның жылдамдығын өзгертетін, бірақ өзі жұмсалмайтын зат (МnO 2 - өршіткі (катализатор) ) .
Бөлінген оттегін екі әдіспен жинауға болады.
- Ауадан сөл ауыр болғандықтан (Мr(O2) =32, Мr(ауа) =29) ауаны ығыстыру арқылы (8, а-сурет) .
- Суда нашар еритіндігінен суды ығыстыру арқылы жинау (8, ә-сурет) .
Оттегін сынап (II) оксидін (HgO) айырып ағылшын ғалымы Д. Пристли алған (1774) .
Газдарды зертханада жинайтын құрал газометр деп аталады. Ол қалың қабырғалы шыныдан жасалған екі бөлімнен тұратын ыдыс, оның сол жағында табанына жақын жерде (1) және оң жақ иығында (2) тығындалатын екі тесігі бар. Ал үстіңгі бөлігі (тубус) ұзын түтікті құйғы сияқты болып жасалған, ол астыңғы бөлігіне кигізілген. Оған газ жинау үшін тубустың шүмегін (А) ашып сумен толтырамыз. Одан кейін тубустың шүмегін жауып, астыңғы тығынға кигізілген шүмекті ашамыз да, осы жерден оттегін жібереміз, ол суды ығыстырып шығарады. Газды жинап болғаннан кейін астыңғы шүмекті жабамыз. Тәжірибеге оттегі керек болғанда тубустың шүмегін ашамыз, одан аққан су оттегін ығыстырады, ол жоғары оң жақ, иықтағы шүмектен (Б) шығады, оны бір ыдысқа жинап алу керек (9-сурет) .
Оттегінің қасиеттері
Физикалық қасиеттері
Оттегі (O 2 ) түссіз, суда аз еритін (20°С-та судың 100 көлемінде 3, 1 көлем O 2 ериді) газ күйіндегі зат. Қалыпты жағдайда (0°С, 1 атм=101, 3 кПа) 1 л оттегінің салмағы 1, 43 г, ал 1 л ауа - 1, 29 г болады.
Химиялық қасиеттері
Оттегі қыздырған кезде көптеген заттармен әрекеттеседі, бұл үдеріс жану деп аталады, ол жылу мен жарықты бөле жүреді.
Жай заттармен әрекеттесуі
Бейметалдармен әрекеттесуін көру үшін оттегі толтырылған сынауыққа көмірдің түйірін салсақ, ол жарқырап жана бастайды (10-сурет) :
С + O 2 = СO 2
Түзілген көмір қышқыл газын әк суына жіберсек оның лайланатыны сендерге белгілі. Бұдан басқа күкірт, фосфор, т. б. бейметалдар да оттегінде жанады (11-сурет) :
S + O 2 = SO 2
4Р + 5O 2 = 2Р 2 O 5
Кейбір металдар да оттегінде жанып оксидтер түзеді. Мысалы, оттегімен толтырылған сынауыққа магний ұнтақтарын сепсек, оның жарқырап жанғанын көруге болады.
2Mg + O 2 = 2МgО
Болат сымның ұшына кішкентай көмір түйірін шаншып алып, оны тұтатып оттегімен толтырылған ыдысқа салсақ жанған көмірден бөлінген жылудың әсерінен темір жана бастайды (12-сурет) .
ЗFе + 2O 2 = Fе 3 O 4 (FеO•Fе 2 O 3 )
Элементтер оттегімен әрекеттесіп оксидтер түзеді, бұл тотығу үдерісі.
Оксидтер дегеніміз молекула құрамы екі элементтен тұрып, оның бірі оттек болатын күрделі заттар.
Оксидтерді атағанда элемент таңбасынан кейін жақшаның ішіне валенттілігі көрсетіледі де оксиді деген сөз қосылады. Мысалы, SO 2 - күкірт (IV) оксиді, SО 3 күкірт (VI) оксиді. Халықаралық номенклатура (атау әдісі) бойынша оксидтердің құрамындағы элемент атомдарының сандары грек сандарымен көрсетіліп аталады: CO - кеміртек монооксиді, СО 2 - көміртек диоксиді, МnO 2 - марганец диоксиді, Мn 2 O 7 - димарганец гептаоксиді.
Күрделі заттармен әрекеттесуі
Кейбір күрделі заттар да оттегінде жанып оксидтер береді, мысалы, тамақ пісіргенде ас үйдегі газ пешінде қолданылатын пропанның (С 3 Н 8 ) жануы:
С 3 Н 8 + 5O 2 = ЗСO 2 + 4Н 2 O
Автогендік әдіспен металдарды кесу мен жалғауда мына реакция жүреді:
2С 2 Н 2 + 5O 2 = 4СO 2 + 2Н 2 O
Металлургия өндірісінде өртеу пештерінде күрделі заттардың тотығу реакциялары жүреді:
2ZnS+3O 2 = 2ZnO + 2SO 2
Cu 2 S + 2O 2 = 2CuO + SO 2
Сонымен, оттегі жай және күрделі заттармен әрекеттескенде жану реакциялары жүріп, нәтижесінде әр түрлі оксидтер түзіледі.
Оттегінің табиғаттағы айналымы және қолданылуы
Табиғатта оттегі негізінен фотосинтез нәтижесінде түзіледі, ол жапырақтарда және теңіз балдырларында жүретін үдеріс.
6СO 2 + 6Н 2 O → С 6 Н 12 O 6 + 6O 2 ↑
Осы оттегімен адамдар мен жануарлар тыныс алады, одан басқа жер қыртысындағы минералдар түзіледі. Табиғатта оттегінің қатысуымен тоттану, шіру, aшy сияқты бүліну үдерістері де жүріп жатады. Оттегінін, атмосферадағы қоры 1, 5•10
15
т, оның 1•10
10
тоннасы жану үшін жұмсалады. Тыныс алу жеке ағзаның өмірі үшін, ал шіру - эволюция (даму) үшін маңызды үдерістер.
Оттегінің қолданылуы оның қасиеттеріне негізделген, ол мына 4, 5-сызбанұсқаларда көрсетілген.
Оттегінің аллотропиялық түр өзгерістері. Озон
Оттегі табиғатта екі түрлі жай зат күйінде кездеседі, оның бірі O 2 , екіншісі O 3 , ол озон деп аталады. Енді озонмен жете таныссақ, озон найзағай ойнағанда ауада пайда болады. Сонда электр заря- дының әсерінен мына реакция жүреді:
3O 2 → 2O 3
Бір элементтің бірнеше жай зат күйінде болу құбылысы аллотропия деп аталады.
Озонның формуласы О 3 , салыстырмалы молекулалық массасы 48, оттегінен 1, 5 есе ауыр (48 : 32 = 1, 5), суда аз еритін, -112°С-да қайнайтын, -193°С-да балқитын газ күйінде қою-көк түсті, ал қатты күйінде көктен қара-күлгін түске дейін боялады.
Озонның химиялық қасиеттері
Озон оттегіне қарағанда химиялық белсенді зат. Ол тіпті алтын, күміс, платина сияқты асыл металдарды да тотықтыра алады (7-кесте) .
6Ag + O 3 = 3Ag 2 O
Нөсер жаңбырдан кейін орманға барсақ, онда ауа тазарып дем алу жеңілдейді, себебі ауада пайда болған озон айырылып, ауаны тазартады. Озонның атмосферадағы мөлшері өте аз - 0, 004%.
О 3 → O 2 + "О"
Озоннан молекулалық және атом күйіндегі оттек бөлінеді, соңғысы күштірек тотықтырғыш, ауадағы бактерияларды жояды. Озон осы қасиетіне қарай ауыз суды, құдыктарды, өндірістік сарқын суларды тазарту үшін (залалсыздандыру) және ағартқыш зат ретінде қолданылады. Атмосфераның жоғары қабатында, жерден 25 км биіктікте (стратосферада) күн сәулесінің әсерінен жерді қорғап тұратын өте жұқа озон қабаты әр түрлі кері әсерлердің салдарынан «тесіліп», сол жерлерден күннің ультракүлгін сәулелері жер бетіне жетіп, ондағы әр түрлі табиғи апаттарға әкеліп соғады. Олар: жер бетінің температурасының біртіндеп артуы, мәңгілік мұздақтар мен мұхиттардағы мұзтауларының еруі, терінің қауіпті ісігі көбейеді. Озонды зертханада озонатор деп аталатын құралда алуға болады.
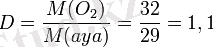 ) түссіз, иіссіз, суда нашар еритін газ (20°С-да судың 100 көлемінде оттегінің 3 көлемі, ал 0°С-да 5 көлемі ериді. Тыныс алу, жану, тотығу, шіру үдерістеріне қатысады.
) түссіз, иіссіз, суда нашар еритін газ (20°С-да судың 100 көлемінде оттегінің 3 көлемі, ал 0°С-да 5 көлемі ериді. Тыныс алу, жану, тотығу, шіру үдерістеріне қатысады.
Фотосинтез - жоғары сатыдағы жасыл өсімдіктердің, балдырлардың, фотосинтездеуші хлорофилл және басқа дафотосинтездік пигменттер арқылы күн сәулесі энергиясын сіңіруі нәтижесінде қарапайым қосылыстардан (көмірқышқыл газы, су) өздерінің және басқа организмдердің тіршілігіне қажетті күрделі органикалық заттар түзуі. Фотосинтез нәтижесінде жер жүзіндегі өсімдіктер жыл сайын 100 млрд т-дан астам органикалық заттар түзеді (мұның жартысынан көбін теңіз, мұхит өсімдіктері түзеді) және бұлкезде олар 200 млрд-тай СО2 сіңіреді, оттегін бөледі.
Фотосинтезді алғаш зерттеушілер Швейцария ғалымдары Ж. Сенебье, Н. Соссюр және неміс химигі Ю. Майер болды. 19 ғасырдың 2-жартысында К. А. Тимирязев күн сәулесі энергиясы фотосинтез процесінде хлорофилл арқылы сіңірілетінін анықтады. 20 ғасырдың басында фотосинтездің физиологиясы мен экологиясына арналған маңызды зерттеулер жүргізіледі (В. В. Сапожников, С. П. Костычев, В. Н. Любименко, А. А. Ничипорович т. б. ) . 20 ғасырдың орта кезінен бастап фотосинтезді зерттеуде жаңа әдістер (газ анализі, радиоизотопты әдіс спектроскопмя. Электрондық микроскоп т. б. ) дамыды. Жоғары сатыдағы жасыл өсімдіктер, балдырлар (көп жасушалы жасыл, қоңыр, қызыл, сондай-ақ бір жасушалы эвглена, динофлагеллят, диатом балдырлар) фотосинтезінде сутек доноры және шығарылатын оттек көзі су, ал сутек атомның негізгі акцепторы және көміртек көзі - көмірқышқыл газ. Фотосинтезге тек СО2 мен Н2О пайдаланылса углевод түзіледі. Фотосинтез процесіне өсімдік углевод түзумен қатар құрамында азоты және күкірті бар аминқышқылдарын, белок, молекуласы құрамында азот болатын хлорофилл де түзеді. Бұл жағдайда көмірқышқыл газбен қатар сутек атомының акцепторы және азот, күкірт көзі нитрат және сульфат болады. Фотосинтездеуші бактериялар молекула оттекті пайдаланбайды, оны бөліп шығармайды (бұлардың көбі анаэробтар) . Бұл бактериялар су орнына донор ретінде электрондарды не органикалық емес қосылыстарды (күкіртті сутек, тиосульфат, газ тәрізді сутекті) немесе органикалық заттарды (сүт қышқылы, изопропил спиртін) пайдаланады.
Фотосинтез аппаратының негізі - жасуша ішіндегі органелла-хлоропластар (көк жапырақ жасушасында 20-100 болады) . Балдырлардың көпшілігінде фотосинтездік аппарат - жасуша ішіндегі арнайы органелла-хроматофорлар, ал фотосинтездеуші бактериялар мен көк-жасыл балдырларда тилакоидтер. өсімдік фотосинтез процесінің негізі - тотығу-тотықсыздану. Мұнда квант энергиясы әсерінен 4 электрон мен протон су дәрежесінен (оның тотығуы) углевод дәрежесіне дейін көтеріледі. (СО2-ның тотықсыздануы) . Сөйтіп углеводтар фотосинтезі былай өтеді: СО2+Н2О С(Н2О) +О2+120 ккал/моль яғни СО2-ның бір молекуласының углевод дәрежесіне дейін тотықсыздануының бос энергиясы 120 ккал/моль болады. Демек, өсімдік фотосинтезі кезінде кем дегенде 3 квант («қызыл» кванттар энергиясы 40 ккал/моль) сіңірілуі қажет. әр түрлі жағдайда жасалған тәжірибе СО2-ның әр молекуласының тотықсыздануына 8-10 квант қажет екенін көрсетті. Көмірқышқыл газ да, су да, жарықты тікелей сіңірмейді, бұл қосылыстардың квантпен байланысқа түсуін хлоропласт не хроматофор структурасындағы хлорофилл а қамтамасыз етеді. Фотосинтездің биосферадағы маңызы да үлкен. Жер жүзіндеге, мысалы, көміртек, суттек, оттек, сондай-ақ N, S, P, Mg, Ca т. б. элементтер айналымы процесіне қатысы бар. Жер қалыптасқаннан бері фотосинтез нәтижесінде маңызды элементтер мен заттар бірнеше мың рет толық цикл айналымынан өткен. өсімдік өнімін арттырудың бір жолы - өсімдіктің фотосинтездік әрекетін үдету. Бұл үшін жапырақ көлемін үлкейту, жапырақ тіршілігін ұзарту, егістіктегі өсімдік жиілігін реттеу керек. СО2, ауа, су, топырақтағы қоректік элементтер жеткілікті болуы қажет. Фотосинтез аппаратының активтілігі жапырақтың анатомиялық құрылысына, фермент жүйесі активтілігіне, көміртек метабализмі типіне байланысты болады. өсімдік селекциясының, яғни СО2 ассимиляциясы тез жүретін өсімдік сорттарын шығарудыңда үлкен маңызы бар.
Автотрофты және гетеротрофты жасушылар.
Пластикалық (анобализм) алмасу сипатына сәйкес табиғаттағы барлық жасушалар екі топқа бөлінеді. Хлорофилі бар өсімдік жасушаларының тірі табиғат үшін маңызы өте зор, себебі онда өзіне тән ерекше әрекеттер (процестер) жүріп жатады. Ол әрекеттер фотосинтез деген атпен ғылымға әйгілі. Фотосинтез дегеніміз күн сәулесі энергиясын химиялық байланыстар энергиясына айналдыратын күрделі механизмді әрекет.
Тынысалу және фотосинтез.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz