Калориметрлік әдістер және органикалық қосылыстардың термодинамикалық қасиеттерін зерттеу


Жоспар:
I. Кіріспе
II. Негізгі бөлім
- Калориметр туралы жалпы мәлімет
- Калориметрлер классификациясы мен құрылысы
- Адиабаттық калориметрлер
- Калориметрлердің жұмыс істеу принципі
- Кальве калориметрі
- Калориметр градуировкасы
III. Қорытынды
Пайдаланылған әдебиеттер тізімі
Кіріспе
Қазіргі қоғамның даму жылдамдығы үнемі артып отырады. Өндірістің әртүрлі салалары технологияландырылуда, ғылым тәжірибелік мәндерді алу үшін ғана емес, оларды өңдеуде қолданылатын жетілген жаңа мәселелермен тоғысуда.
Органикалық заттар химиясы - органикалық синтездің «құрылыс блогы» - қарқынды даму жолында. Жоғары реакциялық қабілетке ие болғандықтан озық технология, медицина және ауыл шаруашылығы үшін ғылыми химиялық өнімдер өндірісінде химиялық дамудың заманауи үрдісіне жауап береді.
Органикалық синтез саласында ғалымдардың негізгі назары пайдалы қасиеттері алдын-ала белгілі заттардың технологиялық тиімді тәсілдерін табу және өңдеу сияқты мәселелерді шешуге аударылған. Көптеген жылдар бойы органикалық заттардың қасиеттерін анықтауға арналған зерттеулер маңызды болып келеді, себебі олардың синтетикалық мүмкіндігі мен болашағы зор және тәжірибелік қолдану салалары да кең. Мысалы, органикалық заттар түрлі биологиялық белсенділікке ие және олар полиэфирлі антибиотиктердің (монексин және А 231187 антибиотигі), полиацетиленді көмірсутектердің, бактерицидтік препараттардың және сұйық кристаллды заттардың синтезінде интермедиаттар болып табылады.
Сонымен бірге, органикалық қосылыстарды реакциялық қабілеттілігі жоғары полимерлер мен олигомерлердің, жылуға және қыздыруға тұрақты материалдардың синтезінде кеңінен қолданады. Органикалық полимерлер синтезінде қолдану бағалы қасиеттерге ие полимерлер алу саласында үлкен бетбұрысқа әкелді.
Органикалық қосылыстардың қасиеттерін анықтау бұрыннан белгілі болғанымен және бұл салада көптеген ғалымдардың зерттеулері жүргізілгеніне қарамастан, олардың қасиеттерін құрылымына ұштастыра отырып зерттеу, олардың алынуы, химиялық қасиеттері сияқты термодинамикалық қасиеттерін анықтау маңызды болып саналады.
Органикалық қосылыстар алдағы синтетикалық айналулардың маңызды қосылыстары болып табылады. Олар қатысатын көптеген синтездер белгілі. Осы синтездердің негізгі кинетикалық және термодинамикалық өлшемдерін қарастыруда калориметрлік әдіс ерекше орын алады.
Құрылысы теориялық және тәжірибелік мәніне әсер ететін болғандықтан, олардың физико-химиялық қасиеттеріне, көбінесе термодинамикалық қасиеттеріне де әсер етеді. Сондықтан калориметрлік әдіс арқылы зерттеудің маңызы зор.
Қурстық жұмыстың зерттеу мақсаты. Фундаментальді термодинамикалық қасиеттеріне (жылусыйымдылық, энтропия, энтальпия Гиббс функциясы) сүйене отырып органикалық заттардың физико-химиялық қасиеттері мен құрылысын байланыстыратын әдістемелерді ұсыну.
Сонымен бірге, органикалық қосылыстардың қарапайым элементарлы процесстер механизмдерінің квантты-химиялық есептеулерін жүргізу.
Зерттеудің негізгі әдісі - калориметрлік әдіс. Бұл әдіс әртүрлі физикалық, химиялық және биологиялық процестер кезінде денелерден бөлінетін немесе олардың қабылдайтын жылу мөлшерін анықтауға негізделген.
Соңғы жылдары квантты-химиялық есептеулер қолжетімділігі және нақтылығымен ерекшеленеді. Қолданбалы квантты-химиялық есептеулерді орындау молекулалық орбитальдар теориясын білуді, мамандандырылған программаларда жұмыс жасауды және есептеулер нәтижесінен маңызды мәліметтерді алуды талап етеді.
Калориметрияда қолданылатын аппараттар мен өлшеу әдістері әртүрлі болып келеді, себебі калориметрлік тапсырмаларды шешу зерттеліп отырған процеске және оны өткізу шарттарына сәйкес орындалады. Осы немесе басқа процестерде бөлінген (немесе сіңірілген) жылу мөлшерін анықтау арнайы құрылғы - калориметрде жүргізіледі. Өлшеуге тиісті барлық жылу таралатын калориметр бөлшектерінің жиынтығы калориметрлік жүйе деп аталады. Ережеге сәйкес калориметрлік өлшеу тәжірибе кезіндегі калориметрлік жүйенің температурасын бақылаудан тұрады. көп жағдайларда «калориметрлік жүйе» сөзін қысқарту мақсатында «калориметр» терминін қолдану енгізілген. Осыған байланысты ол екі мағынада да қолданылады. Құралдардың, калориметрлік әдістердің көптүрлілігіне байланысты калориметрлердің толық классификациясын атау мүмкін емес. Сондықтан калориметрия негіздерін қарапайым және көп қолданысқа ие калориметрлер құрайды. Оларды, көбінесе, белгісіне, температураның жұмыстық интервалына, реакциялық камера санына және т. б. байланысты ажыратады.
Негізгі бөлім
Калориметрлік өлшеу әдістері
Калориметр туралы жалпы мәліметтер
Калориметрияда қолданылатын аппараттар мен өлшеу әдістері әртүрлі болып келеді, себебі калориметрлік тапсырмаларды шешу зерттеліп отырған процеске және оны өткізу шарттарына сәйкес орындалады. Осы немесе басқа процестерде бөлінген (немесе сіңірілген) жылу мөлшерін анықтау арнайы құрылғы - калориметрде жүргізіледі. Өлшеуге тиісті барлық жылу таралатын калориметр бөлшектерінің жиынтығы калориметрлік жүйе деп аталады. Ережеге сәйкес калориметрлік өлшеу тәжірибе кезіндегі калориметрлік жүйенің температурасын бақылаудан тұрады. көп жағдайларда «калориметрлік жүйе» сөзін қысқарту мақсатында «калориметр» терминін қолдану енгізілген. Осыған байланысты ол екі мағынада да қолданылады. Құралдардың, калориметрлік әдістердің көптүрлілігіне байланысты калориметрлердің толық классификациясын атау мүмкін емес. Сондықтан калориметрия негіздерін қарапайым және көп қолданысқа ие калориметрлер құрайды[1-3] . Оларды, көбінесе, белгісіне, температураның жұмыстық интервалына, реакциялық камера санына және т. б. байланысты ажыратады. Калориметр, ережеге сай, өлшенетін жылу құбылыстары өтетін түтікше. Осы түтікшеде бөлінетін немесе сіңірілетін жылу калориметр температурасының өзгеруін тудырады. Нәтижесінде ішкі сыртқы жылу алмасу процесі жүреді. Жылу алмасу калориметрлік түтіктің беткі бөлігі (ішкі қабықша) мен қуыстың беткі бөлігі (сыртқы қабықша) арасында жүреді. Екі қабықша арасында орнатылатын жылу ағыны W неғұрлым көп болса, соғұрлым температуралар айырымы DT мен ортаның жылуөткізгіштігі L жоғары болады.
Тұрақты температура режимінде
W = L·DT
Ом заңын еске түсіретін бұл теңдеуде L қолданыстағы прибордың негізгі қасиетін көрсетеді және калориметрдің әртүрлі классификациясы үшін қолданылады. Әсіресе, калориметрлер жұмысының жылу шарттары олардың классификациясының ортақ белгісі болып саналады.
Калориметрлер классификациясы мен құрылысы
Осы тұрғыдан және калориметрия және микрокалориметрия бойынша жұмыстар анализдерін қорытындылау тұрғысынан қарасақ, калориметрлердің кң таралған келесі түрлері белгілі [4, 5] : адиабаттық, изотермиялық (тұрақты температурада), диатермиялық (ауыспалы температурада), жылу өткізетін және ағынды (өлшеудің жылу шарттары және реакциялық камераның сыртқы ортамен байланысуы бойынша) .
Адиабаттық калориметрлерде реакциялық камера (калориметрлік жүйе) мен сыртқы орта арасында жылуалмасу болмады (немесе минималды) .
Бұл жағдайда ішкі және сыртқы қабықша бір-бірінен термиялық изолятормен ажыратылған, сол себепті калориметр жылу өткізбейді. Мұндай шартта тәжірибе басында бөлінген жылу Q іс жүзінде калориметрдің ішіндегі құраушыларды жылытуға жұмсалады. Тәжірибе соңында калориметр температурасы бастапқыдан DT жоғары болады және Q = C·DT. Мұнда, С - калориметр жылу сыйымдылығы. Бұл құрал тәжірибе кезінде бөлінетін барлық жылу мөлшерін қосатын интегратор болып табылады: реакция жылуы, механикалық араластыру, булану және т. б. жылуалмасудың минималды шартын қамтамасыз ету үшін реакциялық камера мен калориметрдің сыртқы қабықша аралығын вакуумдейді. Бұл жағдайда бір немесе бірнеше қамтитын калориметрлік жүйе экранын пайдалану тиімді болып келеді. Өлшеу процесі кезіндегі температура калориметрлік жүйенің сыртқы бетіндегі температурамен бірдей ұсталынады. Температура теңдігін температуралар айырымы мен электрлік жылытқыш және терморегулятор көмегімен бақылап отырады. Іс жүзінде адиабаттық қабықшалар негізінен қоршаған ортаның төмен температурасында қолданылатын Дьюар түтікшелерімен жабдықталған. Бірақ олар бірнеше сағатқа созылатын тәжірибелерде пайдаланылмайды; сонымен қатар, Дьюар түтікшелерінің жылусыйысдылығы тәжірибе ұзақтығына қарай таңдалады.
Алғаш рет француз ғалымы Персон ұсынған (1849) адиабаттық әдіс тәжірибеге Ричардспен енгізілген (1905) және ол қазіргі уақытқа дейін пайдаланылады. Бірақ адиабаттық калориметрлер жоғары инерцияға ие және өткізілетін тәжірибе уақытында өзгеретін температураға функцияланады. Нәтижесінде қалыпты жағдай үшін бөлінген жылудың нақты ритмін шығару қиын болады.
Изотермиялық калориметрлерде калориметр жылуөткізгіштігі L өте жоғары және жылу калориметрде жинақталмайды да, сыртқы ортаға тез тарап кетеді. Бұл жерде температуралар айырымы DT өте аз. Оны өлшеу өте қиын әрі нақты емес. Сонымен қатар, оны есептеу аса маңызды емес. Бұл әдісте термометр емес бөлінген жылудың ағынға пропорционал мөлшерін өлшейтін құрал қолданылады. Изотермиялық калориметрлерде жылу мөлшерін өзінің агрегаттық күйін өзгерткен (балқыған қатты зат немесе буланған сұйықтық) заттардың санына байланысты анықтайды. Изотермиялық калориметрлер ұзақ процестің жылулық эффектісін анықта үшін кең қолданылады және арнайы тағайындауы бар. Аталған категориялы калориметрияға агрегаттық күйі өзгерген заттық мөлшері - энергия өлшемі болып табылатын калориметрлерді (мысалы, "мұздық" Бунзен калориметрі) жатқызамыз [1, 2] . Бірақ, осы типті калориметрге эндотермиялық жылу эффектісі электр энергиясына, ал экзотермиялық - Пельтье эффектісіне теңесетін калориметрлерді де жатқызуға болады. (сурет 1) .

Сурет 1. Әртүрлі типті калориметрлер сызбасы:
а) - жылуөткізетін Тиан-Кальве калориметрі. Бөлінетін жылудың көп бөлігі А зонасынан сыртқы қабықшаға калориметрлк түтікше қоршаған термопар арқылы өткізіледі. Термоэлектрқозғалғыш күшті жоғалған жылу қуаттарына пропорционал термобатареялары арқылы өлшейді.
б) - изотермиялық калориметр. Калориметрде бөлінетін барлық жылу тез балқитын заттардың белгілі мөлшерін балқытуға жұмсалады. Нәтижесінде алынған сұйықтықты жинайды және өлшейді. А - жылу бөліну зонасы; В - айырғыш бөлшектер; С - жылуды жақсы өткізетін сыртқы блок; D - тез балқитын зат, мұз немесе басқалары; К - G ; Е - X =1% Y =99% X =0% Y =100% гальванометрмен байланысты термопарлар.
а) б) D градуирленген пробирка; X - калориметрлік камерада қалған жылу бөлігі; Y - сыртқы ортаға тараған жылу бөлігі.
Бунзеннің мұзды калориметрі - изотермиялық калориметрдің аяқталған типі саналады. 1б суретте изотермиялық калориметр - Бунзеннің мұзды калориметрі көрсетілген. Бұл приборда жүргізілген процесс жылуының әсерінен еріген мұздың массасын анықтайды. Тәжірибе басынан еріген мұздың салмағы бөлінген жылудың Q жалпы мөлшеріне сәйкес есептеледі. Егер тәжірибе 0°С температурада жүргізілетін болса, онда Бунзен аппаратында қолданылатын мұз басқа тез балқитын затпен алмасуы мүмкін. Метьюз типті изотермиялық калориметрінде бөлінетін жылу Q, 349. 66±0. 05 К қалыпты қайнау температурасында буға айналған төртхлорлы сутегінің массасымен анықталады. Юнкерс типті приборда калориметрден бөлінетін жылуды сіңіру үшін су ағыны пайдаланылады. Осы кезде енгізілген және шығарылған судың температуралар айырымы ескеріледі. Өкінішке орай, Бунзен, Метьюз немесе Юнкерс типті приборлар қолдануға тиімсіз болып саналады. Сонымен бірге, ағынды калориметрлер көлдік әдісті қанағаттандырмайды және қосалқы тексерісті талап етеді: сйықтықтар шығыны және екі температураның айырмашылығы. Бұдан басқа, изотермиялық және жартылай изотермиялық калориметрлер прибор-осциллографтарда жарамайтын аса үлкен термиялық инерттілікті көрсетеді. Шынында да, мұздың балқуы, ал ағынды әдістерде орнатылатын тепе-теңдік жай жүретін процесс.
Диатермиялық (ауыспалы температуралы) калориметрлерде жылу мөлшері калориметрлік жүйе температурасының өзгеруімен анықталады. Әдетте, мұнда калориметрлік түтік немесе блок белгілі бір ұяшықта орналасады. Ол температура реттегішінің ортасында орналасады. Калориметрлік жүйені қоршайтын құралдар калориметрдің қабықшасын құрайды. Ауыспалы температуралы калориметрлерді жұмыс жасау режимі бойынша екіге бөлуге болады: изотермиялық қабықшалы және адиабатикалық қабықщалы калориметрлер. Калориметрдің сыртқы ортамен жылу алмасу есебі өлшеу жүргізу режимімен анықталады. Мұндай типті калориметрлерге кондуктивті микрокалориметрлерді жатқызуға болады. Онда реакциялық камера мен термостат арасында жылуөткізгіштік коэффициенті белгілі зат немесе датчик орналасқан.
Дифференциалды сканирлеуші калориметрлер (ДСК), негізінен, ауспалы температуралы, үздіксіз энергия енгізіліп отыратын, адиабатикалық режимде жұмыс жасайтын калориметр типіне жатады. Соңғы кезде ДСК кең қолданысқа ие болды, соған байланысты көп көлемде аспап жасаушы өндірісте шығарады және оны калориметрлік құралдың қарапайым түріне жатқызады.
Жылу өткізгіш калориметр немесе Кальве калориметрі сонымен қатар калориметрлердің арнайы типіне жатқызады. Оларда реакциялық камералар (екі немесе үш) дифференциялды қосылған термобатареялармен қоршалған (сур. 1а) . Калориметр жұмысы термоэлектроқозғаушы күшті өлшеуге негізделген. Термоэлектроқозғаушы күш термобатареяда реакциялық камерадан термостаттың калориметрлік блогына жылу ағынының өту кезінде пайдаболады. Мұнда калорметрлік реакциялық камераның температурасы аздап өзгереді, бірақ бұндай калориметрлерді диатермиялық немесе изотермиялық деп атауға болмайды. Сондықтан осындай типті калориметрлер жылу ағынды калориметрлер деп аталады [6] .
Ағынды калориметрлерде (ереже бойынша оларға микрокалориметрлер жатады) жылу эффектісі қыздыру немесе суыту үшін реакциялық камерадан алынатын газдың немесе сұйықтықтың белгілі салыстырмалы жылусыйымдылығымен анықталады.
Жоғарыда келтірілген негізгі калориметрлердің типтеріне қысқаша мәлімет олар туралы толық ақпарат бермейді, бірақ кең таралған калориметрлер болып саналады. Кейбір калриметрлердің типтерін осы әдібиеттерден қарауға болады [1- 6] .
Ғылыми термохимиялық зерттеулердің ерекшелігі мынады, зертханалық тәжірибеде - ауыспалы температуралы калориметрлер кең қолданылады [3] . Ауыспалы температуралы калориметрлер өлшемі, құрылымы, белгісі және т. б. бойынша бірнеше типке бөлінеді.
Сұйықтықты калориметрлердің негізгі бөлігі болып оның калориметрлік түтікшесі табылады. Ол сұйықтықпен толтырылған және зерттеулер үшін реакциялық камераны орналастырады. Егер зерттеу бөлме температурасында өткізілетін болса, онда, сұйықтық ретінде кәдімгі су алынады. Сулы еріткіштер мен оргаикалық сұйықтықтар сирек жағдайларда қолданылады.
Массивті немесе анероидты калориметрлерде энергияны өлшейтін орта ретінде массивті блок алынады. Ол жоғары температураға тұрақты металдан (әдетте, мыс, алюминий немесе күміс) жасалады. Массивті калориметрлер жоғары температуралы химиялық зерттеулерде көп пайдаланылады.
Сұйықтықты және массивті калориметрлер қос және дифференциалды болуы мүмкін. Қос калориметрлерде калориметрлік түтіктің біреуі ондағы процессті жүргізу үшін қолданылса, екіншісі энергияның белгілі немесе белгісіз мөлшерін салыстыруға арналған. Мысалы, жұмыс калориметрлік жүйеде химиялық реакция жүрсе, екінші жүйеде бірдей қыздыру жылдамдығына ие бола отырып электрлік токпен қыздырады.
Кең интервалды температурада заттардың жылусыйымдылығын өлшеуде қолданылатын калориметр-контейнерлер, сонымен бірге, ауыспалы температуралы калориметрлер типіне жатады. Калориметр-контейнер, әдетте, жұқақабатты металл түтікше болып келеді.
Калориметр градуировкасы
Калориметр градуировкасы энергия мөлшері арасындағы қатынасты орналастырудан тұрады. энергия мөлшері калориметрлік жүйеден алынады және онда күйі өзгереді (көбінесе температура, сирек - масса, көлем және т. б. ) . төменде калориметрлердің кейбір түрлерінің градуировкасына мысалдар келтірілген. Кең қолданысқа ие болғандықтан ауыспалы температуралы калориметрлер градуировкасына көп көңіл бөлінді.
Тәжірибе барысында ауыспалы температуралы калориметрлерде Q жылуды келесі формуламен анықтайды:
Q = W·DТ.
мұнда, W- калориметрдің жылулық мәні, DТ - температура өзгерісі.
Ескі калориметрлік жұмыстарда W калориметрдің жылулық мәнін калориметрлік жүйеге енетін заттың массасы мен жылусыйымдылығын анықтайтын. Ал қзіргі уақытта, бұл әдіс келесі себептер бойынша қолданылмайды. Біріншіден, әдісті толық білу үшін калориметрлік жүйені құрайтын барлық заттың жылусыйымдылығын нақты білу керек. Екіншіден, калориметрлік жүйе ешқашан оқшау жүйеде болмайды, сол себепті, ереже бойынша нақты шектеулерге ие емес. Сондықтан, W калориметрдің жылулық мәнін эмпирикалық анықтау W = Q кал /D Т кал теңдеуі бойынша анықталады.
Табылған W калориметрдің жылулық мәні калориметрлік жүйенің жылусыйымдылығын көрсетпейді (бірақ сол шамаға жақын), калориметрдің берілген шартында эффективті тұрақты шама болып саналады. Осындай айырмашылықты анықтау үшін W калориметрдің жылулық мәнін калориметрдің энергетикалық эквиваленті немесе жылулық мәні деп атайды. Егер, калориметрдің жылулық мәні табылса, онда D Т х мәнін өлшеп, процесстің қарастыратын жылуын анықтаймыз Q x = W·DТх = Q кал · (DТх /D Т кал) . Бұл теңдік W калориметрдің жылулық мәні тұрақты жағдайды дұрыс болып есептелінеді. Тәжірибе жүргізгенде калориметрлік жүйенің бастапқы және соңғы температуралар мәні жақын болғаны маңызды. Тәжірибе жүргізу шарттары да ұқсас болу қажет.
Qx мәнін есептеуде Тх/DТкал қатынасы қолданылады, калориметрлік жүйенің температурасын кез-келген бірлікте анықтауға болады. Мұндай бірліктер бола алады: термометр кедергісі, термобатарея, электр қозғаушы күші және басқалары. Тек таңдалған шартты бірлік жұмыс интервалында температураға пропорционал болу керек. Өлшеудің мұндай әдісі көбінесе салыстырмалы деп аталады. Яғни, белгілі және белгісіз жылу эффектілерін салыстыру жүргізіледі. Бұдан басқа, жоғарыда көрсетілген нұсқаулар орындалса, тәжірибе нәтижесіне әсер ететін келесі факторлар жойылады: кондуктивті жылуалмасу есебі, тәжірибе кезінде калориметрлік сұйықтықтың булануы және т. б.
Калориметрге қажетті энергияның мөлшерін жеткізу үшін (калориметрді калибрлеу) келесі екі әдістің біреуін қолданады:
- жұмсалған электр энергиясын нақты өлшеу арқылы калоримтерлік жүйені электр тогымен қыздырады (“Джоуль” жылуымен калибровка) ;
- жылу эффектісі нақты белгілі процессті калориметрде жүргізу (көбінесе химиялық реакция) .
Электр тогымен градуировка- ауыспалы температуралы калориметрлердің кең таралған әрі әмбебап градуировка әдісі. Осындай әдісті қолдану үшін, қазіргі заманғы калориметрлер электр қыздыру аспаппен жабдықталады. Калориметрге жеткізілген энергия көлемін келесі теңдеу анықтайды: Q = I 2· R · t,
мұнда, Q - энергия мөлшері, Дж; I - ток күші, А; R - қыздыру кедергісі, Ом; t - токты жіберген уақыт, сек.
Қазіргі уақытты, электр өлшемдері уақыт сияқты нақты өлшенеді. Әсіресе осы жағдай электрлік градуировканың кең қолданысын қамтамаыз етеді.
Электр тогымен градуировка температураның әртүрлі диапазонында жылусыйымдылықты анықтауда қолданылады. Ол үшін калориметр-контейнерді қыздырғыш көмегмен қыздырамыз. Тәжірибенің әр сатысында калориметрге енгізілген электр женргиясы мен калориметр температурасының өзгерісін өлшейды. Өлшеу зерттеудің барлық температуралар интервалында жүргізіледі. Егер бос контейнердің жылу мәні W белгілі болса, алынған мәліметтер бойынша контейнердің ішіндегі заттың жылусыйымдылығын есептейді. Бұл жағдайда калориметр гдадуировкасын есептеу температураның барлық интервалында осы шаманың есептеуіне әкеледі. Әдетте, бос контейнердің жылулық мәнін тікелей есептейді. Алынған W мәнін қандай температураға жатқызамыз? DТ шамасы неғұрлвм аз болған сайын (ереже бойынша, 1-3 К) DТ шамасының Wк температураның орташа интервалына жатқызамыз. Егер W - Т тәуелдігі түзу сызықтан ауытқыса, басқа сәйкес әдісер қолданылады [7] .
Градуировканы соңғы сатысына зерттеудің температуралар интервалына байланысты W - Т тәуелділігін орнықтыру жатады. Тәжірибе нүктелерінің саны температуралар интервалының әртүрлі бөліктерінде W мәнін таба алатындай мөлшерде болу керек. Тәжірибелік берілгендер мәнін сәйкес өңдеуден кейін орташа W мәнін графиктен немесе кестеден табады.
Кейбір жағдайларда градуировка кезінде бос калориметр-контейнердің жылу эффектісін емес, берілген температуралар интервалында жылусыйымдылығы белгілі затпен (бензой қышқылы, корунд және басқалары) толтырылған калориметр-контейнердің жылу мәнін есептейді.
Калориметрлердің жұмыс істеу принципі
Протолиттік реакциялар түсінігін қышқыл-негіздік әрекеттесу деп түсінеміз, онда Бренстед-Лоури қышқыл- негіздік теориясына сәйкес, қышқыл рөлін протон беретін қосылыстар, ал негіз рөлін протон қабылдағыш қосылыстар атқарады. Қарапайым протолиттік процестің элементарлы акты болып протондық ауысу кезеңі болып табылады. Белл бойынша, берілген жағдайда стериялық фактордың көптеген әсеріндегі протонның, және практикалық, әрекеттесуші бөлшектердің байланыстырушы электрондардың қайтабөлінуі жүрмегенде осы акттың элементарлығы элементарлық бөлшектің ауысуы болып табылады. Бірақ, берілген нақтылау күшті қышқылдардың сулы ерітінділері үшін қолданылатынын атап өту керек. Ал сулы емес ерітінділерде көбінесе протондық ауысу процесіне қарағанда аралық комплекстердің пайда болуы бірінші болады, және реакцияға деген стериялық талаптар айтарлықтай жоғарлайды және анықтаушы мәнге ие болады.
Протондық ауысуға қарағанда молекулааралық протондық ауысудың реакциясы күрделі әрекеттесу болып табылады. А. И. Бродский бойынша, протондық ауысу процесі «кооперативтік» механизмге ие. Яғни реакцияның жүру кезінде сутектік байланыс арқасында аралық циклдық комплекс түзіледі (СБЦК) (1) .
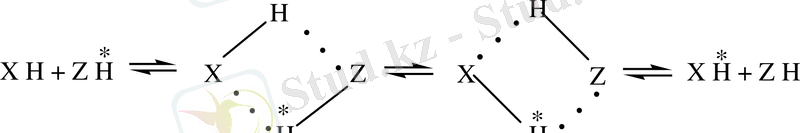
Қазіргі уақытта молекулааралық протондық ауысу кезінде СБЦК түзілудің қатал дәлелдері жоқ, бірақ оның болуы көптеген кванттыхимиялық есептеулердің нәтижесінде айқандалған болатын [19-21] . Протондық ауысудың жылдамдығы сұйықтықтардағы диффузия жылдамдығымен тең екені атап өтілген болатын, ол ауысу жылдамдығы реагенттердің қышқылдығына және сондый-ақ реакцияға қатысатын гетероатомдардың электродонорлық қабілеттілігімен байланысты болуымен түсіндіріледі [20] .
Протондық ауысудың механизміне қатысты басқа да болжамдар бар. Оның мәні -сызық типті СБК-ке екі электронды кезекті ауыстыруда.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz