Титан, магний, мыс және алюминий: қасиеттері, өндіру технологиялары мен қорытпалары


Қазақстан Республикасы Білім және ғылым министрлігі
Шәкәрім атындағы Семей мемлекеттік университеті
СРО
Тақырыбы: Титан және оның қорытпалары. Магний және оның қорытпалары. Мыс және оның қорытпалары. Алюминий және оның қорытпалары
Орындаған: Маукилов А. ТО-411
Тексерген: Тілеуғали Е. Т.
Семей қаласы 2015 жыл
Титан және оның қорытпалары
Титан (Tіtanіum), Tі - элементтердің периодтық жүйесінің IV тобындағы хим. элемент, атомдық нөмірі 22, атомдық массасы 47, 88. Табиғатта массалық саны 46 - 50 болатын 5 тұрақты және жасанды жолмен алынған 5 радиоактивті изотоптары бар. Титанды алғаш ТіО2 түрінде ағылшындық әуесқой-минеролог У. Грегор ашқан (1790) . 1795 ж. неміс химигі М. Г. Клапрот(1743 - 1817) Грегор тапқан “менакит” элементі металдың табиғи тотығы ТіО2 екендігін анықтады, ал таза күйіндегі титанды нидерландық зерттеушілер А. ван Аркел мен де Бур алды (1925) . Бос күйінде кездеспейді, тек оксидтер түрінде болады. Титан кең тараған элемент, жер қыртысындағы салмақ мөлшері 0, 57%. Құрамында титаны бар 70-тен астам минералдардың ішіндегі ең маңыздылары: рутил (оның түрөзгерістері анатаз бен буркит), ильменит, титаномагнетит, перовскит, лопарит, титанит (сфен), лейкоксен. Түсі күмістей ақ, созылғыш және берік; 882°С-тан төмен температурада кристалдық торы гексагональды тығыз жинақталған (°-Ті), одан жоғары - кубтық көлемді орталықтандырылған (°-Ті) ; тығызд. 4, 505 г/см3 (°-Ті) және 4, 32 г/см3 (°-Ті), балқу t 1668°С, қайнау t 3330°С. Титан химиялық активті ауыспалы элемент, тотығу дәрежесі +4, сирек +3, +2. 500 - 550°С-қа дейінгі температурадаметалл бетінде оксид қабаты пайда болатындықтан ауада, теңіз суында, ылғал хлорда, хлоридтер мен азот қышқылы ерітінділерінде, күкірт қышқылы мен сілтілердің сұйытылған ерітінділерінде коррозияға тұрақты. Бөлме температурасында HCl, H2SO4, CCl3COOH, HCOOH, қыздырғанда оттек (400 - 500°С), азот (600°С-тан жоғары), көміртек және кремниймен (1800°С-тан жоғары) әрекеттесіп, сутек және басқа да ауа газдарын өзіне сіңіреді. Фтормен 150°С-та, хлормен 300°С-та, иодпен 550°С-та әрекеттесіп, сәйкес галогенидтерін түзеді. Бор, көміртек, селен, кремниймен әрекеттесіп, металға ұқсас қосылыстар түзеді. Титан қосылыстарының балқуы қиын, өте қатты, түстері әр түрлі болып келеді. Титанды өндірісте кентас концентраттарын хлорлап, алынған TіCl4-ті магниймен (кейде натриймен) тотықсыздандырып, титан кірмесін (губка) алады. Оны вакуумдық доғалы пештерде балқытып, кесек металл алынады. Титан авиация, зымыран, кеме, автомобиль жасауда қолданылатын беріктігі жоғары титан құймаларын (Al, V, Mo, Mn, Cr, Sі, Fe, Sn, Zr, Nb, т. б. ) дайындауға және радиоэлектроникада, тамақ, шарап, қағаз, бояу өнеркәсіптеріне қажетті аспаптар мен қондырғылар жасауда кеңінен қолданылады.
Негізі титан болатын Қорытпалардың техникалық титаннан айырмашылығы - олардың беріктігінің, қызу мен коррозияға төзімділігінің жоғары болуында және тығыздығының аздығында; титан Қорытпалары авиацияда, ракета техникасында, кеме жасауда, химияда және басқа да өнеркәсіп саласында кеңінен қолданылады. Титан Қорытпалары дыбыстан жылдам ұшатын ұшақтардың сыртын қаптауда, реактивті қозғалтқыш құралымдар тетіктерін, ракета қозғалтқыштарының екінші және үшінші сатысының корпустарын, сығылған және сұйытылған газдарға арналған баллондар және шар баллондар жасау, теңіз кемелерін, сүңгуір қайықтарды және торпедоларды қаптау, т. б. жасау үшін қолданылады. Қорғасын немесе қалайы негізінде дайындалатын антифрикц. Қорытпалар баббиттер деп аталады. Қорытпалардың қасиеті олардың химиялық құрамы мен құрылымына, яғни қорытпа фазаларының өзара әсерлесуі мен араласуына тікелей тәуелді. Қорытпалар, негізінен, екі немесе бірнеше қатты фазалардан құралған біртексіз қоспалар және жалғыз ғана қатты фазадан тұратын біртекті Қорытпалар болып екі түрге бөлінеді. Біртекті Қорытпалар қатты ерітінділерге және химиялық қосылыстарға ажыратылады (қ. Қатты ерітінділер) . Екі немесе көп фазадан тұратын эвтектик. (жеңіл балқитын) Қорытпалар электрлік қорғауыштар, дәнекер, баббит жасауға, т. б. мақсаттар үшін пайдаланылады.
Титан жеңіл, өте берік, жемірілмейтін металл. 10 жыл бойы теңіз суында жатқан титан табақшасының ешбір өзгеріссіз қалғандығы туралы дерек белгілі. Титаннан реактивті ұшақтардың двигательдері, кемелер мен сүңгуір қайықтардың кораптары мен химиялык құрал-жабдықтар шығарады.
Металды титан кендерінен (кұмнан) алады. Біздің елімізде онын, 3 кен орны бар. Сәтбаев байыту фабрикасының концентраты қазірдің өзінде өңделуде.
Титанды магниймен тотықсыздандырады. Сондықтан осы металдар өндірісін бір кәсіпорында - комбинатта біріктіреді. Титан-магний комбинаты Өскемен қаласында жұмыс істейді. Ол - әлемдегі өзі сияқты кәсіпорындардың ішінде қуаты жағынан ең ірісі. Комбинаттың ең негізгісіне - титан өндіру жатады.
Магний және оның қорытпалары
Магний (лат. Magnesіum) Mg, элементтердің периодтық жүйесіндегі ІІ топтың элементі, атом нөмірі 12, атом м. 24, 312. Табиғатта үш изотопы бар: 24Mg, 25Mg, 26Mg. 1808 ж. ағылшын ғалымы Г. Дэви (1778 - 1829) ашқан. Жер қыртысындағы масса бойынша мөлш. 2, 1%. Ол барлық қосылыстарында екі валентті. Магний күмістей ақ, өте жеңіл, берік металл; тығыздығы 1, 74 г/см3, балқу t 650ӘС, қайнау t 1107ӘС. Ол қорғағыш оксид пленкамен қапталғандықтан, құрғақ ауада 350ӘС-қа дейінгі температурада тотықпайды, бірақ 600 - 650ӘС-та өздігінен тұтанып, жарқырай жанып, Магний оксидін (MgO) және аздап нитридін (Mg3N2) түзеді. Құрамында бос оттек (О2) жоқ суық сумен әрекеттеспейді; қайнап жатқан судан Н2-ні ығыстырады. Сұйытылған қышқылдарда жеңіл ериді [концентрленген күкірт қышқылының (H2SO4) және HF ерітінділерінде пассивтеледі] ; сілтілердің суық ерітінділерінде ерімейді. Қыздырғанда сутегімен, галогендермен S, N2, C-пен әрекеттеседі. Магнийді құрамында MgCl2 бар балқымаларды электролиздеу арқылы, күйдірілген магнезит немесе доломиттіметаллотерм. (ферросилициймен) тотықсыздандыру және MgO-ін көміртерм. тотықсыздандыру арқылы алады.
Негізгі минералдары
магнезит
доломит
карналлит
бишофит
оливин*
Магний өндірісі көбінесе негізгі өнім алуға бағытталған. Бірақ ол дайын өнім - магнийді де шығарады.
Магниймен басқа металдарды да (мысалы, хром, берилий) тотықсыздандырады. Оның жеңіл әрі берік қорытпаларын зымыран, ұшақ және аспап жасауда қолданады. Магнийді күшті жасанды жарық көзі ретінде фотография мен аспап жасауга (фейерверктер мен «бенгал шамдарына» және т. б. ) пайдаланады.
CaCO3 = MgO + CaО + 2CO2, MgO + Cl2 + C = MgCl2 + CO2. Балқытылған магний хлоридінің электролизі шамотпен футеровкаланған тікбұрышты герметикалық ванна түріндегі элетролиздегіштерде іске асырылады (сурет 1) . Анодтарды графиттен, ал катодтарды екі болат пластиналарынан жасайды. Электролит ретінде хлорлы тұздар MgCl2 (7 - 15%), NaCl, KCl, CaCl2 балқымасы қолданылады. Анод пен катод кеңістіктері оттөзімді диафрагмамен бөлінген. Тотықсызданғаннан кейін магний мен хлор әрекеттеспеуі қажет, өйткені осының салдарынан магний хлорда жанып кетеді: Mg + Cl2 = MgCl2. Электр тоғы электролит арқылы өткенде оны қыздырып, электрхимиялық үрдіс іске асады. Магний иондары катодта тотықсызданады: Mg2+ + 2e = Mg. Магнийдің тығыздығы электролит тығыздығынан кем, соның салдарынан ол қалқып шығып, ванна бетінде жинақталады. Таза магнийдің тотығуының алдын алу үшін ванна беті керамикалық қақпақпен жабылады. Балқыған магний вакуумды шөміштермен және сифондармен периодты түрде ваннадан шығарылады. Анодта түзілген хлор арнайы құбыр арқылы сорылып алынады. Электролизден кейін магнийдің құрамында көп мөлшерде қоспалар болады. Оны тигельді пештерде қождамалармен өңдеу немесе ұшыру арқылы қайта балқытып рафинадтайды. Құрамында 99, 9% - дан артық магний бар рафинадталған металл құю машинасында құйылады. Құю кезінде магний ағыны күкірт ұнтағын үрлеу арқылы тотығудан қорғалады. ⋅ 6H2O қолданылады. Металдық магнийді алудың екі әдісі бар: термиялық және электролиттік. Бірінші әдіс магний тотығының көміртегімен немесе кремниймен тотықсыздануына, ал екінші әдіс балқытылған хлорлы магнийдің MgCl2 электролизіне негізделген. Негізінен металдық магнийді өндірудің электролиттік әдісі кеңінен таралған. Ол екі негізгі үрдістерден тұрады: бастапқы шикізаттан хлорлы магнийді алу және оның электролизі. Хлорлы магниді алу үшін магнезитті немесе доломитті күйдіруден алынған магний тотығын 800 - 900оС - те көміртегінің қатысуымен хлорлайды: MgCO3 = MgO + CO2, MgCO3⋅ KCl ⋅ CaCO3, карналлит MgCl2 ⋅Магнийдің ерекше қасиеттерінің бірі - оның алюминийден 1, 5 есе, темірден 4, 5 есе кіші төмен тығыздығы - 1, 74 г / см3. Ғалымдар магнийдің қатысуымен жеңіл, берік, термотұрақты қорытпалар қатарын ашты. Магнийді легірлеу үшін Ti, Al, Zn, Mn, Be, Li, Ce, Cd, Cu қолданылады. Зымырандар мен ядролық реакторлар, қозғағыштар бөлшектері, бензин мен майлар бактары, вагондар, автобустар, жеңіл машиналар корпустары, дөнгелектер, фото - және киноаппараттар және т. б. магний қорытпаларынан жасалынады. Магний болатты қышқылсыздандыру, бірқатар металдарды (титан, ванадий, хром, цирконий) тотықсыздандыру, шойынды модификациялау үшін қолданылып, металлургияда үлкен рөль атқарады. Сонымен қатар, магний тотығы металлургиялық пештер құрылысында қолданылатын оттөзімді материалдар өндірісінде қолданылады. Магний өндіру технологиясы Магний өндірісіндегі негізгі шикізат болып магнезит MgCO3, доломит MgCO3
Мыс және оның қорытпалары
Мыс, Cu - элементтердің периодтық жүйесінің І-тобындағы химиялық элемент, атомдық нөмірі 29, атомдық массасы 63, 546. Табиғатта тұрақты екі изотопы бар: 63Cu және 65Cu. Жер қыртысындағы массасы бойынша мөлшері 4, 7. 10-3%. Негізгі минералдары: халькопирит, халькозин, ковеллин, малахит, азурит. Пластикалық қызыл түсті металл, кристалл торы қырлары центрленген кубтық, тығыздығы 8, 94 г/см3, балқу t 1084, 5°С, қайнау t 2540°С, тотығу дәрежесі +1, +2. Құрғақ ауадағы бөлме температурасында тотықпайды. Қыздырғанда ауада CuО және Cu2О-ға дейін тотығады, галогендермен, S, Se, HNO3, H2SO4-пен әрекеттеседі. Аммиак, цианидтермен, т. б. кешенді қосылыстар түзеді. Сульфид концентратын балқытып, одан түзілген мыс штейнін қара мысқа дейін тотықтырып, оны жалынмен не электролиттік әдіспен тазарту арқылы; гидрометаллургиялық әдіс - құрамында мысы бар минералдарды күкірт қышқылымен (немесе NH3 ерітіндісімен) өңдеп, одан әрі электролиздеу арқылы алады. Мыс кабельдердің, электр қондырғылары мен жылу алмастырғыштардың ток өткізгіш бөлігін жасау үшін пайдаланылады; қорытпалардың (латунь, қола, мыс-никель, т. б. ) құраушысы ретінде қолданылады.
Мыс кентастары
Құрамынан мыс алынатын табиғи шикізат. Оның құрамына мысы бар 240-тан аса минерал кіреді. Олардың ішінде өнеркәсіптік негізгілері: халькопирит (құрамындағы мыстың мөлшері 34%), борнит (63, 3), ковеллин (66, 4), халькозин (79, 8), теннантит (57), тетраэдрит (52, 3), энаргит (48, 3), куприт (88, 8), тенорит (79, 8), малахит (57, 7), азурит (55, 3), хризоколла (36, 1), брошантит (56, 2), атакамит (59, 5) . Мысты құмтас кен орындарында мыстың мөлшері көп болады. Қазақстанда бұл кен типтері басты орында (мысалы, Жезқазған кен орны) . Минералдық және химиялық құрамдарына байланысты мыс кендерінің технологиялық сорттары сульфидтік, тотыққан, аралас болып ажыратылады. Сонымен қатар мыс кендері сом және сеппелі-тарамшалы болып бөлінеді. Қазақстанда мыс кендерінің ірі кен орындарына Жезқазған, Қоңырат, Ақтоғай, Жаманайбат, т. б. жатады.
Мыс концентраты
Пайдалы қазылымдарды байыту өнімі, не шикізатты химиялық өңдеудің өнімі. Бұл өнімдерде пайдалы концентрат мөлшері бастапқы шикізаттағыдан көп болады. Олар байыту фабрикасынан тікелей пайдалануға не металлургиялық өңдеуге жіберіледі. Металлургиялық өңдеуге жіберер алдында оларды флотациялық байытудан өткізеді. Мыс кенін байыту барысында негізгі алынатын өнім, құрамындағы мыс 55%-ға жететін (көбінесе 10%-дан 30%-ға дейін) мыс концентраты болып есептелінеді. Ал флотация кезінде мыстың концентратқа өту шығымы 80%-дан 95%-ға дейін болады. Байыту барысында мыс концентратынан басқа қосымша пиритті және түсті металдар концентраттары (мырышты, молибденді, т. б. ) алынады. Қазақстанда мыс шикізат көздері Орталық, Шығыс (Кенді Алтай) және Оңтүстік Қазақстан облыстарында шоғырланған. Соңғы жылдары мыс-мырыш күрделі концентраттарын балқытып, ұсатып өңдеу, автогенді балқытып өңдеу тәсілдері Балқаш мыс зауытында жүргізілуде. [1] [2]
Мыстың жаратылысы
Гидротермалық және ол көбінесе мысты минералдардың жер бетінде ыдырауынан шығады. Мыстың кейінгі жаратылысын көрсету үшін халькопирит атты мысты минералдың ыдырауын келтірейік: CuFeS2- * FeSO4 ->-Cu. Осы ыдыраудың нәтижесінде мыспен қатар малахит, азурит минералдары да пайда болады. [3]
Мыстың кендері
Уралда (Орта Уралда), Қазақстанда (Қоңырат, Жезқазған, Ақбастау), Өзбекстанда Алмалықта бар. Шет мемлекеттегі кені АҚШ-та Жоғары Көлдер аймағында (Мичиган штатында), Африкада (Родезия) бар. [3]
Жалпы мыс туралы
Дүние жүзінде 70-тен астам түсті металл балқытылады. Оларды 14 сала өндіреді. Олардың барлығы қосылып түсті металлургияны құрайды. Түсті металдардың көп бөлігі аз уақыттан бері ғана пайдаланыла бастады. Ғылыми-техникалық революцияның нәтижесінде олар кеңінен қолданысқа түсті. Реактивті ұшақтар, ғарыш кемелерін, атом реакторларын жасау үшін ерекше қасиеттері бар, мүлдем жаңа конструкциялық мателиалдарды қажет етті. Ондай қасиеттер тек түсті металдарда ғана бар. Қорғасын, никель және қалайы жемірілуге (коррозия), титан ыстыққа төзімді келеді, ал күміс, мыс жәнеалюминий жоғары электр өткзгіштігімен ерекшелінеді. Сондықтан, олардың қолдану аясы өте ауқымды: медициналық аспаптар мен материалдардан бастап күрделі электроника мен ядролық техника осы металдардан жасалады және әр металл «өз кәсібін тапқан». Адамдар металдардың ішінде алғашқы болып мысты рудадан тез еритін, оңай бөлінетін болғандықтан ерте кезден қолдана бастаған. Ескі замандарда негізінен қалайы мен мыс қосындысы нәтижесінде қола алынып, қару-жарақ дайындалған. Бұл адамзат тарихында қола дәуірі ретінде белгілі. Мыстың латынша Cuprum атауы Кипр аралынабайланысты онда біздің заманымызға дейінгі ІІ мыңжылдықта мыс рудниктері қолданылып балқытылған. Страбон жазбаларында мыс Эбвей жеріндегі Халкида қаласының атымен Халкос деп аталған. Осы сөзден ескі грек тілінде мыстан және қоладан жасалған заттар, ұсталық өндіріс, ұсталық заттар мен құймалар атаулары шыққан. Мыстың екінші латыншы атауы AES (санскр, ayas, гот тілінде air, неміс тілінде err, ағылшынша ore) руда немесе рудник дегенді білдіреді. Еуропа тілдерінің үнді-герман теориясында қолданылып, орыстың «медь»(полякша miedr, чех тілінде - med) ескі немісше smida (металл) және shmied (ұста, ағылшынша smith) сөздерінен шығарады. Әрине, бұл сөздердің түбірлерінің туыстығына дау жоқ, бірақ та бұл екі сөзде гректің рудник, копь деген сөзінен бір-біріне байланыссыз түрде шыққан. Осы сөздерден басқада туыс атаулар шыққан - медаль-медальон(французша medaile) . Орыстың ескі жазбаларында мыс және мыстан жасалған деген сөздер кездеседі. Алхимиктар мысты Венера (Venus) деп атаған. Қазақстанда да мұндай атаулар ерте заманннан бар. Олардың атауларын ерте кезде өмір сүрген ата-бабаларымыз қойған, және де осы күнге дейін сол аттарын сақтап қалған. Мысалы: Мыстау, Мыстөбе, Жезді тағы басқа сол сияқтылар. Көптеген түсті металдардан сапасы жөнінен бастапқы материалдардан да асып түсетін қорытпалар жасалады. Мыстың қалайымен (қола), мырышпен (жез), никельмен (мельхиор), алюминиймен (дюралюминий) қорытпалары бұрыннан қолданылып келсе, ал берилий қоласы ҒТР дәуірінде пайда болды.
Қоспалары
Қоспа түрінде мыс екі дәрежеде тотығады. Оксид тұрақсыз дәрежеде Cu+ және көбіне тұрақты Cu2+, тиісінше көк және жасыл-көк түрінде тұз түзе кездеседі. Арнайы жасақталған жағдайда +3 тіпті +5 тотыққан қоспаларын алуға болады. Бұлар 1994 жылы Cu(B11H11) 23- купроборан анионында кездескен. Мыс карбонаты(ІІ) жасыл түске ие, сондықтан мыстан жасалған ескерткіштердің, бұйымдардың және ғимараттардың жасылданып тұратыны сондықтан. Мыс сульфаты(ІІ) гидратация кезінде көк түсті мыс купорасы кристалына айналып, CuSO4∙5H2O, фунгицид түрінде қолданылады. . Және де тұрақсыз мыс сульфаты(І) кездеседі. Мыстың екі тұрақты мыс оксиді бар - мыс оксиді (І) Cu2O және мыс оксиді(ІІ) CuO. Мыс оксидтері иттрий барий мыс оксидін (YBa2Cu3O7-δ) алу үшін қолданылады. Бұлар өте жоғары өткізгіштердің негізі болып табылады. Мыс хлориді түссіз кристал (көбіне ақ ұнтақ, ) тығыздығы 4, 11 г/см3. Құрғақ түрінде тұрақты. Ылғалды жерде оттегімен тотығып, көк-жасыл түске енеді. Сульфитнатрийнің тұз ерітіндісінде мыс хлоридін(ІІ) синтездеп алуға болады.
Мыс қоспалары І
Мыстың көптеген қоспалары ақ немесе түссіз түрде кездеседі. Бұл мыс ионындағы(І) барлық бес 3d орбиталінің электрон буымен толыққанымен байланысты. Бірақ та Cu2O оксиді қызыл-қоңыр түске ие. Мыс ионы(І) су ерітіндісінде тұрақсыз және жеңіл диспропорционалданады.
 (қатты)
(қатты)
Сонымен бірге мыс(І) суда ерімейтін қоспа түрінде немесе комплекс қоспа түрінде кездеседі. Мысалы, дихлорокупрат(І) -ионы CuCl2 тұрақты. Оны концентрленген тұз қышқылына қосып, мыс хлоридін алуға болады.

Мыс хлориді(І) ерімейтін, қатты, ақ зат. Басқа да мыс галогендері сияқты ол коваленттік қасиетке ие және мыс галогені(ІІ) -ге қарағанда тұрақты. Мыс хлориді(ІІ) қатты қыздыру кезінде мыс хлориді(І) алуға болады.

CO-мен тұрақсыз комплекс құрайды және қыздырған кезде ыдырайды.
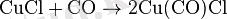
Оны алудың тағы бір жолы концентрленген тұз қышқылында мыс пен мыс хлоридін қайнатып алуға болады. Мұндай жағдайда алғашқы аралық қоспа комплексті дихлоркупрат(І) ионы [CuCl2] - пайда болады. Осы ионы бар ерітіндіні суға құйғанда мыс хлориді(І) шөгеді. Мыс хлориді(І) концентрленген аммиак ерітіндісімен әрекеттесіп, диамминмыс(І) [Cu(NH3) 2] + комплексін түзеді. Бұл комплекс оттегінсіз түссіз, ал оттегімен реакцияға түскен кезде көк түсті қоспаға айналады.
Мыс қоспалары ІІ
Екінші дәрежелі тотығу мыстың ең тұрақты тотығатын дәрежесі. Мыс қышқылдары(ІІ) мыстың қышқыл ерітінділерінде еруі нәтижесінде пайда болады. Бұл дәрежеде тотыққан тұздар көк немесе жасыл түске ие.
Мыс қоспалары(ІІ) әлсіз тотығу қасиеттеріне ие, сондықтан оны анализдерде қолданады. (Мысалы, Фелинг реактивін қолдану) .
Мыс қоспалары (ІІІ) және (ІV)
ІІІ және ІV мыс қоспаларының тотығу дәрежелері өте тұрақсыз және тек қана оттегімен, фтормен және комплекс қоспалар түрінде белгілі.
Табиғатта кездесуі
Мыс табиғатта таза және қосылыс түрінде кездеседі. Мыстың өндірісте қажеттілігі халькопирит CuFeS2 немесе мыс колчеданы халькозин Cu2S және борнит Cu5FeS4 сияқты түрінде қолданылады. Сонымен бірге мыстың басқа да минералдары ковеллин CuS, куприт Cu2O, азурит Cu3(CO3) 2(OH) 2, малахит Cu2CO3(OH) 2 түрінде кездеседі. Мыс кейде таза түрінде де кездеседі. Кейбір жерлерде 400 тоннаға дейін анықталған. Мыс сульфиттері негізінен орташа температураны гидротермальды жерлерде пайда болады. Мыстың кейбір бөліктері құмтөбелермен шөлдерде кездеседі. Бұндай жерлер Ресейде Чита облысында - Удокан кен орнында, Қазақстанның Жезқазғанында, Орталық Африканың мыс белдеуінде, Германияның Мансфельд кен орнында бар. Бұдан басқа мысқа бай ккен орындары Чилиде(Эскондида және Кольяуси) және АҚШ(Моренси) . Мыс рудасы көбіне ашық әдіспен өндіріледі. Ал рудадағы мыстың мөлшері 0, 3-1% ға дейін құрайды.
Қолданылуы
Электротехникада
Өзіндік өте төмен кедергілік қасиетіне сәйкес (күмістен кейін) мыс, электротехникада күшті кабельдер де басқада түрде қолданылады. Мыс сымдары энергия сақтайтын орамдарда және күшті трансформаторларда қолданылады. Бұл үшін металл өте таза болуы тиіс қоспалар электрөткізгіштігін төмендетіп жібереді, мысалы, мыстың құрамында 0, 2 % алюминий болған жағдайда электрөткізгіштігі 10 %-ға төмендейді.
Жылуалмасу
Мыстың тағы бір қасиеті - өте жоғары дәрежедегіжылу өткізгіштігі. Бұл қасиетіне сәйкес жылу бөлінетін, жылу беретін жерлерде қолданады. Бұларға суыту радиоторлары, кондиционерлер және жылу радиоторлары жатады.
Құбыр өндірісінде
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz