Идеал газдардың макроскопиялық күй теңдеуі (Менделеев-Клапейрон)


Қазақстан Республикасының Ғылым және Білім министрлігі
Семей қаласының Шәкәрім атындағы университеті
БӨЖ
Тақырыбы: Идеал газдың макроскопиялық күй теңдеуі
Орындаған: Мұханова М. А
Тобы:БЛ - 409
Тексерген: Рахимбердина А. Т
2015 ж
Идеал газдың макроскопиялық күй теңдеуі
Күй теңдеуі - термодинамикалық жүйенің температура, қысым, көлем және химиялық потенциал секілді макроскопиялық шамаларын өзара байланыстыратын теңдеуі. Күй теңдеуі термодинамикалық құбылыстар орын алатын жүйелерде ақиқат болады. Алайда, шынайы өмірдегі құбылыстардың күй теңдеулері аса қиын болады.
Жүйенің күй теңдеуі термодинамика постулаттарының ішіне кірмейді және олардың салдары болып табылмайды. Ол өзге қайнарлардан (статистикалық физиканың зерттеулері нәтижесінде алынған тәжірибелерден, модельдерден) алынған болуы керек. Термодинамика, өз кезегінде, заттардың ішкі құрылысына қатысты сұрақтарды қарастырмайды. Күй теңдеуінде белгіленген қатынастар тек термодинамикалық тепе-теңдік жағдайында ғана ақиқат болады.
Идеал газ -бұл молекулалар арасындағы өзара әсер елеусіз аз болатын газ.
Газдың берілген массасының куйі үш макроскопиялық параметрмен сипатталады: қысым р, көлем V және тем¬пература Т. Қазір біз олардың арасында кандай байланыс барларын табамыз, ал содан соң ол байланыс не үшін керектігін көреміз.
Күй теңдеуі. Біз идеал газдың жайын молекула-кинетикалық теория тұрғысынан жүйелі карастырайық. Газ қысымының оның молекулаларының шоғырына және температурасына тәуелді болатыны анықталды. Осы тәуелділік негізінде жеткілікті сиретілген газдың берілген массасының күйін сипаттайтын барлық үш макроскопиялық параметр р, V және Т-т байланыстыратын теңдеуді алуға болады. Бұл теңдеу идеал газ күйінің теңдеуі деп аталады.
Мына р = пRТ тендеуіне газ молекулалары шоғырына арналған өрнекті қоямыз, осы арқылы газ шоғырын мына түрде жазуға болады:
n=
мұндағы NА -Авогадро тұрақтысы, m - газдың массасы, М - оның мольдік массасы.
Жоғардағы теңдеуді р = пRТ теңдеуінің орнына қойсақ мынандай формола шығады:
PV=
Мұндағы Больцман тұрақтысы мен Авогадро тұрақтысы NА -ның көбейтіндісін универсал (мольдік) газ тұрақтысы деп атайды жә¬не оны R әрпімен белгілейді:
R=1. 38 Дж/K 1/моль=8. 31Дж/( моль. К)
PV=
Бұл теңдеуде газдың тегіне тәуелді болатын бір ғана шама бар, ол - оның мольдік массасы.
Жоғадағы күй тендеуінен кез келген екі күйдегі идеал газдың кысымы, келемі және температурасы арасындағы байланыс келіп шығады.
Егер индекс 1-мен - екінші күйге катысты параметрлерді белгілесек, ал индекс 2-мен - екінші күйге қатысты параметрлерді белгілесек, онда жоғардағы теңдеуге сәйкес газдың берілген мас¬сасы ушін
және
теңдеулерін аламыз.
Бұл тендеулердің, оң бөліктері бірдей. Демек, олардың сол бөліктері де тең болуға тиіс:
t
Бұл түрдегі күй тендеуі Клапейрон теңдеуі делінеді жә¬не бұл күй тендеуін жазудың, бір түрі болып табылады.
және түріндегі күй теңдеуін бірінші рет ұлы орыс ғалымы Д. И. Менделеев алған. Сондықтан оны Менделеев - Клапейрон тендеуі деп атайды.
Молекулалық физика және термодинамика макроскопиялық денелердің, былайша айтқанда, өте көп микробөлшектерден ( молекулалар, атомдар, иондар, электрондар т. с. с. ) тұратын денелердің физикалық қасиеттерін зерттейтін физиканың бөлімдері. Осы қасиеттерді зерттеу үшін сапалы түрде алшақ және бірін-бірі толықтыратын екі әдіс қолданылады: молекулалы-кинетикалық (статистикалық) және термодинамикалық.
Жүйелерді құрайтын микробөлшектердің қозғалысы сипаттамаларының орташаланған мәндері негізінде макроскопиялық жүйелердің қасиеттерін зерттеу әдісі, молекулалы - кинетикалық (статистикалық) әдіс деп аталады. Жүйелерде жүретін энергияның алмасу заңдарына сүйене отырып макроскопиялық жүйелердің қасиеттерін зерттеу әдісі термодинамикалық деп аталады.
Молекулалы-кинетикалық теорияның (МКТ) негіздері:
1. Барлық заттар молекулалардан тұрады.
2. Молекулалардың арасында бірмезгілде өзара тарту және тебу күштері әсер етеді.
3. Молекулалар үздіксіз хаосты (бейберекет) қозғалыс күйінде болады.
Идеал газ - келесі шарттарды қанағаттандыратын газ:
- молекулалар - материялық нүктелер;
- молекулалар арасындағы тарту күштерін елемеуге болады;
- молекулалар арасындағы тебу күштері олар өзара соқтығысқан мезетте ғана ескеріледі.
Газ қысымы газ молекулаларының ыдыс қабырғаларымен сансыз көп соқтығысуларының салдары болып табылады.
Газдың күйі
үш
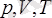 макроскопиялық параметрлермен сипатталады.
макроскопиялық параметрлермен сипатталады.
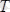 температура - макроскопиялық жүйенің термодинамикалық тепе-теңдік күйін сипаттайтын физикалық шама.
температура - макроскопиялық жүйенің термодинамикалық тепе-теңдік күйін сипаттайтын физикалық шама.
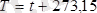 -
абсолют температура.
-
абсолют температура.
Бойль - Мариотт заңы Изотермиялық процесс

Гей-Люссак заңы Изобарлық процесс
:
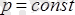
Шарль заңы. Изохорлық процесс
:
 .
.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz