Полиакриламид пен төмен молекулалы лигандарамен Cr, Mo, W және Re иондарының полимер-металдық комплекстеуінің құрамы мен термодинамикасы


ӘЛ-ФАРАБИ АТЫНДАҒЫ ҚАЗАҚ ҰЛТТЫҚ УНИВЕРСИТЕТІ
ХИМИЯ ЖӘНЕ ХИМИЯЛЫҚ ТЕХНОЛОГИЯ ФАКУЛЬТЕТІ
Физикалық химия, катализ және мұнай химиясы кафедрасы
МАГИСТРЛІК ДИССЕРТАЦИЯ
ПОЛИМЕРЛІ ЖӘНЕ ТӨМЕНМОЛЕКУЛАЛЫ ЛИГАНДТАРМЕН Cr, Mo, W ЖӘНЕ Re ИОНДАРЫНЫҢ КОМПЛЕКСТҮЗУ ЕРЕКШЕЛІКТЕРІ
Орындаған Муханова Акерке Акарысовна “ ” 2012 ж.
/қолы/ /аты-жөні/
Ғылыми жетекшісі х. ғ. д., профессор Оспанова А. К. “ ” 2012ж.
/ғылыми дәрежесі/ /қолы/ /аты-жөні/
х. ғ. д., профессор Сейлханова Г. А. “ ” 2012ж.
/ғылыми дәрежесі/ /қолы/ /аты-жөні/
Қорғауға жіберілді
кафедра меңгерушісі х. ғ. д., профессор Алдабергенов М. Қ. “ ” 2012ж.
/ғылыми дәрежесі/ /қолы/ /аты-жөні/
Алматы 2012
РЕЗЮМЕ
Магистрская работа содержит страниц, рисунков, таблиц, приложения, источников литературы.
ПОЛИЭТИЛЕНИМИН, ПОЛИАКРИЛАМИД, ХРОМ(III), ВОЛЬФРАМ(VI), МОЛИБДЕН(VI), РЕНИЙ(VII) , СИСТЕМА, КОМПЛЕКСООБРАЗОВАНИЕ, ПОТЕНЦИОМЕТРИЯ, КОНДУКТОМЕТРИЯ, ВИЗКОЗИМЕТРИЯ, ДВОЙНАЯ СИСТЕМА, ТЕРМОДИНАМИКА, рН СРЕДЫ.
Полимерметаллические комплексы находят широкое применение в различных областях науки и техники - при селективном извлечении ионов металлов из технологических растворов, природных и сточных вод, для создания высокоэффектиных полимерных катализаторов, в производстве ион-селективных электродов, в мембранных технологиях, в медицине и т. д. В связи с этим, особый интерес представляют физико-химические исследования процессов взаимодействия водорастворимых полиэлектролитов с ионами металлов в плане синтеза новых полимерметаллических комплексов с определенными физико-химическими характеристиками.
Объектом исследования является полимерметаллический комплекс (ПМК), образующийся в двойных системах полиакриламид ПАА-Cr 3+ , ПАА-WO 4 2- , ПАА-MоO 4 2- ПАА-ReO 4 - . Цель работы - установление закономерности комплексообразования в двойных и тройных системах, содержащих ионы подгруппы цинка, полиакриламид определение составов, устойчивости двойных и полимерметаллических комплексов, а также термодинамических параметров процессов их формирования.
В работе использованы потенциометрический, кондуктометрический и вискозиметрический методы исследования.
В результате физико-химического исследования двойной системы ПАА-Cr 3+ , ПАА-WO 4 2- , ПАА-MоO 4 2- ПАА-ReO 4 - установлено образование полимерметаллического комплекса состава 4:1, 2:1, 6:1 и 2:1, а для комплекса так же рассчитаны их константы устойчивости модифицированным методом Бьеррума. В работе определены термодинамические характеристики (∆ r G ○ , ∆ r H ○ , ∆ r S ○ ) процессов комплексообразования. На основании результатов установлено, что на процесс взаимодействия исходных реагентов влияют рН среды, ионная сила раствора и температура. На основании экспериментальных данных предложена схема образования комплексов.
МАЗМҰНЫ
1. 2
2
9
16
3. 2
3. 3
ҚҰРАМЫНДА хром ТОПШАСЫ және рений(VII) МЕТАЛЛ ИОНДАРЫ, ПАА ЖӘНЕ ТӨМЕН МОЛЕКУЛАЛЫ ЛИГАНДАЛАР БАР ҮШТІК ЖҮЙЕЛЕРДІ ФИЗИКА-ХИМИЯЛЫҚ ЗЕРТТЕУ
ГОСТ 6. 38-90 Унифицирование системы документации. Система организационно-распорядительной документации. Требования к оформлению документов.
ГОСТ 7. 1-84 Система стандартов по информации, библиотечному и издательскому делу. Библиографическое описание документа. Общие требования и правила составления.
ГОСТ 7. 9-95 (ИСО 214-76) Система стандартов по информации, библиотечному и издательскому делу. Реферат и аннотация. Общие требования.
ГОСТ 7. 12-93 Система стандартов по информации, библиотечному и издательскому делу. Библиографическая запись. Сокращение слов на русском языке. Общие требования и правила.
ГОСТ 7. 54-88 Система стандартов по информации, библиотечному и издательскому делу. Представление численных данных и свойствах веществ и материалов в научно-технических документах. Общие требования.
ГОСТ 8. 417-81 Государственная система обеспечения единства измерений. Единицы физических величин. БЕЛГІЛЕУЛЕР МЕН ҚЫСҚАРТУЛАРПАА - полиакриламид;
ПЭИ - полиэтиленимин;
ПМК - полимерметалды комплекс;
М - металл;
ТПМК - үштік полимерметалды комплекс
lgβ - тұрақтылық константа;
lgβ 0 - стандартты термодинамикалық тұрақтылық константа;
n - Бьеррумның түзілу функциясы;
k - металл иондары концентрациясының ПАА функционалды топ концентрациясына қатынасы;
η - келтірілген тұтқырлық
Кіріспе
Соңғы уақытта химияның теориялық және қолданбалы бағыттарының бірі- координациялық қосылыстар химиясы болып табылады. Төмен- және жоғарымолекулалы қосылыстардың комплекстері төңірегінде біршама теориялық материалдар жинақталып, олар қолданбалы аспектілер негізіне айналды. Жылдан жылға оның зерттеу объектілері кеңейіп, осы жоспарда полимерлі реагенттердің әртүрлі ауыспалы металл иондарымен комплекстүзілуін зерттеу жұмыстары қарқындап келеді. Бастапқы реагенттердің жеке физика-химиялық қасиеттерімен сипатталатын, жаңа полимерлі координациялы қосылыстардың түзілуінің оптималды жағдайларын, құрамын, тұрақтылығын табу ғылыми маңызды.
Жұмыста хелаттүзуші полимерлі лиганд ретінде полиакриламид (ПАА) пен комплекстүзуші қасиеті жоғары төмен молекулалы лигандтардың (салицил, сірке қышқылы, трилон Б) хром топшасындағы және рений металл иондарымен комплекстүзу процесі зерттелген. Алынған жоғары және төмен молекулалы лигандтар салыстырмалы арзан, суда жақсы ериді, комплекстүзуге бейім. Тиімді әрі салыстырмалы түрде арзан суда еритін полимерге жататын полиакриламидті қолдану оның негізінде қолданбалы қабілеті бар, тиімді полимерлі композиция алуға мүмкіндік береді. Олар қажетті қазбаларды байыту және бөліп алу, тағамдық және өндірістік ағын суларды тазалау үшін жоғары тиімді флокулянт ретінде, мұнай және газ өндірісінде сұйықтың гидравликалық кедергісін төмендететін, бұрғыланған ертінділерді қоюлату, жол құрлысы және ауыл шаруашылығында топырақты құрлымдау мақсатында кең қолданыс тапты.
Осыған байланысты, магистрлік жұмыстың мақсаты : хром(III), молибден(VI), вольфрам(VI) және рений(VII) металл иондары, полиакриламид қос жүйелеріндегі сулы және сулы-органикалық ортада және төменмолекулалық лигандары бар үштік жүйеде түзілген комплекстердің құрамын, тұрақтылығын, комплекс түзу процесінің термодинамикалық параметрлерінің өзгерісін, оптималды жағдайларын анықтау.
1 ӘДЕБИ ШОЛУ
- БАСТАПҚЫ ЗЕРТТЕУ ОБЪЕКТІЛЕРІНІҢ ҚЫСҚАША СИПАТТАМАЛАРЫ
Периодтық жүйенің VIB- тобының элементтеріне хром, молибден және вольфрам жатады. Валенттілік электрондық конфигурация Cr үшін - 3d 5 4s 1 , Mo үшін - 4d 5 5s 1 , және W үшін - 4f 14 5d 5 6s 2 . Хром мен молибден элементтерінде бір электронның ns қабатынан (n-1) d қабатына секірісі байқалады, ал вольфрамда валенттік электрондық конфигурациясы 4f 14 қабатымен басталады. Соңғы айтылғаны вольфрамның қасиеттерінде өте қатты көрінеді. Хром топшасы элементтері ауыспалы тотығу дәрежесі бар металдармен сипатталады. Олардың иондану потенциалы (B) төменде ұсынылған:
Кесте 1- Хром топшасындағы металдардың иондану потенциалы (B)
Рений - периодтық жүйенің VII тобының элементі, марганец пен технецийдің аналогы. Рений - сирек элементтер қатарына жатады, тіпті ол түзетін жеке минерал жоқ, өте аз мөлшерде молибден кендерімен араласқан күйде кездеседі. Рений марганец топшасына жатады, төмендегі кестеде осы VII-B тобының жалпы сипаттамасы келтірілген.
Кесте 2- Марганец топшасындағы металдардың жалпы сипаттамасы
Рений атомының электрондық құрылысы 5d 5 5s 2 , соңынан алдынғы 5d электрондық деңгейін толтырып бітіруімен сипатталады. Сол себепті, рений бірнеше тотығу дәрежесін көрсетіп, топшадағы металдармен салыстырғанда комплекстүзуге бейімділігі жоғары болып келеді. Электрондық құрылысына байланысты рений ауыспалы валенттілікті көрсетеді. Ең жоғарысы жеті валеттілікті көрсетеді. Ең тұрақты қосылыстар төрт, алты, жеті валенттіліктері. Рений ең жоғары валенттілік көрсететін перренат ReO 4 - ионын түзеді, бұл ион қасиеттері жағынан комплексті қосылыстарға жақындығымен сипатталады. [4-5] Рений -жылтыр ақ түсті, платинаға ұқсас металл. Ауада үй температура-сында тұрақты, ұнтақ түрінде ауада жануы мүмкін, сондықтан тотығып рений оксиді (Re 2 O 7 ) түзіледі. Ренийдің тығыздығы 21, 02 г/см 3 , ең ауыр металдардың бірі. Вольфрамнан кейінгі ең қиын балқитын металл. 20 0 С температура шамасында ренийдің меншікті электркедергісі - 19, 14·10 -6 ом·см. [6] Рений гидриді - (ReH) қосылысы екені белгілі, оның құрамында ренийдің валенттілігі (-1) . Ренийдің қосылыстарының біршамасы марганецке тән.
Марганецтің екі валентті күйі тұрақты болып келеді, ал рений мен технецийдің екі зарядты катионы белгісіз болып табылады. Көбінесе, рений мен технецийдің жоғары валентті тотығуы тұрақты болады. Технеций +4, +7 тотығу дәрежелерінде, ал рений +4, +5, +7 тотығу дәрежелері күйінде көп кездеседі. Сулы ертінділерде рений мен технеций катион түрінде аз кездеседі, көбінесе оксо-анион мысалы, ReO 4 - , ReOCl 5 2- , TcO 4 - күйінде жүреді. Ренийдің атомдық және иондық радиустары вольфрам, молибден, осмий және иридий металдарының радиустарына жақын болып келеді. Атомдық радиустарының мәндері келесідей: Re 1, 37A 0 , W 1, 37A 0 , Mo 1, 36A 0 , Os 1, 34A 0 , Ir 1, 35A 0 , Mn 1, 29A 0 , Tc 1, 30A 0 . [4-5]
Ренийдің толық иондану энергисы Re 7+ дейін, ал марганец пен молибденнің толық иондану энергиясы Mn 5+ , Mo 6+ дейін болып келеді.
Кесте 3 - Рений және оған ұқсас элементтердің иондану потенциалдары
Mn
Mo
Ru
Tc
Re
7, 41
7, 2
7, 5
7, 28
7, 87
14, 5
15, 7
16, 37
15, 26
13, 1
33, 97
27
28, 62
31, 9
26
53, 4
40, 53
46, 52
43
37, 7
75, 8
55, 5
62, 9
59
51
100, 7
71, 7
80, 6
76
64
127, 4
132, 7
99, 6
94
79
206, 3
153, 2
119, 3
162
-
Рений қосылыстарында барлығы сегіз валентті күйде +7ден -1 ге дейінгі аралықта болады. Көбінесе, ренийдің +4, +7 тотығу дәрежесіндегі қосылыстары тұрақты болады. Рений қосылыстарының ішінде ең маңыздысы +7 тотығу дәрежесіндегі HReO 4 , KReO 4 және Re 2 O 7 . Перренат ионы ReO 4 - қышқылдық және негіздік ортада тұрақты болып келеді. Ренийдің бес валентті қосылыстары қышқылдық ортада әлсіз тотықсыздандырғыш, және тұрақты комплекстүзгіш қасиетке ие. Төрт валентті рений сулы ортада әр түрлі комплекстер түзеді. Ренийдің (VII) валентті қосылыстары қышқылдық және негіздік ортада тұрақты болып келеді. Тұрақты бір, екі, үш валентті ренийдің қосылыстары карбонилмен, фосфинмен, диарсинмен π-комплекстер түзеді, бұл лигандалар төменгі валеттілік күйді тұрақтандырады. Бір, екі, үш валентті рений қосылысы сусыз ортада тотықсыздандырғыш болады. [6]
Рений өндірісте кең қолданыс табуда - электр лампыларындағы вольфрам сымының сыртына рений жалатса ол оның беріктігін арттырады, тұтыну мерзімін ұзарады. Рений мен платинаның құймасынан 1900градусқа дейін температура өлшейтін термоэлемент жасалады. Ренийдің басқа құймасы қатты, тозбайтын, коррозияланбайтын түрлі тетіктер, автоқаламдардың ұшы т. б жасауда, ренийді катализатор ретінде қолданады. [7]
[8] жұмыста қызықты мәліметтер берілген. Сұйытылған ерітінділерінде молибдаттар тек мономерлі пішінде болады деген көзқарас айтылған. Алайда әртүрлі рН мәндерінде молибденнің (VI) бірнеше түрлі пішіндері болады.
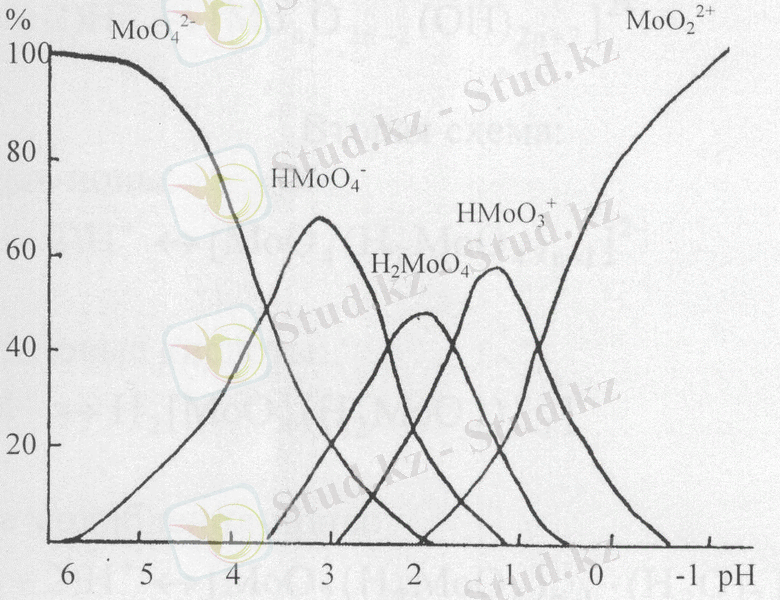
Сурет 1 - рН мәніне тәуелді әртүрлі пішінді молибден (VI)
таралу диаграммасы
Вольфрам-Д. И. Менделеевтің элементтердің периодтық жұйесінің алтыншы топ қосымша топшасының химиялық элементі. Вольфрам d-элементке жатады. Осы топтағы элементтер ауыспалы металдардың негізгі тобына жатады, олардың d-орбитальдары толық толмаған. Хром атомының электрондық құрлысы 3d 5 4s 1 , молибден- 4d 5 5s 1 және вольфрам -5d 5 6s 1 . Осыдан көретінміз, осы топша элементтерінің химиялық байланыс түзуіне сыртқы валентік қабат электрондары емес, сондай-ақ d-қабатындағы электрондар қатыса алады. Осы факторлар элемент иондарының күрделі полимерлі форма түзетінін түсіндіреді.
Төмен тотығу дәрежесіндегі хром үшін катионды комплекс тән, ал хром (III) - катиондық және аниондық, ал Cr(VI), Mo(VI), W(VI) үшін-тек анионды группировкалар және олар хром топшасындағы оттегі бар аниондарға жатады: CrO 4 2- ; Cr 2 O 7 2- ; MoO 4 2- ; WO 4 2- .
Басқа d-элемерттер секілді Cr-Mo-W қатары үшін химиялық активтілігі атомдық нөмері өскен сайын кемиді. Молибден (VI) және волфрам(VI) ерекше сипаттамасы полимеризацияға қабілеттігінде.
Кесте 4 - Хром топшасындағы металлдардың жалпы сипаттамалары
Полиакриламид [-CH 2 -CH-] - ақ түсті иіссіз полимер, суда,
l
OCNH 2
формамидте, мұзды сірке және сүт қышқылында, глицеринде ериді, пропион қышқылында, пропиленгликольде, диэтилсульфоксидте ісінеді, метаноль, этаноль, ацетон, гександа ерімейді. Шынылану температурасы ~200°С, мольдік массасы ~1⋅10
6
; [η] =3. 73⋅10
-4
 0. 66
(1н. NaNO
3
ерітіндісінде, 30
о
С-де орташамассалы) ; [η] =6, 8⋅10
-4
0. 66
(1н. NaNO
3
ерітіндісінде, 30
о
С-де орташамассалы) ; [η] =6, 8⋅10
-4
 0. 66
( 25
о
С H
2
O, орташасанды) ; [η] =6, 31⋅10
-5
0. 66
( 25
о
С H
2
O, орташасанды) ; [η] =6, 31⋅10
-5
 0. 80
( 25
о
С H
2
O седиментация бойынша) .
0. 80
( 25
о
С H
2
O седиментация бойынша) .
Полимерде карбоксил топтарының болуы полиакриламид (амидтердің сабындануы нәтижесінде) тұтқырлығына әсер етеді, өйткені сұйылтқан сайын “полиэлектролиттік қасиет” арта түседі.
Полиакриламидтің химиялық қасиеті амид тобының жағдайына байланысты анықталады. ПАА сулы ерітіндісінде бөлме температурасында гидролизге тұрақты, бірақ жоғары температурада (≥93ºС) гидролиздеуші агенттердің қатысуынсыз белгілі жылдамдықпен гидролиз жүреді. Қышқылдық ортада ПАА-ның гидролиз реакциясы келесі түрде:
-(-СН 2 -СН-) n - +mH 2 O → -(-СН 2 -СН-) n-m - (-CH 2 -CH-) m +mNH 3
CONH 2 CONH 2 COOH
Гидролиздеуші реагент ретінде көптеген төменмолекулалы (Н 2 SО 4 , НCl, Н 3 РО 4 және т. б) және полисульфон қышқылы қолданады. ПАА-ның қышқыл қатысында гидролиз дәрежесі жоғары мән көрсетеді. ПАА-ның қышқылды гидролизінің кинетикасын 0, 05 М ацетонды буферде 18ºС-де Сметс пен Хасбейн зерттеген. Гидролиздің бастапқы жылдамдығы жоғары емес (жылдамдық константасы 2, 6⋅10 -2 с -1 ) және буферлі ерітіндідегі сірке қышқылының концентрациясына тәуелді. Айналу дәрежесі 3-5% болғанда гидролиз автокаталитикалық түрде жылдамдайды. Полимердің қышқылды гидролизі реакциясының жылдамдығының тиімділігі оң зарядталған азот атомы мен гидролиз жүргізетін гидроксоний ионы Н 3 О + арасында электроостатикалық тебілудің баяу эффектісімен компенсирленеді:
~СН 2 -СН~ + НСl → ~ СН 2 -СН ~
СОNH 2 CONH 3 + Cl -
ПАА-ның қышқылды гидролизінің негізгі ерекшелігі имидизация жүруінен аз және толық суда ерімейтін реакцияның өнімдерінің түзілуі болып табылады, ол үшөлшемді құрылымның түзілуіне әкеледі.
Әр түрлі амидтердің (Е Н + ) және сілтілік (Е ОН - ) гидролиздің активтену энергиясын қарастырғанда ПАА үшін ΔЕ= Е Н + - Е ОН - айырмасы аз болады (ΔЕ= 28, 8 кДж/моль) . Басқа зерттелген полимерлер мен төменмолекулалы амидтер үшін ΔЕ 8-18 кДж/моль аралығында болады, ПАА үшін имидизация процесінің активтену энергиясы гидролизінің активтену энергиясынан жоғары.
ПАА-ның сілтілік гидролизінде АА сополимерінің АК тұздарымен тізбегінде буынының статикалық таралуы бар макромолекулалар түзіледі. ПАА-ның сілтілік гидролизінің реакциясы келесі түрде:
-(-СН 2 -СН-) n - +mNaOH→-(-СН 2 -СН-) n-m - (-СН 2 -СН-) m - +NH 3
CONH 2 CONH 2 COONa +
ПАА-ның гидролизін қарастырғанда ПАА үшін төменмолекулалы амидтермен салыстырғанда (изобутирамид және глутарамид) негізгі гидролиздің екі сатысын бөліп қарастыруға болады. Жылдам жүретін бірінші саты карбоксилатты амид тобының 40%-ті амид тобына айналғанда аяқталады. Осы сатыда гидролиз жылдамдығы бірінші дәрежедегі полимердің концентрациясына және бірінші дәрежедегі гидролиздейтін реагенттердің концентрациясына тәуелді, яғни ПАА-ның сілтілік гидролизі екінші ретті реакция болып табылады. Ал екінші сатысы сілтінің артық мөлшеріне қарамастан біріншіге қарағанда он есе аз жүреді және гидролиз дәрежесі 70 % болғанда аяқталады [9] .
Полиакриламидті 100 о С -тан жоғары қыздырғанда имидизация әсерінен және тігілген құрылымның пайда болуынан азоттың мөлшері азаяды. Сулы (20 о С, рН 8-10) ерітіндіде немесе сусыз ортада полиакриламид әсерінен метилдену жүреді:
-CONH
2
+CH
2
O
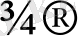 CONHCH
2
OH
CONHCH
2
OH
Полиметилметакриламид немесе оның ерітінділерін қыздырғанда немесе тотықтырғанда эфирлі көпірлі (-CONHCH 2 -O-CH 2 NHCO-) және метиленді көпірлі (-CONH-CH 2 -NHCO-) үшөлшемді құрылым түзіледі. Полиакриламидке этилен тотығы қосылады:
-CONH
2
+ CH
2
- CH
2
-О
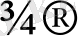 CONHCH
2
- CH
2
- OH
CONHCH
2
- CH
2
- OH
Полиакриламид және оның бейтарап ерітінділері кәдімгі жағдайда сақтауға тұрақты. Полиакриламид және оның туындылары таулы жыныстарды шығару және химиялық өндірісте, түсті металлургияда коагулянт (флокулянт) ретінде, сонымен қатар қағаздардың қаттылығын жоғарылату үшін, тканьдерды апператтау үшін қолданылады. Таза акриламидтің метилендиакриламидпен аз мөлшерімен сополимеризациясын мұнай скважиналарын бекіту үшін қолданылады. Полиакриламид және оның акрил қышқылымен сополимерлерін грунттарды қаттылату үшін құрылымтүзгіш ретінде қолданады[9] .
Полиакриламид салыстырмалы арзан, суда жақсы еритін, қолданбалы маңызы бар комплекстүзгіш полимерлер қатарына жатады. Бүгінде техника мен технологияның барлық салаларында полиакриламидті реагеннттер қолданылады. Атап айтсақ, полиакриламид пайдалы қазбаларды бөлу және байытуда, ағынды және ауыз суды тазартуда жоғары эффективті флокулянт болып табылады. Олар бұрғылау ерітінділерін, дегидраттарды қоюлатуда, мұнай және газ өндірісінде сұйықтықтың гидравликалық кедергісін төмендетуде, ауылшаруашылық және жол құрылысында топырақтың құрылым түзілуінде кең қолданыс тапты. Жұқа қабықша ретінде минералды тыңайтқыштар және дәрі жасау өндірісінде, фоторезистрлі композициялар және микросызбалар жасауда радиоэлектронды өндірісінде пайдаланылады, Мұның бәрі полиакриламид және оның поликомплекстерінің қолданылуының толық мәліметтері емес [9] .
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz