Лантаноидтердің және 2,2'-дипиридилдің аралас лигантты комплекстерінің әдеби шолуы және потенциометрлік зерттеулері


ӘДЕБИ ШОЛУ
Лантанның периоттық жұиедегі орны;
Лантанның периоттық жұйенің 3 тобына, 6 топшаснда СЖЭ элементтері (лантаноидтар) орналасқан. СЖЭ-ге лантаннан (57) лютециге (71) дейнгі 14 элемент жатады.
Физикалық және химиялық қасиеттері;
Лантонниттер дербес күйнде күмістей ақ металдар прозедим (Pr) мен (Nd)ғана сарғыш
Тартқан болады. Лантоиттардын барлығы ауырметалдар меншікті салмағы 5, 245 ден 9, 849 г/см 3
Дейін өзгереді, олардын балқу және қайнау температурасы 1-кестедгдей өте жоғары жалғыз-ақ (Ce, Eu, Yb) үшеунікі төменірек .
Атом
Радю
сы(HM)
Ион
Радю
сы (HM)
T
балқу
T
қаинау
Лантаноиттердің көпшілігі пара магнитті . Cd, Dy және Ho феромагнитті.
Химиялық активтілігі жағынан сілтілік және жер металдарынағана жол береді.
Арганикалық қышүқылдардың түздары және коплексті қосылыстары
Көптеген органикалық қышқылдармен СЖЭ тұздары алынғын. Тұздардың көбі суда аз ериді, мысылы, тартараттар, фталаттар, малонаттар, бензоаттар, цитраттар. СЖЭ көптеген органикалық комплексті қосылыстары зерктелген. олардың арасында ең маңыздысы цитраттар, оксинаттар және комплексондар.
Лантоноиттардың қосылыстыры
Лантоноиттар көпшілік жағдайда үш валентті көрсетеді лантоноиттардін толып жатқан жай қосылыстары бар. Ме 2 О 3, МеF 3, MeC 2 , MeH 3 Т. Б осылармен қатар түрліше тұздар тұзеді.
Дипиридилдер - молекуласында екі пиридил қалдығы бар гетероциклды аминдер.
Сурет 6 - 2, 2 , -дипиридил молекуласының кеңестіктегі көрнісі
Дипиридилдің алты изомері бар:
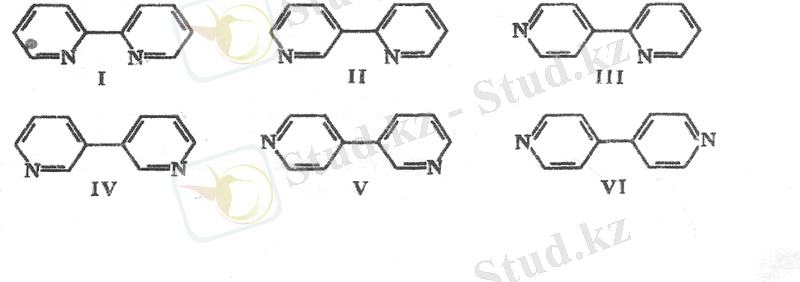
I-2, 2 ʼ -дипиридил немесе α, αʼ-дипиридил; II-2, 3ʼ-дипиридил немесе α, βʼ-дипиридил; III-2, 4ʼ-дипиридил немесе α, γʼ-дипиридил ; IV-3, 3ʼ- дипиридил немесе β, βʼ- дипиридил; V-3, 4ʼ-дипиридил немесе β, γʼ- дипиридил; VI-4, 4ʼ- дипиридил немесе γ, γʼ- дипиридил.
Ерітіндінің pH -ының төмендеуі мен 2, 2ʼ-дипиридилдің УК- спектрлерінің жұтылу жолақтарының ығысуына қарап, протонның бос негізге сатылып қосылады деген шешімге келген. Бірінші сатыда (10) монокатион (H + dipy ) екінші сатыда(11) дикатион(H 2 2+ dipy) түзіледі. (K 1 =3, 72*10 -5 ; K 2 =1, 66*10 -3 ) .
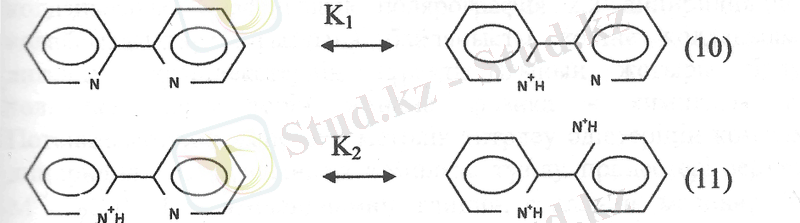
H + dipy монокатионына жазық цис-конфигурация, ал Н 2 2+ dipy дикатионына транс- конфигурация тән. Қосылған екі протнның стериялық әрекеттесуінің нәтижесінде пиридин сақиналарының копланарлығы бұзылады.
Дипиридилдер фенолдармен, аминдермен, метал тұздарымен және басқа да қосылыстармен комплекс тұзуге бейім. 2, 2ʼдипиридил периоттық жүйедегі металл тұздары мен қосылыстар береді. ол басқа изомерлермен салыстырғанда активтігі ең жоғары қосылыс болып табылады. 2, 2ʼ-дипиридил полидентанытты лиганыт ретінде зерттеулерге коп қолданылады.
Тармақталған it электрондық жүйесі бар болғандықтан бұл лиганд ортальщ атомның төменгі тотығу дэрежелерін тұрақтандырады. Комплекстердің тұрақты болуы лигандтардың жоғаргы акцепторлық қасиеттеріне байланысты.
Төмендегі 7-суретте 2, 2' - дипиридилдің қышідылдық диссоциациялану константалары (рКІ=4, 4; рК2=2, 8) бойынша, рН-тың әртүрлі мәнінде протондалмаған, біріншілік және екіншілік протондалған лигандтың концентрациялары анықталып, ортаның рН-на тәуелді таралу диаграммасы келтірілген. Диаграммадан рН < 2, 8 облыста DipyH 2 2+ , 2, 8 < DipyH + < 4, 4, рН > 4, 4 облыста Dipy күйлерінің кездесетінін көреміз.
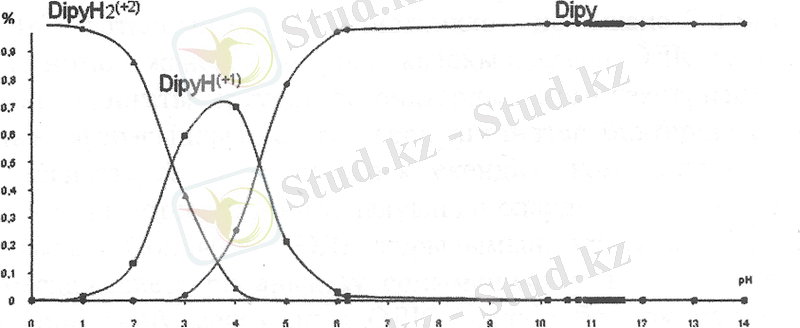
Сурет 7 - 2, 2' - дипиридилдің әртүрлі күйлерінің ерітінді рН-на тәуелді таралу диаграмасы.
Екі валентті металл түздарымен 2, 2'-дипиридилдің комплекс түзуі көп зерттелген. Me (II) : 2, 2'-dipy жүйесінде 1:2 және 1:3 қатынастағы комплекстер түзіледі. Металдың 2, 2'-дипиридилмен комплекстері түзілген кезде бесмүшелді хелатты циклдер түзеді, ал 4, 4'-дипиридил молекуласы металл иондарының арасында "көпірше" қызметін атқарады.
2, 2'-дипиридилдің аралас комплекстер түзу қабілеттілігі жоғары. Металдардың 2, 2'-дипиридил қатысындағы әртекті лигандты комплекстерін зерттеуде көбіне потенциометрия және рН - метрлік титрлеу әдістері колданылады. Классикалық полярография 2, 2'-дипиридилдің адсорбциялық колайсыздықтар туғызуына байланысты көбіне қолданылмайды. Әртекті лигандты комплекстердің түрақтылығының жоғыры болу себептерінің толықтай мәліметтерін жанама физика - химиялық әдістер береді. Потенциометрлік және рН- метрлік титрлеу әдістерінің көмегімен М п+ - 2, 2'-дипиридил - L жүйесіндегі комплекс түзілу процестері зерттелген. Мүндағы М пт - Cu 2+ , L - этилендиамин, глицин, а-аланин, малонат. Бірдей жағдайда анықталған (1=0, 2; 30°С) әртекті комплекстер мен біртекті комплекстердің тұрақтылық константаларын салыстырғанда [Cudipy] коплекстері тұрақты екенін көрсеткен. Спектроскопиялық зерттеулер қорытындысы бойынша [CuL] және [CuL 2 ] комплекстеінің тұрақтылығының төмен болуы Си(П) -ң dn электрондары мен сәйкес лигандтың L ажырамаған электрон жүптарының тебісуіне байланысты деп түсіндіріледі. [CudipyL] типті комплекс түзілгенде орталық атомның dn электрондары мен 2, 2'-дипиридил молекуласының бос п орбиталдарының арасында дативті байланыс түзу нәтижесінде тебілу төмендейді. Бүл Си(П) -ң dn орбиталінің электрон тығыздығының төмендеуіне әкеліп, нәтижесінде әртекті лиандты комплекстердің түзілуін күшейтеді [16] .
Әртекті лигантты комплекстердін (ӘЛК) түзіліу сипаттамасы
Әрткеті лиганты комплекстүзілу үрдістері аналитикалық химияда элементтерді анықтаудың бөлу және концентрлеу реакцияларының сезгіштігі мен талғанпаздығын арттыру үшін кеңінен қолданылады. Оларды химиялық технология мен гальванотехникада қолдану өндірісті жетілдіруге ықпал етеді. Көптеген ӘЛК каталитикалық активтілікке ие және d-металдардың гетероциклді аминмен және оксикарбон қышқылымен ӘЛК түзу үрдістері, нақтырақ айтсақ табиғаты әртүрлі лигантардың комплекстүзгіш-ионның координациялық сферасындағы өзара әсері, лигандтар бір-біріне сәйкес келу үшін қандай қасиеттерге ие болу керек екендігі, комплекстердің құрамы, лигантар мен комплекстердің протондалуының олардың тұрақтылығына әсері толық зерттелмеген. Сондықтан ӘЛК құрылымын, құрамын, тұрақтылығын және тағы да басқа қасиеттарін анықтау, сонымен қатар ғылым мен практиканың нақты міндеттерін шешу мақсатында ӘЛК түзілуін болжау мен қасиеттерін бағытты түрде өзгерту маңызды және өзекті болып табылады.
ӘЛК түзілгенде маңызды рольді біртекті комплекстердің тұрақтылығын анықтайтын факторлар болып табылады. Сонымен қатар ӘЛК түзілу реакциясылигандтардың үйлесімділігін және олардың тұрақтылығын анықтайтын спецификалық парамерлермен сипатталады. Сондықтан орталық ион, лиганд және ортаның комплементарлық және сәйкестік принципі ӘЛК түзілгенде жақсы көрінеді. Мұндай комплекстерде МА және МА 2 типі комплекстерде байқалмайтын қасиеттер тән болып келеді: стереоселективтілік, кіші молекулаларды (O 2 , N 2 , CO, NO) байланыстыру қабілетілігі, жаңа химиялық қасиеттер, молекулашылық, лигандаралық байланыстардың түзілуі және лигандаралық әрекеттесу, лигандтардың депротондалу процесін және олардың реакциялық қаьілеттілігін, лигандтардың ерекшелігін басқару, белгілі тотығу дәрежесі бар металдармен комплекстерінің тұрақтылығын және координациялық полиэдрдің геометриясы, жеңіл гидролизденетін лигандтардың тұрақтылығы және олардың ерекше құрылымы және т. б. Бұл барлық эффектілер белгілі бір дәрежеде ӘЛК тұрақтылығына әсер етеді.
... жалғасыӘЛК - дің тұрақтылық константалары (1) - (3) теңдеулерімен анықталады:
M + L + X MLX, =
ML + X
MLX, =
MX + L MLX, =
Мұндағы М - металл ионы; L және X - лигандтар. Тәжірибеден анықталатын жалпы тұрақтылық константасы мына теңдеулер арқылы K ML MLX және K MX MLX байланысады:
Lg = lg - lg
lg = lg - lg
мұндағы және - мынадан туындайды:
M + L
ML, =
M + X =
ӘЛК - дің салыстырмалы тұрақтылығы
lgK = lg - lg =lg - lg =lg - lg -lg
lgK шамасы лигандтың (мысалы, X) ML комплексіне координациялануының салыстырмалы ( оның акваионға координациялануымен салыстырмалы түрде ) қабілеттілігін сипаттайды.
ӘЛК - дің сандық сипаттамасы үшін қолданылатын тағы бір жақындастыру () - теңдеумен сәйкес “антидиспропорцонирлеу” (сопропорционирлеу) реакциясына негізделген:
ML 2 + MX 2
2MLX, X 11 =
ал Lg X 11 мына теңдеумен анықталады:
lgX 11 = 2lg - (lg lg ) =
(lg - lg ) + (lg - lg )
Мұндағы , , және -(), (), (), () теңдеулеріне сәйкес константалар:
ML + L
ML 2
MX + X
MX 2
M + 2L
ML 2
M + 2X
MX 2
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz