Бейорганикалық сілтілердің технологиясы: натрий, калий және литий гидроксидтерінің физика-химиялық қасиеттері, өндіру технологиясы және қолданылуы


Қазақ Ұлттық Университеті
Химия және химиялық технология факультеті
Тақырыбы: Бейорганикалық сілтілердің технологиясы
Орындаған: Рысбай Мөлдір
Бақыт Гүлиза
Тексерген: х . ғ. к., аға оқытушысы
Қалабаева Майра
Алматы 2011
Мазмұны
- Кіріспе
- Негізгі бөлім
2. 1. Бейорганикалық негіздерге жалпы сипаттама:
2. 1. 1. Физика- химиялық қасиеттері
2. 1. 2. Табиғатта таралуы және қолдануы
2. 2. Негіздерді өндіру технологиясы және оның маңызы
2. 3. Қышқылдық- негіздік теориясынан талдау
III. Қорытынды
IV. Пайдаланылған әдебиеттер
Кіріспе
Курстық жұмыстың өзектілігі: Бейорганикалық сілтілерге деген сұраныс олардың қолданыс ауқымының аз емес екендігін көрсетеді. Оларды жоғары технологиялық жұмыстарда негізгі рөл атқарады. Соның ішінде, электронды және электроскопиялы негізде ақпараттық технология, биомедицина, қоршаған ортаны қорғау болып табылады. Олардың қолдану аясы люминофор, қолданбалы керамика, катализатор, өткізгіш, тұрақты момент, жоғары сапалы әйнек, оттекті сенсор, лазер сәулесі және жергілікті металлургия.
Курстық жұмыстың мақсаты: Д. И. Менделеевтің периодтық жүйесіндегі I негізгі топша элементтеріне сипаттама беру. Соның ішінде олардың гидроксидтерінің физика-химиялық қасиеттерімен, түзетін қосылыстарымен таныстыру. Бөлу әдістерін, өндіру технологиясын анықтау. Қышқылдар мен негіздер теориясы бойынша түсіндіру.
Периодтық жүйенің негізгі топтарындагы элементтердің бұл соңғы тобы. Бірінші топтағы элементтердің барлығының да сыртқы қабатында 1s электрон болуы, олардың электрон қосып ала алмайтындығын, қайта жалғыз электронын беріп жіберіп, оң бір валентті катион түзеді деп күтуге мүмкіншілік береді.
Бұл топтағы элементтердің сырттан екінші қабатындағы электрон саны екі түрлі; бір топ элементтерінде ол қабат сегіз электронды, әрі соңғы электроны -s, -p электрондар, бұл литий, натрий және үлкен периодтардың жұп қатарларының элементтері- калий, рубидий, цезий және франций. Құрылымы мұндай элементтерді, негізгі топқа жатқызамыз. Қалған мыс, күміс және алтын элементтерінің сырттан екінші қабатында 18 электрон болады. Әрі соңғы электрондар- олар қосымша топқа жатады.
Бірінші негізгі топтың элементтерін көптен сілтілік металдар дейді, өйткені ертеде, бұл металдар белгісіз кезде, натрий мен калийдің гидроксидтері белгілі болатын, оларды сол кезде «сілті» деп атайтын. Олардың қолдану аясы өте кең. Сілтілік металдар өздерінің валенттік электрондарын жеңіл береді, өте күшті тотықсыздандырғыштар және өздерінің периодтарында өте белсенді металдар болады.
Біздің планетамызда таралуы бойынша натрий барлық элементтердің ішінен алтыншы орын алады. Ал калий - табиғатта таралуы бойынша жетінші элемент.
1807 жылы Дэви сол сілтілерді балқытып, электролиздеп, натрий мен калийді жеке шығарып алған. Натрий мен калий сілтіден алынғандықтан сілтілік металл деп аталған. Одан кейін бұларға ұқсас - литий, рубидий, цезий жене франций сілтілік металдар қатарына қосылды. Сілтілік металдардың сыртқы жалғыз электроны ядродан әжептәуір қашық орналасқандықтан, оның ядроға тартылуы нашар, берілуі оңай болады, сондықтан сілтілік металдар барлық металдардың ішіндегі активтісі. Басқа топтардағы сияқты топ бойымен жоғарыдан төмен түссек, металдардың реет нөмері өсіп, радиусы ұзарған сайын электрон бергіштігі, металдық қасиеті, активтілігі күшейеді.
II. Негізгі бөлім.
2. 1. 1. Бейорганикалық негіздерге жалпы сипаттама. Физика- химиялық қасиеттері.
1. Калий гидроксиді латынның Potassium hydroxide (күйдіргіш калий, каустикалық поташ) . Қосылыс өз алдында ақ гигроскопиялық кристалдық масса, иіссіз. Ауада тотығады, өзіне су мен CO 2 газын сіңіреді. 247°С температураға дейін тұрақты. Қайнау температурасы 1327°С, тығыздығы 2, 044 г/см3.
Калий гидроксиді суда өте жақсы ериді, сонымен қатар ерітіндінің температурасы жоғарылап, шашырауы да мүмкін. Одан басқа КОН этанолда, метанолда ериді. Гигроскопиялық қасиетінің жоғары болуынан тетра және ди, моногидраттар түзіледі.
Кесте. Калий гидроксиді мен оның қасиеттері
Ср =49, 4 Дж/(моль/К) ; ΔHтұтану =197, 1кДж/моль кесте үшін
Таза күйінде KOH жанғыш емес және жарылыс бермейді. Денеге зиянды жағынан екінші орында. Күйдіргіш калий денеге тиген жағдайда немесе көзге ауыр химиялық күйік береді, одан дерматит пайда болуы мүмкін. Сонымен қатар калий гидроксиді адам денесіне сіңірілу арқылы еніп, оның өкпесінің ісінуіне әкеледі.

Олар типтік күшті негіздер. Бұлар ауада балқи бастайтын, ылғал тартқыш ақ түсті кристалдық заттар. Олар суда жақсы ериді, толығымен диссосацияланады.
KOH= K + + 0H -
Құрамында гидроксид ионының OH - болуына байланысты сілтілердің ерітінділері сабындай сезіледі, олар теріні, матаны, қағазды (қолды, әсіресе көзді байқау керек) жеп жібереді.
Алынуы. Лабораторияда калий гидроксидін KCl ерітіндісін электролиздеп алады. Көбінесе сынап катодтарын қолданады, ол жоғары сапалы өнім алуға септігін тигізеді.
КОН күшті сілтілер қатарына жатады. Қышқылдармен, ылғал газ тектес CO 2 , SO 2 , H 2 S және NO 2 шапшаң әсерлесіп, өзіне сәйкес KHCO 3 , KNSO 3 , полисульфидтер мен олардың қоспаларын KNO 2 және KNO 3 , HF- KF, KHF 2 ; CO- HCOOK аламыз.
Сусыз KOH-та аммоний тұздарымен реакцияласады, нәтижесінде аммиак түзіліп, өрт немесе жарылыс қаупі төнеді.
.
1. Қышқылдармен тұз және су түзе әрекеттесуі( нейтрализация реакциясы):


2. Қышқылдық оксидтермен оңай әрекеттеседі:


Реакцияның соңғы өнімі ретінде су және тұз түзіледі.
3. Балқытылған гидроксид Be, Al, Ga, Zn, Sn, Pb, Sb и гидроксидтерімен және олардың оксидтерімен, оксометалл түзе реакцияласады. Мысалға оксометалдар (КАlO2, K2ZnO2), нәтижесінде су және сутек бөлінеді. KOH тың сулы ерітінділері жоғарыда көрсетілген металдармен гидрокомплекстер түзіп, сутектің бөлінуі де жүреді. Амфотрелі металдармен күрделі комплексті қосылыстар береді. Мысалы:
![\mathrm{2 \ Al + 2 \ KOH + 6 \ H_2O \longrightarrow 2 \ K[Al(OH)_4] + 3 \ H_2 \uparrow}](https://kz-rkd-img.s3.studkz.pro/36343/image6.webp)
4. NaOH сияқты, калий гидроксиді аммиакты аммоний тұздарынан ығыстырады:
NH 4 Cl + KOH = NH 3 ·H 2 O + KCl
Натрий гидроксиді - түссіз, өте гигроскоптық, өзі жанасқан затын күйдіргіш қатты зат. Сондықтан күйдіргіш сілті, күйдіргіш натр деп аталады. Күйдіргіш натр оңай балқығыш, әрі айырылмай ұшатын зат, балқыған күйде шыны, фарфор, платина ыдыстарын «жеп» қояды, сондықтан мұны күміс, никель, темір ыдыстарды балқытады.

Олар типтік күшті негіздер. Бұлар ауада балқи бастайтын, ылғал тартқыш ақ түсті кристалдық заттар. Олар суда жақсы ериді, толығымен диссосацияланады.
Na0H= Na + + OH -
Құрамында гидроксид ионының OH - болуына байланысты сілтілердің ерітінділері сабындай сезіледі, олар теріні, матаны, қағазды (қолды, әсіресе көзді байқау керек) жеп жібереді.
HCl= NaCl + H 2 O қышқыл
CuSO 4 = Cu(OH) 2 + Na 2 SO 4 тұз
Na0H + CO 2 = Na 2 CO 3 + H 2 O қышқылдық оксид
Zn(OH) 2 = Na 2 [ Zn(OH) 4 ] екідайлы
Күйдіргіш натр суда (спирте де) жақсы ериді, ерітінділерінде толық диссосацияланады, сондықтан бұл ең күшті сілтінің бірі. Натрий гидроксидін ( күйдіргіш натр, каустикалық сода, каустик) өнеркәсібтің түрлі салалары өте көп мөлшерде тұтынады. Бүкіл жер жүзінде жыл сайын бірнеше миллион тонна өндіреді, әрі оның көпшілігі ас тұзы ерітіндісін электролиздеу арқылы алынады. Оны мынандай алмасу реакциясы арқылы да алады:
Na 2 CO 3 + Ca(OH) 2 = CaCO 3 + 2 Na OH
реакция нәтижесі бойынша натрий гидроксидінің ерітіндісі мен кальций карбонатының тұнбасы түзіледі. Кальций карбонаты ерітіндіден құрамында шамамен 92% NaOH бар балқытылған ӛнім алынғанға дейін буландырылады. Балқытылған NaOH тоңазыту үшін темір барабандарға құяды.
Ферритті әдіс екі реакциямен сипатталады:
Na2CО3 + Fe2О3 = Na2О. Fe2О3 + CО2
натрий ферриті
Na2О. Fe2О3 + f H2О = 2 NaOH + Fe2O3
ерітінді тұнба (2) реакция кальцинирленген соданың темір оксидімен жымдасуы 1100-1200°С температура аралықтарында жүргізілетіндігін кӛрсетеді. Осыдан натрийдің ферриті түзіліп кӛміртек оксиді бӛлінеді. Одан ары қарай түзілген феррит (3) реакция бойынша сумен (шаймаланады) ӛңделеді. Нәтижесінде натрий гидроксиідінің ерітіндісі және Fe2O3 тұнбасы түзіледі, бұл тұнба бӛлініп алынғаннан кейін процеске қайта жіберіледі. Ерітінді құрамында шамамен 400 г/л NaOH болады. Оны 92% NaOH алғанға дейін буландырады.
Натрий гидроксидін химиялық жолмен алудың елеулі кемшіліктері бар: кӛп мӛлшерде отын жұмсалады, алынған күйдіргіш натр қоспалармен ластанған, аппараттардың қызмет кӛрсетуі ӛте күрделі және т. б. Бүгінгі таңда бұл әдістердің барлығы толығымен электрохимиялық ӛнеркәсіпте орындалады.
NaOH- ты электролиз әдісімен өндіру.
Мұнда бір қондырғыда (электролизерде) натрий гидроксидін, хлор және сутекті алуға болады. Натрий хлоридінің ерітіндісінен тұрақты электр тогын өткізгенде хлордың бөлінуін күтуге болады:
2CI- 2е = С12 (а) сонымен қатар оттек
2ОН- 2е = 1/2О2 + Н2О (б)
немесе
H2О - 2e =1/2О2 + 2H+ ОН
ионының разрядталуының қалыпты электродтық потенциалы +0, 41 в, ал СІ- ионының разраядталуының қалыпты потенциалы +1, 36 в құрайды. Натрий хлоридінің қаныққан бейтарап ерітіндісіндегі гидроксид иондарының концентрациясы шамамен 1·10-7 г-экв/л. 25°С-та гидроксил иондардың разрядталу потенциалы мынадай болады:
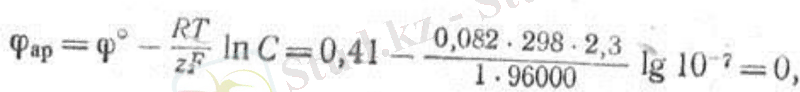
Катодтың сілтілік ерітіндісінде су молекуласы разрядталады:
Н2О + е = Н + ОН-
Сутек атомы рекомбинацияланғаннан кейін молекулярлы сутек түрінде бөлінеді:
2Н = Н2 (г)
Сулы ерітінділердегі қатты катодта натрий ионының разрядталуы мүмкін емес, себебі олардың разрядталу потенциалы сутекпен салыстырғанда жоғары. Сондықтан ерітіндіде қалған гидроксид иондары натрий иондарымен сілті түзеді. NaCI ыдырау процесін келесі реакциялармен өрнектеуге болады:
2CI- 2e → CI2
2H2O + e = 2H + 2OH-
2H = H2
2H2O + 2CI- = CI2 + H2 + 2OH-
немесе
2H2O + 2NaCI = CI2 + H2 + 2NaOH
Яғни анодта хлордың түзілуі, анодта - сутек және натрий гидроксидінің түзілуі жүреді.
Электролиз кезінде процестерде сипатталған негізгі компонанеттермен бірге жанама реакциялар қатар жүреді, олардың біреуі (б) теңдеуімен берілген.
Сонымен қатар анодта бӛлінген хлор электролитте жекелеп еріп, келесі реакция бойынша гидролизденеді:
CI2 + H2O = HOCI + HCI
Сілтінің диффузия жағдайында (ОН- иондары) анодқа қарай немесе катодтық және анодтық ӛнімдер хлорлау және тұз қышқылы сілтімен бейтараптанып натрий гипохлоиті мен хлридін түзеді:
НОСl + NaOH = NaOCl + Н2О
НСl + NaOH = NaCl + Н2О
Ваннада ас тұзы толық ыдырамайды, онда сілті мен ыдырамаған ас тұзының тұрақты концентрациясы орнатылады. Вананадан ағып түскен электролиттік щелоктың құрамында 110-120 г/л NaOH және 180-170 г/л NaCl болады.
Өнеркәсіптік электролизерлердің өнімділгі өте жоғары болуы тиіс. Оған жүктемені ұлғайту арқылы жетеді. Беті өте жетілдірілген катодтарды қолдану жүктемесі 5000 а болатын шағын электролизерлерді құруға мүмкіндік береді.
Анодтар графитті пластина түрінде болады. Катод - құрышты жиектен тұрады, ішкі жағы болат торлардың жазық қалташалар қатарынан құрастырылған. Қалташалардың орналасуы мен кеңдігі, катод қондырғысы ванна түбінде қалташалар анодтар арасына сыя алатындай болуы тиіс.
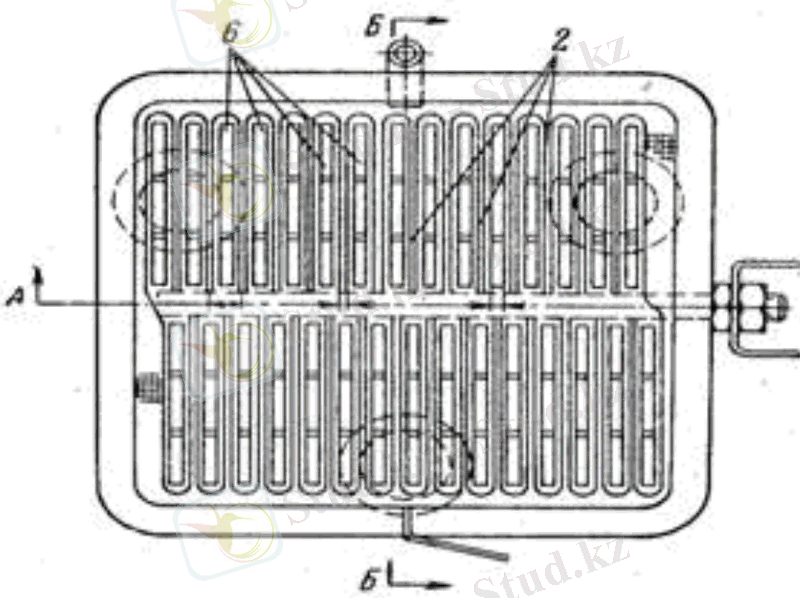
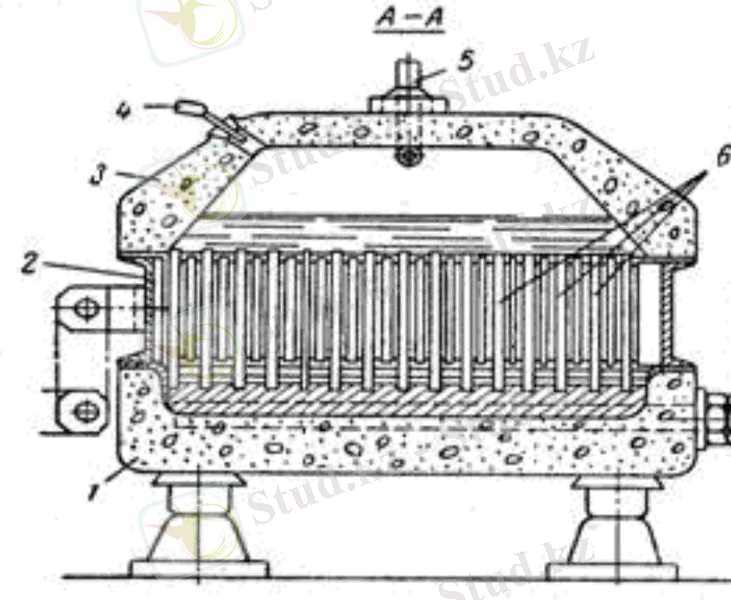
Батырылған диафрагмасы бар ванна: 1 - бетонды жұп; 2 - болат катод; 3 - бетонды қақпақ; 4 - тұздық жіберетін құбыр; 5 - хлорды алып кететін құбыр; 6 - графитті анод; 7 - сутекті кетіретін штуцер; 8 - электролиттік щелокты төгетін құбыр; 9 - мысты токтасымалдағыш сым
Ванна қақпағында тұздықты жіберіп және хлорды алып кетіп отыратын тесік бар. Электролизерде қоршаған ортаға жылуды бөлу есебінен энергияның жоғалуын төмендететін жылу изоляциясы бар.
Сынап катоды және графит аноды бар ваннадағы натрий хлориді ерітіндісінің электролизі
Мұндай типтегі электролизерде диафрагмалықпен салыстырғанда концентрациясы айтарлықтай жоғары өнім алынады. NaCI ерітіндісі арқылы тұрақты электр тогын өткізген кезде графитті анодта СІ- иондарының разрядталуы жүзеге асырылып, нәтижесінде хлор газы бөлінеді:
2Сl - - 2е = СI 2
Cынап катодында сутектің бөлінуі үлкен асқынкернеулікте жүзеге асады. Егер бейтарап ерітіндідегі темір катодта сутектің бөлінуі 0, 415 в болса, онда сынап катодында 1, 7-1, 85 в құрайды. Сынап катодында натрий үлкен деполяризациялық эффектімен бөлінеді, сынаптың артық мөлшерінде еритін NaHgn натрий амальгамасын түзеді. Осының арқасында сынап катодындағы натрийдің ыдырау потенциалы тепе-теңдіктегі күйден төмен болады, яғни 1, 2 в тең болады, сол мезгілде оның тепе-теңдіктегі потенциалы 2, 71 в тең. Осылайша, сынап катодында келесі процестер жүзеге асады және сутек мүлдем бөлінбейді:
Na+ + е = Na
Na + nНg = NaHgn
Натрий амальгамасы арнайы аспатарда ыдырайды - сумен ыдыратқышта мына реакция бойынша ыдырайды:
NaHgn + Н20 = NaOH + 1/2Н2 + nHg
Сынап катоды бар ваннадағы электролиз 4, 3-4, 4 в тең болатын орташа кернеулікте жүезеге асады.
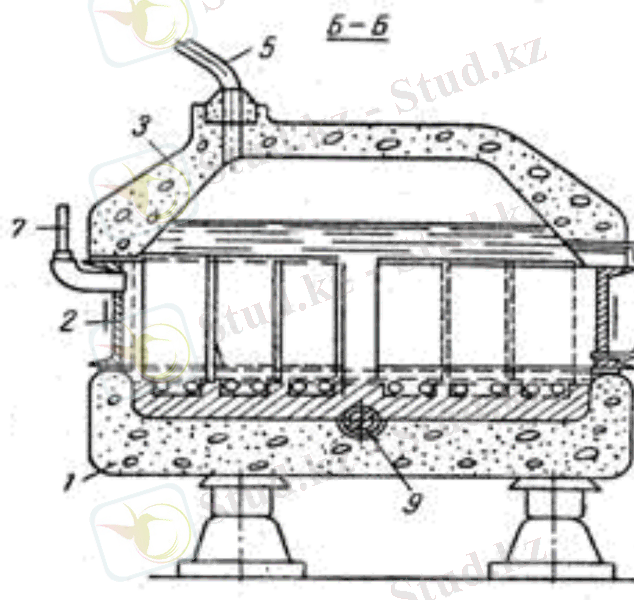
Сынап катодты ваннаның принципиалды сызбасы 66-суретте келтірілген, Ол екі бөліктен тұрады: электролизер және электолизер мен раз конструкциялық жағынан бір-бірінен бөлінген, олар өзара құбырөткізгіштер арқылы байланысады немесе ортақ жалпы қапшаның ішіне орналасуы мүмкін.
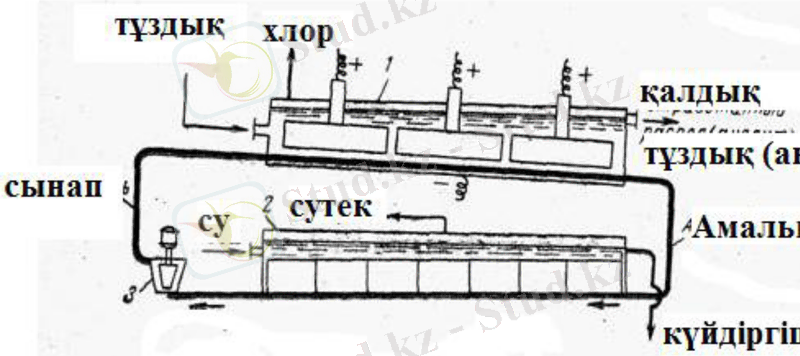
66-сурет. Сынап катодты ваннаның сызбасы: 1 -электролизер; 2 - разлагатель; 3 - сорғыш
Кез-келген жағдайда электролизер - тікбұрышты қималы ұзын жәшік болып табылады, жоғары жағы графит анодтары бекітілген, жабық қақпақтан тұрады. Ваннаның көлдененең түбіне катодтық шина орналастырылған, ол арқылы сынаптың жіңішке ағыны үздіксіз ағып жатады. Осылайша ваннаның түбі катод болып табылады.
Электролизер натрий хлоридінің (310-315 г/л) қаныққан ерітіндісімен қанықтырылып отырылады, олар электролиз процесі кезінде концентрациясы 260-270 г/л ас тұзымен араласып, ваннадан шығарылады, таза ауамен үрлеу арқылы хлорсызданады, тұзға дейін қанықтырылып, қоспадан тазартылып, электролизерге қайта жіберіледі сызбада көрсетілмеген) . Түзілген хлор ваннаның қақпағы арқылы сыртқа шығарылады.
Электролиз процесінде сынап элетролизер түбіне қарай жылжу кезінде натрий амальгамасы түзіледі, ол сынапта еріп, электролизерден разлагательге шығарылады. Разлагательдер іртүрлі конструкцияда болуы мүмкін - горизантальды және вертикальды. Горизантальды разлагательдер қақпағы жабылған тікбұрышты желоб түрінде болады. Разлагательге су ағып келіп жатады, одан түзілген өнімдер - сутек пен сілті алып кетіліп жатады.
Сынап катодты ваннаның ауданы көлбеу орналасқан сынап катодының орналасуына байланысты үлкен болады. Вертикаль орналасақан амальгамдалған дискілері бар катодтары ванналар да бар. Мұндай ванналар, шағын, бірақ конструкциясы жағынан және эксплуатациялау жағынан өте күрделі болады. Ваннаның екі типінің жұмыстарының негізгі көрсеткіштерін салыстырған кезде, диафрагмалықпен салыстырған кезде сынап катодты ванналардағы энергия шығынының жоғары болатындығын көрсетті. Сонымен қатар, сынап катодты ваннан эксплуатациялау, диафрагмалықпен салыстырғанда айтарлықтай қиын болады, оларды орналастыруға да көп каптиалдық шығын жұмсалады және сынап катодымен жабдықтандырылған цехтардағы жұмыс жағдайы, диафорагмалық ванналар орналасқан цехтарға қарағанда ауыр болады. Сынапты ванналарда ас тұзынан бос концентрленген щелоктарды алу, сынапты ваннаның аса маңызды жетістігі болып табылады. Осыдан егер таза сілті қажет болса (мысалы вискозалы талшық өнеркәсібі), онда таза сілті сынапты катодта алынады. Таза каустикаға деген сұраныстың жоғарылауына байланысты сынапты катодтың электролизі кеңінен тараған.
Электролиз кезінде ерітінді түрінде алынған сілті, буландырғыш қондырғыларда концентрациялануға ұшырайды. Диафрагмалық ваннадағы сілтінің құрамында130- 140 г/л NaOH және 180-170 г/л NaCl болады. NaOH концентрациясының жоғарылауымен ас тұзының ерігіштігі тӛмендейді. Мысалы 20°С-та құрамында 50% (769 г/л) NaOH бар сілтіде, NaCI ерігіштігі 13, 9 г/л құрайды.
Диафорагмалық ваннадан алынған электролитті щелоктарды буландыру кезінде, ерітіндіні концентрлеумен қатар, натрий хлоридінің кристаллизациялануы қатар жүреді, ол электролизе қайта оралады.
Буландыру және балқытудан кейін, құрамында 92-94% NaOH, 2-3% NaCI бар сілті алынады.

Литий - ақ түсті, жылтыр, жұмсақ металл. Металдардың арасындағы ең жеңілі. Литий химиялық өте активті:
2 + 2H 2 O = LiOH + H 2
Реакциядан байқағанымыздай литийдін гидроксиді негізгі өнім ретінде қолданылып тұр.
Литий гидроксидін литий хлоридінің судағы ерітіндісін электролиздеумен алады. Оны электролит ретінде аккумуляторда қолданады.
Литий гидроксиді - түссіз, өте гидроскопты, суда еритін зат, күшті негіз. Басқа сілтілік металдардың гидроксидтеріне қарағанда қыздырғанда LiOH айырылады.
2 LiOH = Li 2 O + H 2 O
LiOH- ты LiСl- дың сулы ерітінділерін электролиздеу арқылы алады.
Кристаллогидраттар қатарында су молекулалары көпірлік байланыстар түзуге қатысады. Міне LiOH· H 2 O- да (моноклиникалық тор)Li + катион оттектің 4атомымен қоршалған қисық тетраэдр түзеді. Тетраэдр жұптас жалпы қабырғалармен біріктірілген (OH топтарының оттек атомдарының есебінен) .
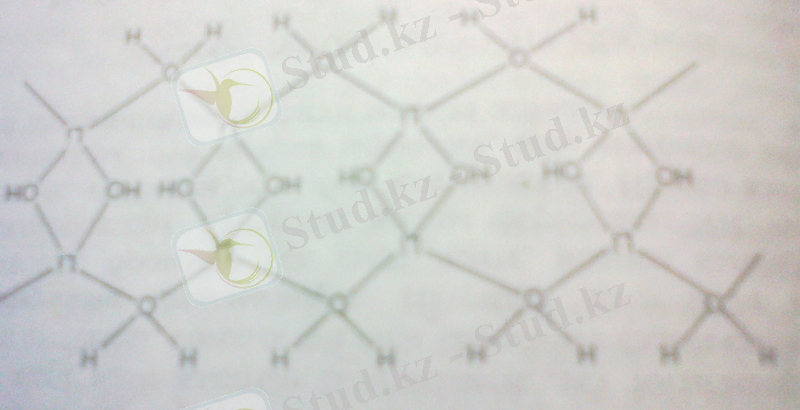
Тетраэдрдің көрші жұптары жалпы төбелермен біріктірілген. Тізбектер бір-бірімен сутектік байланыс арқылы байланысқан.
2. 1. 2. Натрий және калий гидроксидтерінің табиғатта таралуы мен қолдануы.
Өндірісте калий гидроксидін калий хлоридінен электролиз әдісімен өндіреді. Маңыздылығы - бұл процесс кезінде аппараттан калий ги дроксидімен қатар каустикалық соданы да ала аламыз.
КОНтың кең ауқымда қолдануы иіс сабындар өндірісі. Калий және натрий сабындарының қоспасы сұйық сабын алуда, шампунь және қырынатын гельдер, ағартушылар, белизна және кейбір фармацевтикалық аппараттар өндірісінде де қолданады.

Басқа ауқымды қолданысы калийдің әртүрлі тұздарын өндіру. Мысалы, калий перманганатын марганецтің диоксидін каустикалық поташпен тотықтыруы кезінде алады, камерада. Сонымен қатар оны каустикалық соданың қатысында бояулар өндірісінде және т. б. органикалық қосылыстар, тағы газдардың адсорбенті ретінде, дегидратациялаушы агент, тұндырушы бола алады. Оны тұрып қалған суларды майсыздандыруда, майларды рафинирлеу үшін, азот өндірісінде азоты кептіру үшін, никель -кадмий аккумуляторларында электролит ретінде, хирургияда күйдіруші аппарат ретінде кең қолданады.
Сонымен қатар тамақ өнеркәсібінде пищевой добавка E525 ретінде тіркелген. Аз мөлшерде метан өндірісінде, қышқыл газдарды сіңіруде, тағы ең маңыздысы кейбір катиондарды анықтауда кеңінен қолданады.
Қазіргі кезде цирконий өндірісінде де фторсыз цирконийдің гидроокисін алуда тиімді. Тағы айта кетерлік қазіргі кезде мәйіттерді ресомациялық сақтауда табтырмайтын қосылыс.
Калий гидроксидін шетелдерде өндіру көрсеткіштері
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz