Тау-сағыз (Scorzonera tau-saghyz) өсімдігін in vitro микроклонды көбейту мен каучук синтезін оңтайландыру


МАЗМҰНЫ
Каучук түзуші тау-сағыздың биосинтетикалық қасиеттері, изопреноид синтезі
ҚЫСҚАРТЫЛҒАН СӨЗДЕР
6-БАП - 6 -Бензиламинопурин
2, 4-Д - 2, 4- Дихлорфеноксисірке қышқылы
ИСҚ - Индолилсірке қышқылы
НСҚ - Нафтилсірке қышқылы
КІРІСПЕ
Тақырыптың өзектілігі: Тау-сағыз (Scorzonera tau-saghyz, Lipsch. et Bosse) күрделігүлділер тұқымдасы (Asteraceae) - Тянь-Шань ареалындағы жойылып бара жатқан эндемик өсімдік. Өте маңызды техникалық өсімдік, қоңыржай аймақтағы табиғи каучукқа ең бай шикізат көзі [1, 3] .
Қазіргі таңда 80% әлемдік синтетикалық каучук бутадиен және изопреннен жасалады. 20% химиялық синтез арқылы стирол, хлоропрен, этилен және басқа да полимерден жасалады. Табиғи каучук 20% құрайды. Латекс (цис-1, 4-полиизопрен) - каучук негізі. 2000 өсімдікте синтезделеді. Ол өндірістік масштабта Индонезия, Малайзия, Вьетнам елдерінде плантациялардан алынады. Табиғи каучук медицина, автомобиль шинасын жасауда, соның ішінде үлкен жүк тасушы және спорттық машиналарға қолданылады, себебі табиғи каучук синтетикалыққа қарағанда берік болып табылады. Табиғи каучукқа сұраныс артуы жаңа альтернативті көздер іздеуге себеп болды.
Қаратау каучукқа ең бай өсімдік - тау-сағыздың (Scorzonera tau-saghyz , Lipsch. et Bosse) Қазақстандағы табиғи өсетін аймағы [1] .
Тау-сағыз өсімдігінің саны соғыс жылдары күрт төмендеді, себебі 1, 4 млн өсімдік қазылып алынған болатын. Қазіргі таңда тау-сағыздың қоры қайта қалпына келу үстінде.
Тау-сағыз өсімдігінің ең құнды екенін ескере отырып, қандай да бір жоюшы фактор немесе өсуін тоқтататын шаралар мемлекетпен қудаланылады [2, 3] .
Ғылыми жаңалығы: Тау-сағыз өсімдігінің жапырақ және тамыр эксплантарының дақылдануы үшін залалсыздандыру әдісін жетілдіру маңызды болып табылады. Зерттелген залалсыздандыратын агенттердің арасында ең тиімді 0, 1% сулема және 70 % этанол екендігі анықталды. Жабайы өсетін тау-сағыз өсімдіктерін in vitro культураға енгізу және каллусогенезді оңтайландыру үшін 2, 4-Д, кинетин, БАП, ИСҚ фитогормондарының әртүрлі концентрациялары бар Мурасиге-Скуг (МС) және Гамборга-Эвелега В5 (В5) қоректік орталары қолданылды. 0, 1% тиомочевинамен алдын ала өндеу және стратификациядан кейін төмен өну қабілеті бар тұқымдарынан тау-сағыздың асептикалық өскіндерін алу мүмкіндігі анықталды.
Практикалық маңыздылығы : Бұл жұмыстың өзектілігі бірден тау-сағыздың (Scorzonera tau-saghyz) өсіп жатқан ареалындағы санының қайта қалпына келтіру проблемасын шешуде. Егілетін материалдардың аздығы, Қазақстанда оларды өсіретін саябақтардың жоқ болуына байланысты маңызды культураны өсіру мен технологияларды дамыту негізгі өзекті мәселе болып табылады. Осыған орай жылдам көбейтудің альтернативті технологиясын жасау, соның ішінде микроклонды көбейту технологиясын дамыту маңызды болып табылады.
Зерттеу жұмысының мақсаты: Жабайы өсетін тау-сағыз өсімдігін микроклонды көбейту үшін культивирлеудің оптималды жағдайларын анықтау.
Жұмыстың міндеттері:
- Жабайы өсетін тау-сағыз өсімдігінің формаларынin vitro культурасына енгізу;
- Тау-сағыз экспланттарын залалсыздандыру жағдайларын оптимизациялау;
- Тау-сағыз клетка культурасы үшін қоректік орта құрамын оптимизациялау;
- Микроклонды көбейту үшін тау-сағыздың асептикалық өскіндерін алу және оларды қалемшелеу.
Зерттеу объектісі :
Қаратау таулары аймағында өсетін Scorzonera tau-saghyz Lipsch. et Bosse жабайы өсетін эндемик өсімдіктердің түрлері; эксплант ретінде - 2-жылдық өсімдіктердің жапырақ сегменттері және тамыр сегменттері қолданылды.
Зерттеу әдістері:
- Залалсыздандыру әдісі: залалсыздандырушы агенттер ретінде 50% Na гипохлориді, калий перманганаты, асқын тотығы, 70% этанол, 0, 1% сулема пайдаланылды;
- Микроклондық көбейту әдісі: жапырақ, тамыр экспланттарынан пайда болған регенеранттарын және асептикалық өсімдіктерінен алынған микроқалемшелерін 16 сағаттық фотопериодта, 25±2º С температурада, 60% ылғалды жағдайларында өсіру;
- Статистикалық талдау әдісі.
“Жоғары дәрежеде табиғи каучук бар тау-сағыз өсімдігінің сорттарын алу мақсатында микроклонды көбейту әдісін жетілдіру” ғылыми жобасы бойынша жұмыс жүргізілді.
НЕГІЗГІ БӨЛІМ
- ӘДЕБИЕТКЕ ШОЛУТау-сағыз өсімдігінің биологиялық ерекшеліктері
Тау-сағыз ( Scorzonera tau-saghyz ) - күрделігүлділер тұқымдасына жататын көпжылдық өсімдік. Көпжылдық кейде 2 жылдық шөптекті және бұта тәрізді болып келеді, 170 түрі бар. Шөлейтті өңірлерде, соның ішінде көбіне Орта Европа және Шығыс Азияда өседі. Жуандаған жер асты мүшелері жеуге жарамды түрлері кездеседі, мысалы S. turberosa, S. hispanica . Европа мен Америкаға көкөніс ретінде өсіріледі. Ең маңыздысы тау-сағыз өсімдігінің тамырында каучук болатыны анықталған. Біржылдық тау-сағыздың тамырында 5-6% каучук, 2 жылдықта 9-10 %, 3 жылдық 12-15 %. Көпжылдық өсімдік тамырының диаметрі 10см -ге жетеді, ал ұзындығы 4 м, биіктігі 25-40 см [2] .
Ғылыми классификациясы:
Бөлім: Жабық тұқымды гүлділер
Класс: Қосжарнақтылар
Тұқымдас: Астрагүлділер
Туыс: Астрагүлділер
Түр: Тау-сағыз ( Scorzonera tau-saghyz, Lipsch. et Bosse ) [3] .
Сыртқы түрі жартылай бұта түріндегі қысқа, жуан тамыр сабақтан тұрады (каудекс) . Каудекс соңы бір немесе бірнеше астық тұқымдас өсімдігіне ұқсас біркелкі жапырақшалармен аяқталады. 1-4 гүл тостағаншасынан тұрады. Гүл шоғыры көптеген сары күлтешелерден (30-40) тұрады. Пісіп жетілген бақбақ өсімдігіне тән шар тәрізді болып, желмен жеңіл таралады. Тұқым - цилиндрлі, қабырғалы, үстіңгі бөлігінде ұшуға қабілетті айдары бар, ақ өскіншелермен.
Табиғи жағдайда өсімдік тұқыммен ғана емес, вегетативті жолмен сабақ пен тамырдың өскіндерімен көбееді. Вегетация уақыты ұзақ емеc −3-3, 5 ай. Табиғи жағдайда 3 жылы ғана гүлдейді. Гүлдеу мамыр- маусым аралығында, ал шілде - тамыз аралығында аз мөлшерде жеміс түзеді. Вегетация кезінде өсімдік биомассаны аз түзеді. Культуральды жағдайда тау-сағыз салыстырмалы тез өседі, 2 жылы гүлдей береді. Тұқымның қалыпты өсуі топырақтың 20-25°С температурасында жүзеге асады. Егер 9°С -дан төмен болса, олар өспейді және 25°С-дан жоғары температурада өсу қабілеті төмендейді. Тұқымдар өнуі үшін жылумен қатар, топырақтың беткі қабаты жақсы ылғалданған болу керек. Сондықтан суарып отыру қажет. Егер аталған жағдайлар жасалған болса, тау-сағыздың өскіндері 5-6 күннен соң шығады.
Өскіндер 2 жапырақшадан тұратын ұзынша формада болады. 7-10 күнде өскінде нағыз жапырақтар пайда болады. Олардың өсуі келесі жаздың маусымы мен шілдесіне дейін жалғасады. Жаздың ыстық температурасында жапырақ өсуі тоқтатылып, ескілері шіріп кетеді, ал өсімдік жаздық тыныштыққа көшеді. Келесі жапырақ өсуі қыркүйектен басталады [3] .
1 жылда тау-сағыз тамыры 1 м дейін өседі. 1 жылдық тамырдың салмағы орташа 2, 5-5 г болады. Ал каучук құрғақ салмағының 3-7 % алады [6] .
Тау-сағыздың вегетация уақыты 2 жылы көктемде басталады. 2 жылы тамырдың өсуі қарқынды жүреді және массасы 8-20 г жетеді. Кей жағдайда 40-80 г, ал каучук түзуі 7-12 % өседі. 3 жылы өсімдік гүлдей бастайды. Тұқымның 1 га жерден жиналғаны 15-60 кг құрайды. 1 га 30-35 ц тамыр, соның ішінде 15-20% каучук құрғақ массасын құрайды, яғни 150-250 кг каучук [3] (Сурет 1) .

Cурет 1. Scorzonera tau-saghyz
Каучук тамырының өзегінде және жер асты бұтақшаларында салыстырмалы көп мөлшерде болады. Табиғи каучукты алу үшін тау-сағыздың құрғақ тамырларын пайдаланады. Тамыр 40 % өнімнен тұрады. Өсімдікті 1929 жылы С. С. Зарецкий Қаратау өңірінен тапқан. Бұл өсімдік бұрыннан жергілікті тұрғындарға таныс еді. Егер тау-сағыздың тамырын бөлсе, каучуктың созылмалы жіпшелерін көруге болады. Каучук сонымен қатар тамырдан ғана емес, каудекстен және жапырақтан да анықталған [6] .
Жапырақта басқа органдарға қарағанда каучук аз мөлшерде болады. Сабақта каучук түзетін глобуллалар орналасады. Әр түрлі жастағы өсімдіктердің глобула формасы мен өлшемі әр түрлі. Өсімдік жасы өскен сайын мүшелері үлкейіп, формасы ұзарады. Соған байланысты өсімдікте өзектегі каучук мөлшері өзгереді. Егер 1 жылдықта 1-8% каучук болса, 2-3 жылдықта 8-30 % каучук мөлшері болады [3] .
Қазіргі кезде тау-сағыз “Қызыл кітапқа” енген. Бұл антропогендік фактор әсерінен болған, яғни соғыс жылдары 14 млн. өсімдік алынып пайдаланған. Кейін оның табиғи қоры толуы үшін ұзақ уакыт керек. Себебі өсімдіктен тұқымның түзілуі 3-4 -ші жылы ғана жүреді және жас кезінде өскіндердің өлімі көп кездеседі. Тау- сағыз сол аймақта өсетін басқа өсімдіктерге қарағанда бәсекеге төмен болып табылады [1] .
Өсетін аймағын интенсивті түрде басқа өсімдіктер қамтуы тау-сағыздың жойылуына себеп болып табылады. Сырдарияның Қаратау тауларынан алғаш тау- сағыз табылған, содан бері геологиялық процестер жүргізіліп, топырақта түрлі өзгерістер болған. Бұл да өз әсерін тигізді, яғни шөл және шөлейтті аймақта өсетін өсімдіктің өсуін шектейді.
Топырақ өзгеруіне байланысты көптеген өсімдіктер тау-сағыздың өсетін аймағын кішірейтуде. Төмен бәсекелестігіне байланысты тау-сағыз өсімдігі саны азаюда [7] .
Көптеген болжамдарға қарамастан табиғи каучук өндіру даму үстінде. 1963 жылы 2, 17 млн. тонна, 1973- 3, 45, ал 1981 жылы - 4 млн. тонна каучук өндірілді. Қазіргі таңда табиғи каучук өндіру ақталады. Төмен бағамен сатылса да, тиімді болып табылады. Табиғи каучуктың әлемдік нарықта бағасы синтетикалық полиизопренді каучуктың бағасына қарағанда төмен. Қазіргі таңда бағалы заттар өндіруде биотехнологиялық және гендік инженериялық әдістер қолдану арқылы табиғи каучукты тау-сағыз өсімдігінен өндіруге әбден болады [2] .
Вегетативті көбею бұл өсімдіктің белгілі бір мүшелерінен, яғни тамыр немесе сабақтың бөлігінің дифференциациясы арқылы жыныссыз жолмен көбею процесі. Жабық тұқымды өсімдіктердің ішінде вегетативті жолмен көбінесе құлпынай, тау-сағыз, раушан, батат т. б өсімдіктер көбееді. Тау-сағыз өсімдігінің негізгі көбею жолы - вегетативті тамыр арқылы [21]
Клеткалық және гендік инженерия әдістері көмегімен, мысалы, тау-сағыздың каучук синтездейтін гені бақбақ өсімдігіне енгізуге болады. Бақбақ та өз алдына каучук синтездеуге қабілетті деп саналады. Бұл қол жетімді, бірақ бұл әдісті қолдану үшін тау-сағыздың барлық генетикалық әртүрлілігін және генетикалық картаны анықтау керек [5] .
Қаратау аймағының табиғи жағдайларында тау-сағыздың 6 түрі табылған болатын. Олар ауылшаруашылықта пайдасы зор. Ең маңыздылары Қайнар-бастау аймағында өсетін тау-сағыз түрлері. Олардың бір-бірінен айырмашылығы жапырақ және гүлінің формасында.
Қайнар- бастау тау-сағызының жапырағы ұсақ және гүлі бүршіктелген тәріздес, сүтті жолы ақ түсті болып табылады. Басқа түрлерден айырмашылығы тез өну қабелеттілігінде. Екінші жылда өсімдіктің 5 % және 10% гүдей бастайды. Үшінші жылда гүлдеу 50%, ал тұқым өнімі 60 кг жетеді. Тамыры жақсы жетілген болып келеді.
Желаған-ата тау-сағыз түрі жуан жапырақтарымен ерекшеленеді. Гүлдері ұсақ. Дақылдау барысында бұл сорт жай өну қабілетіне ие екені анықталды. Төртінші жылы гүлдеу 20% ғана құрайды, ал тұқым өнімі 10-15 кг құрайды.
Леонтьевка тау-сағыз жуан лацентті жапырақ типіне ие. Гүлі жуан, сүтті жолы сары-жасыл түсті. Кеш пісіп жетіледі, үшінші жылы гүлдеу 10-15% құрайды [6] .
Тау-сағыз өсімдігінің өсуі үшін органикалық массаға бай және құнарлы топырақ болу қажет. Негізгі топырақ дайындау оптимальді жағдайларды қарастыру сатысынан тұрады. Топарқты әртүрлі зиянкестерден тазарту керек.
Тау-сағыз көпжылдық өсімдік болғандықтан топыраққа мына заттардың қажет мөлшерде себілуі өте маңызды болып табылады: аммоний сульфаттары, суперфосфат, калий тұздары т. б.
Тамыр жүйесі жақсы жетілуі маңызды болғандықтан минералды тыңайтқыштар маңызды рөл атқарады. Тыңайтқыштарды күзде сепкен өте тиімді болып табылады. Азотты тыңайтқыштарды көктемде сепкен тиімді.
Тау-сағыз өсімдігі өну үшін жеткілікті дәрежеде бақылануда болу керек. Ол үшін өсудің бірінші жылында ылғал көп мөлшерде болу маңызды. Сондықтан суаруды 8-10 рет жүргізу керек. Көктем және жаз айларында көп мөлшерде суару жүргізіледі, ал қыс айларында минимум дәрежеде жүзеге асырылу қажет [9] .
Тау-сағыздың тұқым түзуі үшінші жылы жүзеге асады. Тұқым пісіп жетілуі 5 сатыдан тұрады. Тұқымның түзілуі 3-4 -ші жылы ғана жүреді және жас кезінде өскіндердің өлімі көп кездеседі. Тау- сағыз сол аймақта өсетін басқа өсімдіктерге қарағанда бәсекеге төмен болып табылады Тұқымдарды жинаған кезде ең соңғы сатыдағы екеніне көңіл аудару керек. Яғни толықтай өнген тұқым болуы өте маңызды. Тау-сағыз тұқымдары қолмен жиналады. Кейін олар толықтай кебу керек, ол үшін белгілі уақыт оларды кептіреді. Тұқымдар өнуі үшін жылумен қатар, топырақтың беткі қабаты жақсы ылғалданған болу керек. Сондықтан суарып отыру қажет. Егер аталған жағдайлар жасалған болса, тау-сағыздың өскіндері 5-6 күннен соң шығады.
Тау-сағыз тамырларын жинау 3-4 жылдары жүзеге асады. Жаздық тыныштық қалыпқа көшкен кезге дейін. Тамырларын жинамас бұрын өсімдікті көп мөлшерде суару керек. Кейін тамырларды кетіру қажет. Оны ауада жүргізеді [5]
Тау-сағыз өсімдігінің таралу аймақтары: Қазақстан: Сырдария, Қаратау, Машат, Даубаба, Тәжікстан: Фан таулары, Өзбекстан: Ферғана солтүстігі, Қырғызстан: Талас Алатауы, Шатқал тауы, Түркістан қыраты, Исфир бассейні. Орта Азияның эндемик өсімдігі, Батыс Тянь-Шань, Қаратау, Тамир Алтайдың төмен немесе таулы, қыратты жерлерінде өседі [3] .
Тау-сағыз өсімдігінің саны соғыс жылдары күрт азайды, сол кезде 14 млн. өсімдік қазып алынды. Қазіргі кезде жайлап қайта қалпына келуде.
Табиғи таралуының негізгі шектеуші факторы: төмен бәсекеге қабілеттілік, тұқымның ұзақ уақыт пайда болуы, геологиялық жұмыстар, малға азық болуы, каучук түзуші ретінде көп қолданылуы [9] .
1. 2 Каучук түзуші тау-сағыздың биосинтетикалық қасиеттері, изопреноид синтезі
Каучуктың полиизопреноидының түзілуі клетка паренхимасында жүзеге асады. Алдымен каучуктың бөлігі цитоплазмада, кейін вакуольде түзіледі. Каучуктың бастамасы қант, ацетат, пируват, мевалонат болып табылады. Каучук - эмперикалық формуласы С
5
Н
8
, изопреннің полимердену өнімі мен молекулалық массасының алуан түрлі спектрінен тұрады.
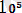 дейін, бұл 1500-6 полимерге эквивалентті [9] . Изопреноид көмірсуларының атомдары пируваттың декарбоксильденуі нәтижесінде ацетаттан түзіледі. (Сурет 2) .
дейін, бұл 1500-6 полимерге эквивалентті [9] . Изопреноид көмірсуларының атомдары пируваттың декарбоксильденуі нәтижесінде ацетаттан түзіледі. (Сурет 2) .
Сурет 2. Каучук биосинтезі
Көміртегінің екі атомы бар ацетат молекуласы ацетаттың үш молекуласының конденсациясы мен бір атом көміртегінің бөлінуінен С
5
 молекуланы изопренге айналдырады
молекуланы изопренге айналдырады
Изопреноидтар - көміртегі атомдарының тобынан тұратын табиғи қосылыс. Изопрендер терпен және олардың туындылары стероидтар, полиизопреноидтарға бөлінеді. Тірі организмдерде изопреноидтар сірке қышқылынан түзіледі. Изопреноидтарға каротиноид, мысалы витмин А, феромондар, каучук, ювенильді гормондар, гуттаперча жатады [22] .
Келесі кезең үш молекула ацетаттың қосылып бұтақталған тізбек түзуі ацетил коферменті қатысымен жүреді. Келесі кезең мевалонатқа айналудан тұрады. Кейін мевалонаттың фосфорилденуі жүреді. Сол кезде пирофосфатмевалонат түзіледі [8] .
Пирофосфатмевалонат ең негізгі изопреноид метаболизмінің реакциясына қатысады. Ол изопентилпирофосфат пайда болуы. Терпендердің, сесквитерпендердің және жоғарғы изопреноидтардың түзілуі цис-1, 4- көмегімен изопентилпирофосфат қалдығының ұзарған изопреноид тізбегіне қосылуы нәтижесінде пайда болады. Бұндай полимеризация әдісі изопреноид синтезінің негізі болып табылады
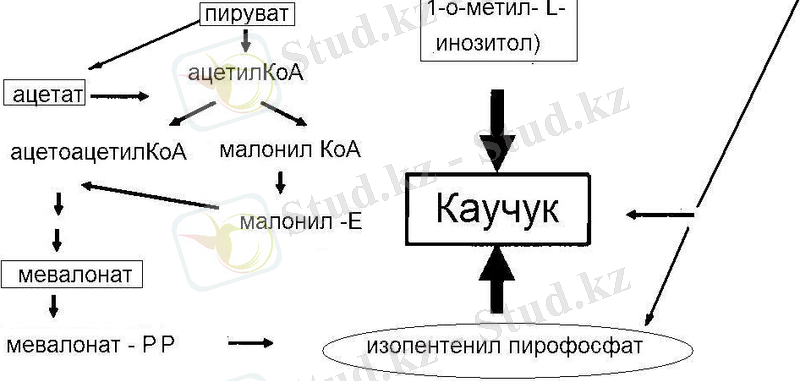
Бұл әдіс арқылы каучук түзілуі фруктозадан 1-0-метил- L-инозитол арқылы алуға болады. Каучук синтезінің жылдамдығы көптеген жағдайларға байланысты. Мысалы, Гевея ағаш Hevea brasiliensis латексінде ол 5 мг. Судың жеткіліксіз болуы каучук түзілуін арттырады. Каучук синтезін сонымен қоса, этилен де стимулдейді [8] .
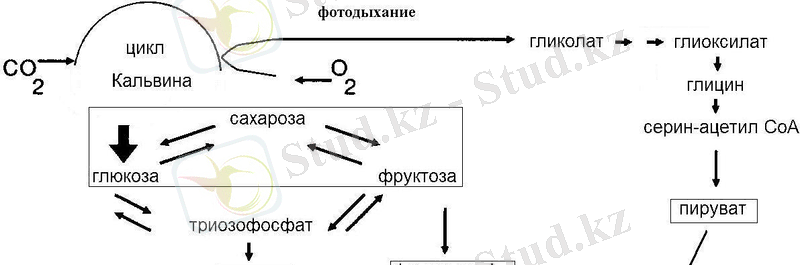
Сүттіген шырынының кей бөліктерінде каучук емес, тритерпеноидтарды эфирлер болады. Латексте терпеноидтар және терпеноидты спирттер де болады. Бұл дезинфицирлеуге қабілеттілігін арттырады. Терпеноидтармен қатар латекстен басқа да қосылыстар анықталған. Вакуольде мекон және хелидон қышқылы, фенол болады (Сурет 3) .
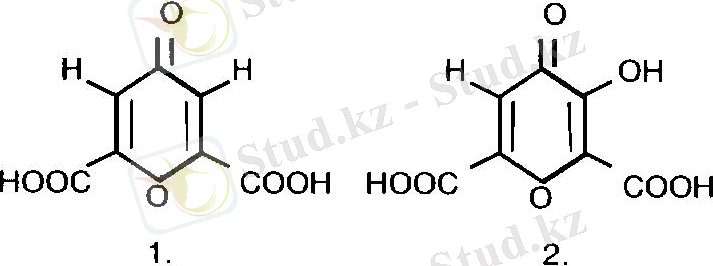
Сурет 3. Латекстегі хелидон (1) және мекон (2) қышқылы
Ең кең таралған амин қышқылы 3, 4-диоксифенилаланин (ДОФА) . Латексте ДОФА 1, 7% құрайды. Қорғаныш қызметін сүттіген шырынында лизоцим белоктары атқарады. Олар бактериалды полисахаридтік байланысты гидролиздейді [8] (Сурет 4) .
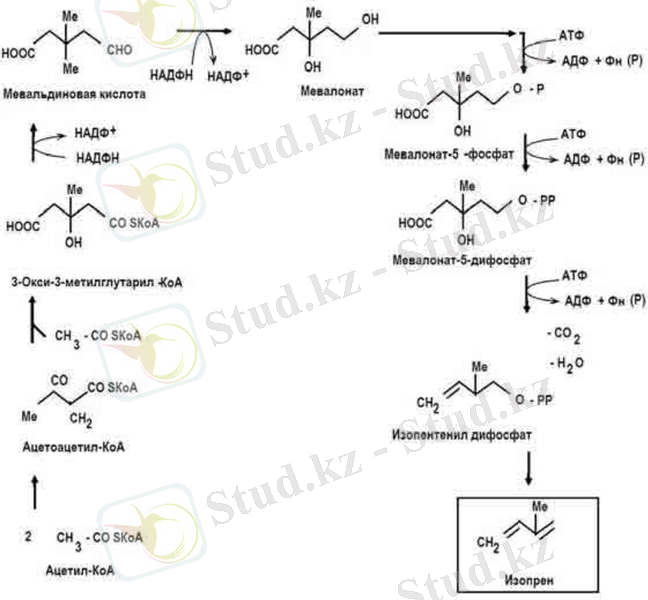
Сурет 4. Изопреннің түзілу жолы
Латекс - (англ. latex , нем. Latex m, Kautschukmilch f ) сулы ерітіндідегі дисперсті полимерлі заттардан тұратын эмульсия. Табиғатты өсімдіктің сүтті жолынан бөлінеді, соның ішінде бразилиялық гевея және бақбақ өсімдіктерінде т. б (Сурет 5, Кесте 1 ) .
Кесте 1
Каучук түзуші өсімдіктердегі латекстің құрамы

Сурет 5. Өсімдік кесіндісінен бөлінген латекс
Латекс құрамында коллоидты каучукты бөлшектер (глобула), беттік активті заттар эмульгаторлар болады. Латекстегі глобулалар ионогенді беттік-активті заттар арқылы тұрақтанған, көбінесе анион типті ионогендермен. Латекс полидиперсті жүйе. Алғашқы латекс глобуласының диаметрі 10-200 нм құрайды. Өндірістік масштабта әртүрлі мысалы, изопренді, бутадиенді, акрилді, карбоксилатты латекстер қолданылады [35] .
Каучукты латекстен бөліп алу үшін форманы тұз ертіндісі бар ертіндіге салып, мысалы, хлорлы кальция бар. Ертінді құрамында оң зарядталған металл бөлшектері - катиондар бар. Латексті ертіндіге салған кезде катиондар диффундирленеді. Латекс құрамындағы теріс зарядталған бөлшектермен соқтығысқан соң оң зарядталған бөлшектер оларды зарядынан айырады. Каучук бөлшектері ертіндіде тұнба түзеді.
Табиғи латексті тек концентрленген күйде ғана қолданады. Табиғи латекстен жасалған заттар салқын температураға тұрақты (- 67°), жоғары физико-химиялық қасиет көрсетеді. Вулканизацияланған пленкалар 200-350 кг/ құрайды.
Ең маңызды латекс қолданылатын сала болып адгезивтер түзу болып табылады. Ол шина, транспортерлік жіптер т. б жасауда маңызы зор. Басқа да мақсатта қолданылады: мата жасауда, фрикционды заттар жасауда, қағаз өндірісінде, тері өндеуде, электротехникада, жол құрылысында т. б салаларда кеңінен қолданылады [42] .
Каучук - жоғары молекулалы көмірсутегі, эмпирикалық формуласы . Құрылымдық жағынан изопрен полимерлену өнімі болып табылады. (Сурет 6) .

Cурет 6. Каучуктың формуласы
Каучук бензолда, петролейндік эфирде, күкіртті эфирде ериді, бірақ ацетон және спиртте ерімейді. Каучук молекулалық массасы әртүрлі гомологты полимерлердің қоспасы. Каучук әртүрлі өсімдік тканьдерінде жиналуы мүмкін. Клетка паренхимасында түзіледі. Тау-сағыз, көк-сағыз, гевея сияқты өсімдіктерде көп мөлшерде жинақталады [14] .
Өсімдіктегі сүтті жолда активті ферменттер көп мөлшерде болады. Олар протеолиттік және тотығу ферменттері. Ферменттердің көп болуы каучук биосинтезімен тығыз байланысты. Сүтті жолда каучук микроскопиялық бөлшек түрінде болады (глобула) .
Латекстегі каучук мөлшері әр өсімдікте әртүрлі формада болып келеді. Каучук глобулаларының сырты жіңішке белокты қабықпен қапталған.
Каучук биосинтезіне тоқталар болсақ, қазіргі кезде зерттеулерге қарағанда каучук өсімдік ұлпалары бойымен жылжуға қабілетсіз. Сондықтан каучук жинақталатын өсімдік мүшелері биосинтез жүретін негізгі орын екені анықталды. Каучук биосинтезі үшін алғы зат көмірсулар және олардың туындылары саналады. Мысалы, тау-сағыз өсімдігінің тамырында жиналатын каучук түзілуінің алғы заты қант екені анықталды [23] .
Ацетат, яғни ацетил қалдығы каучук биосинтезі үшін қажет негізгі зат болып табылады. Каучук және гутта биосинтезі каротиноидтар және терпендердің синтезімен тығыз байланысты. Бұл қосылыстардың барлығы өсімдікте А коферменті қатысуымен активті ацетилден түзіледі.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz