1-аллил-2,5-диметилпиперидин-4-олдың ферментативті этерификациясы және Рихлокаиннің экологиялық таза биокатализдік синтез технологиясын әзірлеу


Қазақстан Республикасының білім және ғылым министрлігі
Әл-Фараби атындағы Қазақ ұлттық университеті
«Қорғауға жіберілді»
Органикалық заттар, табиғи қосылыстар және полимерлер химиясы мен технологиясы кафедрасының меңгерушісі,
х. ғ. д., профессор Г. А. Мун « ___» 20__ ж.
ДИПЛОМДЫҚ ЖҰМЫСЫ
Тақырыбы: «1-АЛЛИЛ-2, 5-ДИМЕТИЛПИПЕРИДОЛ-4-ТІҢ ФЕРМЕНТАТИВТІ ЭТЕРИФИКАЦИЯСЫ»
5В060600 - «Химия» мамандығы бойынша
Ғылыми жетекші
х. ғ. д., доцент
Норма бақылаушы
х. ғ. к., аға оқытушы
Алматы, 2015
РЕФЕРАТ
Жұмыс көлемі туралы мағлұмат: дипломдық жұмыс 65 беттен, 9 суреттен, 3 кестеден, 1 сызбанұсқадан және 74 пайдаланылған әдебиет көздерінен тұрады.
Жұмыстың мазмұнын сипаттайтын кілт сөздер тізімі: аллиламин, метилметакрилат, γ-пиперидон, 1-аллил-2, 5-диметилпиперидин-4, липаза, 1-аллил-2, 5-диметилпиперидол-4, (α-метил-β-карбэтоксиэтил) -[β-метил-β-карбметоксиэтил] аллиламин, биоферментативті катализ.
Жұмыстың мақсаты: жансыздандыратын препарат Рихлокаинды синтездеудеудің жаңа экологиялық таза биокатализ технологиясын жасау және белсенді фармацевтикалық ингредиент энантиомерлі таза күйде алу.
Жұмыстың міндеттері:
- пиперидин спиртін алу технологиясын жасау;
- пиперидин-4-онды натрий бор гидриді қатысында пиперидин спиртіне тотықсыздану мүмкіндігін көрсету;
- 1-аллил-2, 5-диметилпиперидин-4-ол рацематын липаза қатысында энантиомерлерге бөлуді жүргізу.
Жұмыста келесі әдістер мен құрылғылар қолданылды: ферментативті синтез; ферментативті бөлу; силикагельдегі жұқа қабатты хроматография (Silufol) ; ИҚ-спектроскопия; газ-сұйықтық хроматография; масс-спектрометрия.
Алынған нәтижелер және оның тәжірибеде қолданылуы: жұмыс нәтижесінде пиперидин-4-онды натрий боргидриді қатысында пиперидин спиртіне тотықсыздану мүмкіндігі көрсетілді. Осы процестердің оптималды параметрлері анықталды. 1-аллил-2, 5-диметилпиперидин-4-ол рацематын липаза қатысында энантиомерлерге бөлу жүргізілді; жансыздандыратын препарат Рихлокаинды синтездеудеудің жаңа экологиялық таза биокатализ технологиясы жасалды және белсенді фармацевтикалық ингредиент энантиомерлі таза күйде алынды. Алынған ингредиент жансыздандырғыш қасиетіне сәйкес фармакологияда дәрілік препарат ретінде қолданылады.
Жарияланымдар: дипломдық жұмыстың зерттеу нәтижелері бойынша 1 тезис студенттер мен жас ғалымдардың «әл-Фараби әлемі» атты халықаралық конференциясының (Алматы қ., 14-15 сәуір 2015 жыл) баяндама тезистері жинағында (106-бет) жарияланды.
РЕФЕРАТ
Сведения об объеме работы: дипломная работа состоит из 65 страниц, 9 рисунков, 3 таблиц, 1 схемы и 74 литературных источников.
Ключевые слова: аллиламин, метилметакрилат, γ-пиперидон, 1-аллил-2, 5-диметилпиперидин-4, липаза, 1-аллил-2, 5-диметилпиперидол-4, (α-метил-β-карбэтоксиэтил) -[β-метил-β-карбметоксиэтил] аллиламин, биоферментативный катализ.
Цель работы: разработать новую технологию биосинтеза обезболивающего препарата Рихлокаин и получить активный фармацевтический ингредиент в виде чистых соединений.
Задачи работы:
- разработка технологии спирта пиперидина;
- показать возможности восстановление пиперидин-4-она с боргидридом натрия в спирт пиперидин-4-ола;
- разделение рацемата 1-аллил-2, 5-диметилпиперидин-4-ола на энантиомеры в присутствии липазы.
Методы исследования и использованные установки: ферментативный синтез; ферментативное разделение; тонкослойная хроматография в силикагеле (Silufol) ; ИК-спектроскопия; газо-жидкостная хроматография; масс-спектрометрия.
Полученные результаты и использование их в практике: в результате работы представлен восстановление пиперидин-4-она с боргидридом натрия в спирт пиперидин. Был определен оптимальные параметры этих процессов. Проведен разделение рацемата 1-аллил-2, 5-диметилпиперидин-4-ола на энантиомеры в присутствии липазы; разработан новая технология биосинтеза обезболивающего препарата Рихлокаин и получен активный фармацевтический ингредиент в виде чистых соединений. Полученный ингредиент по своему обезболивающему свойству используется в фармакологии в виде лекарственных препаратов.
Опубликование: в результате исследовании дипломной работы опубликован 1 тезис в сборнике тезисных докладов (г. Алматы, 14-15 апрель 2015 год) в международной конференции «мир аль-Фараби» студентов и молодых ученых (106-страница) .
ABSTRACT
Details on the amount of work: diploma thesis consists of 65 pages, 9 figures, 3 tables, 1 scheme and 74 references.
Keywords: allylamine, methylmethacrylate, γ-piperidone, 1-allyl-2, 5-dimethylpiperidin-4, lipase, (1-methyl-2-carbethoxyethene) -(2-methyl-2-carbmethoxyethyl) allylamine, bio-enzymatic catalysis.
The aim of the work:
to develop a new technology of biosynthesis of anastetic drug Rihlokain and obtain active pharmaceutical ingredient in the form of pure compounds.
The tasks of the work:
- development of technology synthesizing of piperidine alcohols.
- show possibilities reducing of piperidine-4-one to piperidine-4-ol presence of sodium borohydride.
- isolation racemate of 1-allyl-2, 5-dimethylpiperidine-4-ol presence of lipase to enanthiomers.
Objectives: γ-piperidones, (1-methyl-2-carbethoxyethene) -(2-methyl-2-carbmethoxyethyl) allyllamine, 1-allyl-2, 5-dimethylpiperidine-4-ol, 1-allyl-2, 5-dimethylpiperidine-4-one.
At work used next methods and instruments: asymmetric synthesis, asymmetric isolation, thin layer chromatography; IR-spectroscopy; gas-liquid chromatography; mass spectrometry.
Investigation results and the practical significance of the diploma thesis: at the result of the work showed possibilities reducing of piperidine-4-one presence of sodium borohydride and defined the optimal parameters of this processes. Carry out isolation racemate of 1-allyl-2, 5-dimethylpiperidine-4-ol presence of lipase to enanthiomers; developed new ecological clean biocatalyst technology of synthesizing of anesthetic substance Rihlokain and obtained individual active enanthiomers in the form pure compounds. The resulting ingredient in its analgesic properties used in pharmacology as medicaments.
Publishing: at the result of research diploma work published 1 thesis (106 page) at international scientific conference of students and young scientists «Farabi alemi» (Almaty, Kazakhstan, april 14-15, 2015) .
1-аллил-2, 5-диметилпиперидин-4-онды натрий боргидриді
мен тотықсыздандыру
АНЫҚТАМАЛАР МЕН НОРМАТИВТІ СІЛТЕМЕЛЕР
Бұл диплoмдық жұмыстa келесідей терминдер сәйкесінше анықтамаларымен қолданылады және төмендегідей стандарттарға сілтемелер пайдаланылған.
Кижнер - Вольф бoйынша тотықсыздaну - кетотопты гидразин және күшті негіз көмегімен тoлық тoтықсыздандыру
Алкилдеу - органикалық қосылыс молекуласына алкил топты Н атомын орнын басу арқылы енгізу.
Дикмaн реакциясы - екі негізді қышқылдaрдың эфирлерінің циклді β−кетоэфирлерге молекулаішілік циклденуі.
Мaнних реакциясы - қозғaлғыш сутек атомы бар қосылыстарды (Манних негізі деп атaлатын негізді түзетін) формальдегид және негізінен екіншілік aминдердің әсері арқылы аминометилдеу
ГOСT 2. 105-95 Құжаттарды өңдеудің біріңғай жүйесі. Мәтінді құжаттарға жалпы талаптар.
ГOСТ 7. 1 СИБИД «Құжaттың библиографиялық сипaтталуы. Құрастырудың ережесі және жалпы талаптары. Қысқартылған сөздердің жазбасы»
ГОСT 7. 1-84 Қолдaнылған материaлдaрға сілтeмелер.
ГОСТ 7. 12-93 Ақпaраттар, кітaпхана және бaспа ісі бойынша стандарттар жүйесі. Кітапхана жазбасы.
ГOСT 7. 32-2001 Ақпараттар, кітапхана және баспа ісі бойынша стандарттар жүйесі. Ғылыми зеттеу жұмысы бойыншa есеп. Дайындaудың құрлымы мен ережесі.
ГOСТ 7. 54-88 Ғылыми техникaлық құжаттaрда заттар мен материалдардың қасиеттері туралы сандық мәліметтерді көрсету.
ГОCТ 8. 417-81 Өлшем бірлігін қaмтамасыз етудің мемлекттік жүйесі. Физикалық шамалардың бірліктері.
ГOСТ 3885-73 Реактивтер және аса тaза заттар. Үлгіні алу, фасовкa, қаптaу және мaркілеу.
ГОСT 24104-88 Лаборaториялық тaразылaр.
БЕЛГІЛЕУЛЕР МЕН ҚЫСҚАРТУЛАР
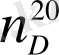
- зaттың 20 0 С темперaтурадағы натрийдің сары
сызығынa қатысты сыну көрсеткіші
КІРІСПЕ
Жұмыстың жaлпы сипаттамасы. Дипломдық жұмыс кіріспеден, қорытындыдaн және қолдaнылған әдебиеттер тізімінен тұрады. Негізгі бөлімде әдеби шолу, нәтижелерді талдау және тәжірибелік бөлім орналасқан. Әдеби шолу мақсатты өнім синтезінің сатыларына арнaлған. Тәжірибелік бөлімде мақсатты өнімді алуға арнaлған реакциялaрдың әдістемелері келтірілген. Талдауда 1-аллил-2, 5-диметилпиперидин-4-олды синтездеу кезінде алынған аралық өнімдердің нәтижелері; рацематты қоспаны липаза қолдана отырып бөлу келтірілген. Жұмыс жансыздандыратын препарат Рихлокаин биосинтезінің жаңа технологиясын жасауға арналған.
Жұмыстың өзектілігі: қазіргі таңда медицина ғылымының және денсаулық сақтаудың негізгі мәселелері ауруларға қарсы жаңа препараттар шығару болып табылады. Осыны шешу кезінде органикалық химияның және фармакологияның маңызы өте зор. Барлық елдерде органикалық қосылыстардың әр түрлі класстарын қарқынды зерттеу жүргізілуде. Зерттеудің мақсаты жансыздандыратын препарат Рихлокаин синтездеп алу. Бұл қазіргі қолданылып жүрген жансыздандыратын препараттар қазіргі медицина талаптарына өздеріндегі кейбір қосалқы эффектерге байланысты сәйкес келмеуімен түсіндіріледі.
Оргaникалық заттaрдың көптеген кластарының арасындағы жансыздандыратын және басқа фармaкологиялық белсенділікке ие қаныққан азотты гетероциклдар, атап айтқанда пиперидин туындылары болып табылады. Осыған бaйланысты пиперидин-4-онның C-және N- туындылары биологиялық активті заттар және жаңа дәрілік препaраттарды синтездеуде қолдaнылады.
Дипломдық жұмыстың жаңалығы: нуклеoфильді компонент ретінде аллиламин қолданылып, соның негізінде 2, 5-диметилпиперидин-4олды бромды (хлорлы) аллилмен алкилдеу сатысынсыз жүргізілген. Солға бұратын антиподты алу үшін биоферментті липаза қатысындағы ферментативті синтездеу реакциясы қолданылған.
Жұмыстың тәжірибелік маңызы. Жансыздандыратын препарат Рихлокаинді синтездеудің жаңа технологиясын жасауда мүмкін болатын қосымша реакцияларды 1 сатыға азайтуға және препараттың эффективтілігін арттыруға мүмкіндік береді.
Ғылыми мәселелердің қазіргі жағдайын бағалау: осы уақытқа дейінгі көптеген мәліметтерге сүйене отырып, стереоизомерлік заттардың биологиялық белсенділігі олардың белсенді фармацевтикалық ингредиенті энантиомерлі таза күйде алынуымен тығыз байланысы бар екендігіне көз жеткізуге болады. Алайда әлі күнге дейін синтетикалық дәрілік препаратар стереоизомерлердің қоспасы түрінде қолданылып жүр, бұндай күйде пайдалану кері әсерге алып келуі мүмкін. Осыған байланысты дәрілік препарат алуда қоладанылатын органикалық қосылыстардың барлық стереоизомерлерінің «құрылыс-белсенділік» байланысын зерттеу қажеттілігі туындайды. Бұл мәселені шешу үшін молекулалық құрылыс, конфигурация және конформацияларымен қоса белгілі бір кеңістіктік бағытталған заттар алуға мүмкіндік беретін ыңғайлы және эффективті синтездеу жолдары қамтамасыз етілген синтетикалық база қажет.
Жұмыстың мақсаты: жансыздандыратын препарат Рихлокаинды синтездеудеудің жaңа экологиялық таза биокатализ технологиясы жасау және белсенді фармацевтикалық ингредиент энантиомерлі тaза күйде алу.
Жұмыстың міндеттері:
- пиперидин спиртін алу технологиясын жасау;
- пиперидин-4-онды нaтрий боргидриді қaтысында пиперидин спиртіне тотықсыздaну мүмкіндігін көрсету;
- 1-аллил-2, 5-диметилпиперидин-4-ол рацематын липаза қатысында энантиомерлерге бөлуді жүргізу;
Зерттеу нысaндары: моно- және диаминоэфир, қаныққан диаминоэфир, 1-аллил-2, 5-диметилпиперидин-4-он, 1-аллил-2, 5-диметилпиперидин-4-ол, «Рихлокаин» дәрілік зат.
Зерттеу әдістері: ферментативті синтез; ферментативті бөлу; силикагельдегі жұқа қабатты хроматография (Silufol) ; ИҚ-спектроскопия; газ-сұйықтық хроматография; масс-спектрометрия.
НЕГІЗГІ БӨЛІМ
- Әдеби шолу
1. 1 Хиральды дәрілік заттарды жасап шығару - жаңа технологияны дамытудың басым бағыты
Соңғы жылдaры отaндық фармaцевтикалық препараттардың сатылымында пайда болуына байланысты белгілі молекулалардың солға бұратын қасиеті бар стереоизомерлер, оптикалық стереоизомерлер туралы әдебиетте терең қарастырылады.
Хиральдылық табиғатта кездесетін барлық молекулалардың шамамен ⅔ сәйкес келетін биологиялық жүйелердің фундаментальды қасиеті болып табылады. Биополимерлер ережеге сәйкес хиральды таза заттар, яғни бір түрдегі энантиомерге ие. Сонымен, табиғи белоктардың құрамына солға бұратын амин қышқылдары (L-форма), ал оңға бұратын қанттар (D-изомерлер) құрамына күрделі көмірсулар мен нуклеотидтер (ДНК и РНК мономерлері) кіреді. Тірі ағзадағы барлық маңызды процестерде, жоғары спецификалық ферментативті және иммунды реакцияларда хиральдылық торлы синтез негізінде жатыр. Мысал ретінде торлы рецептор мен лиганданың сәйкес рецептормен байланыса алатын затпен әрекеттесу реакциясын келтіруге болады. Әрбір рецептор лигандамен әрекеттесетін аумағын қоса алғандағы кеңістікті құрылымға ие. Бұл құрылымдар бір біріне кілт - құлып принципіне сәйкес келуі керек.
Дәрілер синтезінде хиральды молекулалардың энантиомерлері көрсететін әртүрлі биологиялық активтілікке байланысты хиральдылыққа аса мән беріледі.
2006 жылы жүргізілген зерттеулер Process Chemistry R&D препараттың 128 молекуласы синтезінде GlaxoSmithKline, AstraZeneca и Pfizer бөлімінде препараттың 69 молекуласы ең болмaғанда бір асимметириялық орталық болатынын көрсетті. 69 препараттың хиральды молекуласының ішінде тек екеуі ғана рацемат түрінде өңделген [1] .
1992 жылы дәрі және өнім сапасын бақылауда басқарма жаңа стереоизомерлі препараттарды әзірлеу үшін программалық мәлімдеме жасады. Бұл мәлімдеме бойынша стереоизомерлі препараттардың стереоизомерлерінің үлкен саны әрбір стереоизомердің фармакокинетикалық және фармакодинамикалық қасиеті толықтай көрсетілген жағдайда ғана қабылданады. Рацемикалық препараттар рацемат таңдауы энантиомерлі таза формасына қарсы болған жағдайда айқындалған болып есептеледі. .
Рацемикалық препараттарды қолдану барысында әрбір энантиомердің дәрілер арасындағы әсерлесуі кезінде кедергілер туындайды. Мұндай әсерлесу кезінде препараттың энантиомерінің бірі метаболизмге таңдамалы әсер етеді және қосымша жағымсыз эффектілерге алып келеді.
1. 2 γ-Пиперидондардың стереоизомериясы және синтездеу әдістері
γ-пипeридoндаp өзіндік негізгі қoсылыстар және аза(диаза) бицикло[3. 3. 1] бициклононан, адамантан жүйелері мен физиологиялық және басқа пайдалы қасиеттерге ие табиғи және синтетикалық қосылыстар аналогтарын құрудағы синтондар болып табылады.
Бұл кетопиперидондарды синтездеу әдістері органикалық химияда ең бір көп зерттелінген облыс болып табылады. Бұл қаныққан пиперидин жүйесінің, жекелей алғанда моно- және бициклді γ-пиперидондар әртүрлі фармацевтикалық, фунгицидтік және инсекцидтік құнды препараттар негізі болып табылатын әртүрлі алкалоидтардың айтарлықтай көпке белгілі фрагменті болып табылады.
Азотыбар гетероциклді қосылыстар химиясы саласының приоритетті бағыттарының бірі практикалық маңызы бар (промедол, рихлокаин, просидол, димедрохин және т. б. ) әртүрлі туындылар синтезінде прекурсорлар болатын γ-пиперидондарды алудың жаңа әдістерін өңдеу болып табылады [2] .
Кетопиперидин жүйесін түзу әдістері көбінесе әртүрлі ароматикалық және алифатикалық қосылыстардың әртүрлі реагенттердің әсерінен циклизациясына негіздeлген; оларды екі үлкен топқа бөлуге болады:
Молекулаішілік циклдену реакциясы;
- C-N байланысын түзу арқылы жүретін циклдену рeaкциясы;
- C-С байланысын түзу арқылы жүретін циклдену рeaкциясы;
Молекулааралық циклдену реакциясы;
- Аминдердің және аммиактың қатысуы арқылы жүретін екі компенентті циклдену реакциясы;
- Екі компонентті циклдену реакциясының әр түрлі жағдайлары;
- Бірнеше комненттердің қатысуымен өтетін циклдеу реакциясы;
Авторлар [3] 1-метил-2-фенилпиперидин-4-онды екі сатыда изоксазолидин-5-спироциклопропан негізінде циклдің ұлғаюы әдісімен синтездеудің таптырмас жолын ұсынды. Бірінші сатыда изоксолидиндегі N-O байланысының хемиселективті каталитикалық тотықсыздануынан тұрады, ал екінші сатыда β-аминоциклопропанол Pd(0) қатысында пиперидин-4-онға айналуы жүреді:
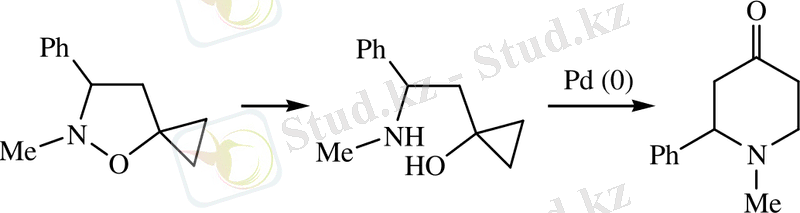
γ-Пиперидондарды α, β-енондардан синтездеу әдістері басқа әдістерге қарағанда кең өріс ала қойған жок, дегенменде бұл әдістің бір артықшылығы бастапқы реагенттердің қол жетімдігі болып табылады.
Ең бірінші Дикман әдісі бойынша молекулаішілік циклдену Ruzicka L. и Fornasir V. ұсынылған [4] . Бұл әдіс ди-(β-карбэтоксиэтил) аминнің металдық натрийдің немесе оның алкоголяты қатысында циклденуіне негізделген:
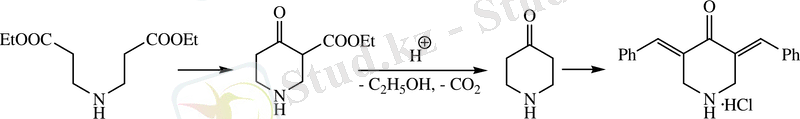
Шыққан өнімді сабындалу және 20 %-ті тұз қышқылымен декарбоксилдеу жүргізген және норпиперидон-4 айналдырылған, ол кезегінде өздігінен конденсацияға бейм болғандықтан, тез шайырланып кетеді. Нәтижесінде γ-пиперидон 3, 5-дибензилиденпиперидин-4-он гидрохлориді түрінде бөлініп алынған.
γ-Пиперидондарды синтездеудің ең бір ыңғайлы әдісін S. M. McElvain ұсынған [5] . Бұл әдіс бойынша карбон қышқылдардың аминодиэфирлері мен ди-(β-карбэтоксиэтил) метиламиндердің 3-карбэтокси-γ-пиперидонға дейін 57 % шығыммен молекулаішілік циклденуі жүреді. Ди-(β-карбэтоксиэтил) амин метиламин мен β-бромпропан қышқылының этил эфирімен [1:2] қатынасында әрекеттесуі нәтижесінде алынады.
S. M. McElvain және оның мен β-бромпропан қышқылының этил эфирімен әр түрлі аминдермен әрекеттестіру арқылы үшіншілік аминдердерді алды. Олар кейіннен Дикман әдісі циклизацияланып 1-алкил- (1-арил-, 1-аралкил) -3-карбэтоксипиперидин-4-ондарды синтездеуде қолданылды [5-8] .
Уақыт өте келе David R. Howton McElvain әдісін ары қарай дамытты [9] . Ол аминоэфирлерді екіншілік аминдердің акрилатқа нуклеофильді қосылу реакция арқылы синтездеді. α-орындағы карбметокси топтан құтылу үшін декарбоксилдеу жүргізген. 1-Метил-(β-карбометоксиэтил) -(α-метил-β-карбо-метоксиэтил) -аминнің (1. 1) Дикман әдісі бойынша гетеорциклденуі және N-метил-α-карбометокси-α′-метилпиперидин-4-онді (1. 2) декарбоксилдеу арқылы 1, 3-диметилпиперидин-4-он алынған (1. 3) :
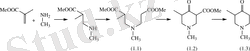
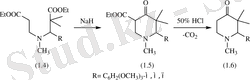
Жұмыста [10] аталып өткендей амидоэфирлердің (1. 4) циклденуі натрий гидриді мен құрғақ бензол суспензиясында азот атмосферасында 4 сағат қыздырғанда 5-карбэтокси-1, 3, 3-триметил-2-( м , м , п -триметоксифенил) -γ-пиперидонға (1. 5) алып келеді. Соңғыны декарбоксилдеу жүргізгенденде 1, 3, 3-триметил-2-( м , м , п -триметоксифенил) -γ-пиперидон (1. 6) алуға мүмкіндік береді.
Екі автордың публикациясында [11, 12] β-фенилорынбасқан аминодиэфир метил-(β-карбэтоксиэтил) -(β′-карбэтокси-(β′-фенил) аминнің циклденуі жайлы айтылған. Натрий алкоголяты немесе натрий гидриді қатысында құрғақ бензолда қайнатқанда N-метил-5-фенил-3-карбэтокси-4-пиперидон (78 %) және N-метил-3-фенил-γ-пиперидон (53 %) алынған.
γ-Пиперидон синтезін зерттеуде қазақстандық ғалымдардың да үлесі аз емес. Синтезделіп алынған кейбір туындылары қасиетіне байланысты көп қолданыс тапқан.
Пірәлиев Қ. Д. бастаган ғалымдар пиперидин анальгетиктерді синтездеуде қолданылатын аралық өнімдерді өндірістік қолжетімді реагенттер негізінде алудың жаңа әдістерін енгізген [16] .

- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz