Химиялық реакциялардың кинетикасы мен энергетикасы: жылдамдық, катализ және химиялық тепе-теңдік


Химиялық реакциялардың кинетикасы мен энергетикасы
§ 1. Химиялық реакциялардың жылдамдығы
Химиялық реакция процесі кезінде заттардың мөлшері өзгереді: алғашқы - реагенттердің мөлшері кемиді және соңғы - өнімнің мөлшері өседі. Осындай өндірістің жылдамдығын химиялық реакциялардың жылдамдығы деп атайды
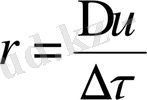 ,
,
мұнда r - жылдамдық (ағылшынша «rate») ;
Δυ - зат мөлшерінің өзгеруі
Δτ - уақыт интервалы.
Әдетте, егер реакция ерітіндіде өтсе, заттың мөлшері реакциядағы кеңістіктік көлен (V) бірлігіне жатады,
онда
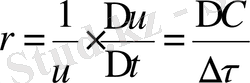
мұндағы ΔС молярлық концентрацияның өзгеруі. Бірақ, мысалы
 реакциясында А заты В затына қарағанда, жайымен 2 и рет жұмсалады, және А заты бойяынша жылдамдықтың сандық мәні (А заттың концентрациясының өзгеруі) В затына қарағанда 2 есе кіші болады.
реакциясында А заты В затына қарағанда, жайымен 2 и рет жұмсалады, және А заты бойяынша жылдамдықтың сандық мәні (А заттың концентрациясының өзгеруі) В затына қарағанда 2 есе кіші болады.
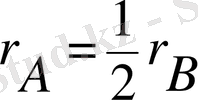
Сондықтан, концентрацияның өзгеруімен қандвай заттың жылдамдығын өлшейтінін көрсету керек. Одан басқа, егер бір зат реагент болса, онда оның мөлшері азаяды (ΔС<0), ал егер өнім болса, онда (ΔС>0) өседі. Барлық уақытта r > 0 болуы үшін, жазуда сәйкес келетін белгіні таңдаймыз
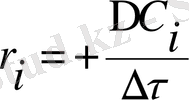
мұндағы τ - алынған реакция қатысушысы.
Гетереогендік реакция жағдайында, яғни фазалар шекарасында жүретін реакция (қатты-қатты, қатты-сұйық және т. б. ) реакцияласатын заттардың мөлшері S ауданның фазааралық бетінің бірлігіне жатады.
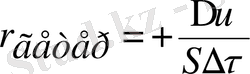
1. Төмендегі реакцияда әрбір затта қатысушы жылдамдығын көрсетіп, өзара салыстырыңдар:
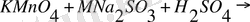
2. Реакция жылдамдығын эксперимент анықтайтын затты немен түсіндіруге болады.
3. 1-сұрақта келтірілген реакция жылдамдығын қандай затпен анықтауға болады.
4. Бірнеше деңгейде жылдамдықты ұстап тұратын, азайтатын немесе тездететін реакция мысалдарын келтіріңіздер.
5. Реагенттеуге ұшырайтын беті көп болған сайын, гетерогендік реакцияның жылдамдығы көп болатынын жиі оқуға болады. Гетерогендік реакция жылдамдығы теңдеуінің S алымына қараңдар. Түсінік беріңдер.
§ 2. Реакция жылдамдығының реацияға түсетін заттардың табиғатына концентрацияға температураға байланыстығы
Молекула мен заттың құрылыстың байланысты (егер ол молекулалы болмаса) олар әр түрлі жылдамдықпен өзара реакцияға түседі. Мұнда реагент заттардың химиялық байланысының беріктігі аз болған сайын, олар реакцияға тез қатысатыны айқын. Сонымен, мысалы, тұрақтылығы аз озон О 3 және оттегі О 2 қарағанда реакциялық қабілеті көп, ақ фосфордың қызыл фосфорға қарағанда реакциялық қабілеті көп және т. б. Химиялық әрекеттесуші акт реагент бөлшектерінің соғылысуынан шығады. Уақыт бірлігінде жүретін мұндай соғысулар сөп болған сайын, реакция жылдамдығы жоғары болады.
Соғысулар саны берілген көлемінің бөлшектер санынан, яғни концентрациясынан тұрады. Сондықтан реакция жылдамдығы реакциясы түсетін заттардың концентрациясынан пропорционал (мұнда масса әсер ету заңынан тұрады)
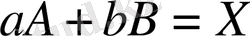 реакциясы үшін
реакциясы үшін
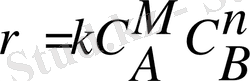
мұндағы k - пропорционалдық коэффициент немесе реакция жылдамдығының константасы.
С А және С В - А, В затқа сәйкес келетін концентрация.
m және n - экспериментальдық шама, реакция жылдамдығы концентрациядан тұратынын көрсетеді.
Егер реакция бір стадияда жүрсе, онда бұл көрсеткіштердің дәрежесі стехиометриялық коэффициентке тең: m=a, n=1. Бұл орынға ие болады, мысалы, төмендегі жай реакцияларда:
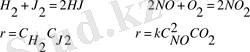
Көбіне m ≠ a және n ≠ b болады, себебі көптеген реакциялар бірнеше стадияларда жүреді. Мұнда жылдамдықтың жиынтығы ең жай жүретін реакцияның жылдамдығымен анықталады.
Температураны 10 0 -қа көтерсе химиялық реакцияның жылдамдығы 2-4 есе өседі (Вант-Тофф ережесі) . Осы уақытта соғылысу саны мұнда бірнеше өседі.
Реагенттердің кез келмеген соғылысулар саны химиялық әрекеттесуде алып келеді. Олардың жай жақындауының өзі энергетикалық барьерде болуы мүмкін. Бұл барьер, мысалы, электрондық бұлттарда тебуімен немесе судағы ерітіндіде гидратталған бұлттардың бүлінуімен анықталады. Сондықтан реакцияда барьерді жеу үшін, энергияны игеретін, тек ғана аталған «активті» молекулалар қатысады. Температурада өскен сайын активті молекулалардың саны да өседі.
Активті молекулаларға ие болатын кіші энергия активтердіру энергиясы деп аталады. Энергиясы аз молекулалар соқтығысқанда реакцияға қатыспайды. Реакция үшін, бөлме температурасына жақын жүретін (активтердіру энергиясы мұндай реакцияда 50-150 кДж/моль) Вант-Тофф ережесі. Бұл ереже былай жазылуы да мүмкін:
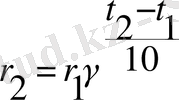
мұндағы
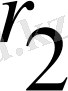 мен
мен
 -
-
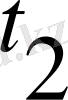 мен
мен
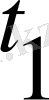 , температурадағы реакция жылдамдығы.
, температурадағы реакция жылдамдығы.
γ - реакцияның термиялық коэффициенті (2-4 мәнге ие) .
1. Реакция жылдамдығы константасының физикалық ұғымы қандай?
2. Реакция жылдамдығы константасының өлшемі қандай?
3.
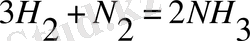 реакциясы үшін
реакциясы үшін
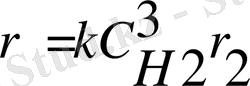 жылдамдық деп айтуға бола ма?
жылдамдық деп айтуға бола ма?
4. Реакция жылдамдығының константасы температураға, концентрацияға, катализаторға байланысты ма?
5. не үшін қатты заттар мен сұйықтар арасындағы реакцияның араласуын тездетеді?
§3. Катализ және катализаторлар
Реакциялық қоспаға кейбір заттарды қосқанда реакция жылдамдығы өседі, заттың қосылған мөлшері тұрақты болып қалады. Мұндай заттар катализаторлар деп аталады.
Мысалы,
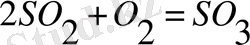 реакциясы жылдамдатады, егер газ қоспасына азот (11) оксидін қоссақ, онда реакция жүреді.
реакциясы жылдамдатады, егер газ қоспасына азот (11) оксидін қоссақ, онда реакция жүреді.
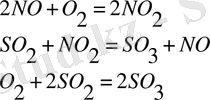
NО-ның жұмсалмайтыны көрініп тұр. Бірақ, мұның есебінен, реакция басқа жолмен жүреді (NО 2 қоспасының түзілуімен активтендіру энергиясы аз болса реакция жылдамдығы артады. Мұндай жағдайда, NО - катализатор.
Бұл мысал гомогендік катализ, ерітіндіде немесе газ қоспаларында жақындайды. Тағы бір мысал -+ Кучеров реакциясы, сынап тұздарында католизденеді,
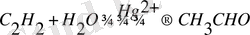
Гетерогендік католиз ретінде, қатты заттарда катализаторлар жүреді, реагенттер молекулалары бетінде адсорбцияланады. Кейде олардың реакциондық қабілеті көтерілуі мүмкін, адсорбцияланып олар өзгереді. Онда бұл қатты заттар катализаторлар жүреді. Аммиактың синтезі катализаторлар ретінде темір қолданылады. Бетінде азот молекуласы адсорбцияланады, мұнда азот атомдары арасында байланыс әлсірейді.
Гетерогендік катализге тағы бір мысал,
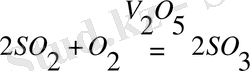
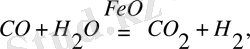
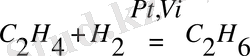
Сонымен, катализаторлардың қызметі қосылыстар арасында түзілетін есебінен яғни, реакция жолының өзгеруінен активтендіру энергиясы төмендеп, жылдамдығы өседі.
Реакциялық қоспаға түсетін кейбюір заттар, реакцияда бәсеңденуі мүмкін. Мұндай заттар ингибиторлар деп аталады.
Сөйтіп, тұз қышқылына қосылған, металдармен әрекеттесіп, қосылатын уротропин (гексаметиллитетрамин (СН
2
)
6
N
4
судағы ерітіндіде
 хромат-иондар темірдің коррозиясында тоқтайды.
хромат-иондар темірдің коррозиясында тоқтайды.
Ингибатордың әсері көбіне оның қатты деп бетіндегі адсорбциясымен және реагенттен осы беттің изоляциясынан аяқталады.
- Реакция жолы деген не?
- Судың катализатор болатын реакцияға мысал келтіріңіз.
- Сутегі асқын тотығының айыру үшін оның судағы ерітіндісіне марганец диоксиді қосылған. MnO2гамогендік немесе герерогендік катализаторлар деп аталады?
§4. Химиялық реакцияның қайтымдылығы
Егер реакция өнім реакциядағы кеңістікке түспесе (реакция жабық ыдыста өтеді) өзара әрекеттесу үшін жағдай туады, яғни қайтымды реакция жүреді. Сөйтіп, өкінішке орай, қайтымды процестер өндірісте аммиакты синтездеу
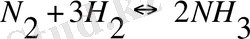 , күкірт газының тотығуы
, күкірт газының тотығуы
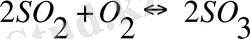 және басқалар болады.
және басқалар болады.
Әлсіз электролиттердің диссоциациясы
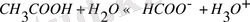
тұздардың иондарының гидролизі.
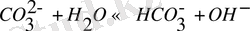 қайтымды.
қайтымды.
Мысал ретінде төмендегі реакцияны кейде қайтымды деп атайды.
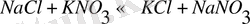
Енді иондық түрде жазайық.
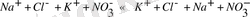
Оң жыл сол жағында иондарды жазу тәртібінен ажыратылады. Бірақ мұнда ешқандай реакция жоқ (реакция белгісі болатын - жаңа заттың түзілуі жоқ) .
Реакция жағдайға байланысты қайтымды және қайтымсыз болуы мүмкін. Мысалы, сутегі жанғанда қайтымсыз реакция жүреді
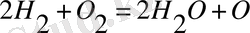 .
.
Дегенмен, өте жоғары температурада (1500-2500 0 С) судың айырылуы байқалады, яғни қайтымды реакция жүреді.
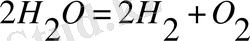 .
.
Сөйтіп, жағдайға сәйкес осы реакция қайтымды болады.
Көзқарастарға бпайланысты реакциялар қайтымды және қайтымсыз болып саналады. Мысалы,
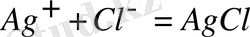
реакциясын қайтымсыз деп қарауға болады, егер біз ерітіндіден күміс ионын тұнбаға түсірсек.
Алайда AgCl белгісіздеу үлгіштікті (~ 10 -5 моль/л) игереді.
Солай етіп, ерітінді мен тұлба арасындағы тепе-теңдік орнына ие болады.
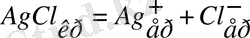
Осы көзқараспен қарағанда реакция қайтымды.
Осы позициямен ерітіндідегі электролиттердің қайтымсыз реакциясының екі шартын келтіруге болады:
1) өнімнің біреуі реакция сферасынан (газ, тұнба, аздиссорцияланатын заттар) түрінде шығады.
2) алғашқы затқа қарағанда, өнімнің көп мөлшерін түзуге алып келетін реакцияның экзотермиялығы.
Қайтымсыз реакциялар жүрген кезде, нәтижеде экзотермиялық күрделі заттар жай заттарға айналады. Мысалы,
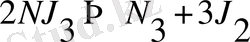
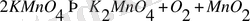
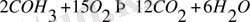
Мұндай реакцияларды өніммен ешқандай тәсілдермен реагенттерді алу мүмкін болмайды?
- Не үшін өкінішке орай аммиакты синтездеу қайтымды реакция?
- С+О2=СО2реакциясы қайтымды немесе қайтымсыз ба?
Химиялық тепе-теңдік және оның ығысу жағдайы.
Егер қандайда бір система қайтымды реакцияда жүру жағдайына ие болса, онда бірнеше уақыттан соң мұндай система химиялық тепе-теңдік болып орнығады, сондықтан түзу және қайтымды реакцияның жылдамдығы теңдей болып қалады.
Бірстадиялы реакция үшін тепе-теңдікте А+В ↔︎Х реакцияның түзу жылдамдығын жазамыз
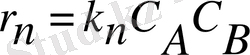 және қайтымды реакция жылдамдығы
және қайтымды реакция жылдамдығы
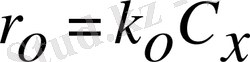 . Реакция жүру кезінде С
А
және С
В
реагенттерінің концентрациясы азаяды, демек, түзу реакцияның жылдамдығы түседі. Бір уақытта С
х
өсуімен қайтымды реакция жылдамдығы өседі.
. Реакция жүру кезінде С
А
және С
В
реагенттерінің концентрациясы азаяды, демек, түзу реакцияның жылдамдығы түседі. Бір уақытта С
х
өсуімен қайтымды реакция жылдамдығы өседі.
Бұл кезде
 химиялық тепе-теңдік шығады. Демек
химиялық тепе-теңдік шығады. Демек
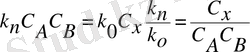
Түзу және қайтымды реакциялар жылдамдығының константысы қатынасын К әрпімен және заттың тепе-теңдік молярлық концентрациясын квадрат жақшамен белгілеп, өрнекті жазамыз
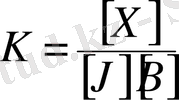
Реакцияның тепе-теңдік константын К - деп атаймыз. Бұл өрнек масса әсер ету заңы деп аталып, тепе-тіеңдікте реакция өнімін концентрациясының көбейтіндісінің реагенттер концентрациясы көбейтіндісіне қатынасы тұрақты шама болып, алғашқы концентрациядан тәуелсізідігін білдіреді.
Көп стадия реакция мысалы ретінде төмендігіні қарасытрамыз:
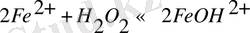
Ол екі стадия жүреді (мұнда екіншіге қарағанда, біріншісі 1000 есе болу) .
Екі стадиядағы тепе-теңдік константын жазамыз:
1)
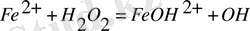
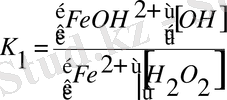
2)
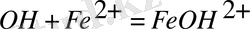
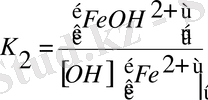
Стадия бойынша константа көбейтіндісіне К әрпімен белгілеп, мынаны аламыз:
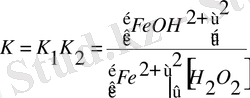
Көп стадиялы реакция үшін өрнекте тепе-теңдік константы концентрация дәрежесіне кіріп, реакция теңдеуде коэффициенттері бірдей болады.
Егер
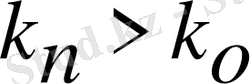 онда
онда
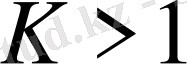 реакцияның тепе-теңдігі оңға қарай ығысады, және керісінше. Мысалы, диссоциация кезінде сірке қышқылы
реакцияның тепе-теңдігі оңға қарай ығысады, және керісінше. Мысалы, диссоциация кезінде сірке қышқылы
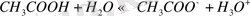
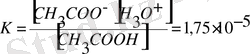
тепе-теңдік солға қарай ығысады.
Аммиакты синтездеу реакциясы үшін
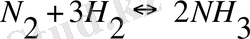
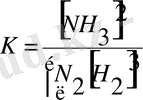
25 0 С-та К =4, 6 ·10 5 , яғни тепе-теңдік оңға ығысады, ал 427 0 С - та К =8, 2 ·10 -5 , тепе-теңдік солға ығысады.
Өрнекте тепе-теңдік константы үшін концентрациясы аз өзгеретін немесе реакция нәтижесінде ешқандай өзгермейтін заттар кірмейді.
Мұндай заттардың бірі - еріткіштер (қышқылда диссоциацияланатын константасы - су) . Басқа мұндай заттар жеке күйінде болатын заттар болуы мүмкін, сол себепті ол реакция өзгермейді, тек қана жұмсалады.
Сондықтан, С+СО 2 ↔︎2СО реакциясы үшін
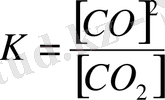 ,
,
 көріністен қалады. Тепе-теңдік күйі көптеген факторлардан тұрады.
көріністен қалады. Тепе-теңдік күйі көптеген факторлардан тұрады.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz