Жезқазғанда колчеданнан жылына 2000 т күкірт қышқылын өндіру технологиясын жобалау және технико-экономикалық негіздеме


РЕФЕРАТ
Диплом жұмысы 65 беттен, 15 суреттен, 18 кесте, және 35 пайдаланылған әдебиеттен тұрады.
Түйінді сөздер: күкірт, күкірт қышқылы, колчедан
Жұмыстың мақсаты: өнімділігі жылына 2000 тонна күкірт қышқылын өндіру технологиясын жобалау.
Жұмыстың міндеттері:
- Жезқазған мыс қорыту зауытының технологиясының үлгісімен танысу;
- Жылына 2000 т күкірт қышқылын өндіру технологиясынның жобасын жасау;
- Техника-экономикалық есептеулер жүргізу;
Зерттеу әдістері: Техника-экономикалық есептеулер.
Жұмыс нәтижесінде Жезқазған мыс қорыту зауытының технологиялық үлгісімен танысып, жылына 2000 т күкірт қышқылын алу технологиясының жобасы жасалынды. Техника - экономикалық есептеулер жүргізілді.
Практикалық маңызы: Күкірт қышқылы химия өндірісінің көптеген салаларында қолданылады.
РEФEРAТ
Дипломная работа состоит из 65 страниц, 15 рисунков, 18 таблиц, и 35 источников использованной литературы.
Ключевые слова: сера, серная кислота , колчедан.
Цель работы:
Проектировать технологию серная кислота производительность которая в год 2000 тонн.
Задачи работы:
- Ознакомится технологической схемой Жезказганском медеплавильном заводе ;
- Проектирование технологии получения производства 2000 тонн серной кислоты в год ;
- Сделать технико-экономические расчеты
Методы исследования:
- В результате работыознакомив технологии Жезказганском медеплавильном заводе, проектирована технология получения производства 2000 тонн серной кислоты в год. Расчитаны технико-экономические показатели.
Практическая значимость:
- Серная кислота используется во многих отраслях химической промышленности .
ABSTRACT
Thesis consists of 65 pages, 15 figures, 18 tables, 35 sources of literature.
Keywords: sulfur, sulfuric acid, pyrite.
Purpose:
Design technology sulfuric acid productivity is 2000 tons per year.
Objectives of the work:
• Learn about the technological scheme Zhezkazgan smelter;
• Design technology for the production of 2, 000 tonnes of sulfuric acid per year;
• Make a technical-economic calculations
Research methods:
As a result of familiarizing Zhezkazgan smelter technology, design technology for production of 2000 tons of sulfuric acid per year. Calculate the technical and economic indicators.
The practical significance: Sulfuric acid is used in many sectors of the chemical industry.
МАЗМҰНЫ
Кіріспе . . . 7
1ӘДЕБИ ШОЛУ . . . 8
- Күкірт қышқылының технологиялық қасиеттері мен қолданылуы . . . 9
1. 2 Күкірт қышқылын өндіру үшін шикізат . . . 13
1. 3 Күкіртті газды өндіру . . . 17
1. 4 Бір сатыда күкірт қышқылды контакт әдісімен өндіру . . . 19
1. 5 Қысқа сызба бойынша күкірт қышқылды алу. Күкірт қышқылын «ылғал» катализбен өндіру . . . 24
2 БАС ЖОСПАР ЖӘНЕ КӨЛІК . . . 28
2. 1 Негізгі цехтардың ғимараттары мен құрылыстары бойынша сәулетті-құрылыстық шешімдер . . . 28
2. 2 Өндірістегі жұмыскерлерді тұрмыстық және тазалық бойынша қызмет көрсету шешімдері . . . 29
2. 3 Жылыту жүйесін сипаттау . . . 29
2. 4 Канал жүргізу және сумен қамтамасыз ету жүйелерін сипаттау . . . 29
2. 5 Колчеданнан жанасу күкірт қышқыл өндірісінің технологиялық сұлбасының сипаттамасы . . . 29
3 ТЕХНОЛОГИЯЛЫҚ БӨЛІМ . . . 31
3. 1 ҚҚ пешінің материалдық балансы . . . 31
3. 2 Колчеданды күйдірудің жылулық балансы . . . 33
3. 3 Шаю бөлімінің материалдық балансы . . . 35
3. 4 Кептіру бөлімінің материалдық балансы . . . 36
3. 5 Жанасу бөлімінің материалдық балансы . . . 38
3. 6 Жанасу бөлімінің жылулық балансы . . . 39
3. 7 ҚҚ пешін есептеу . . . 42
4 ЕҢБЕК ҚОРҒАУ . . . 44
4. 1 Қауіпсіздік шаралары . . . 44
4. 2 Техника қауіпсіздігі . . . 45
4. 3 Электрқауіпсіздік . . . 45
4. 4 Өрт қауіпсіздігі . . . 46
4. 5 Шу және діріл . . . 46
4. 6 Жарықтандыру . . . 47
4. 7 Микроклимат . . . 48
4. 8 Санитарлы - гигиеналық шаралар . . . 48
5 ҚОРШАҒАН ОРТАНЫ ҚОРҒАУ . . . 49
5. 1 Атмосфераны қорғау . . . 49
5. 2 Атмосфераға зиянды заттардың тасталуын есептеу . . . 50
5. 3 Зиянды заттардың максимал концентрация мәніне жететін түтін құбырынан ара қашықтықты есептеу . . . 51
5. 4 Су алаптарын қорғау . . . 51
6 АВТОМАТТАНДЫРУ БӨЛІМІ . . . 52
6. 1 Өндірісті автоматтандырудың қысқаша сипаттамасы . . . 52
6. 1. 1 Шаңұстау бөлімі . . . 52
6. 1. 2 Күкіртқышқылды аймақ . . . 52
6. 2 Жанасу бөлімінің функциялық сұлбасын сипаттау . . . 53
7 ЭКОНОМИКАЛЫҚ БӨЛІМ . . . 57
7. 1 Жылдық өндірістік қуатты негіздеу . . . 57
7. 2 Еңбекті ұйымдастыру . . . 57
7. 3 Жұмыскерлердің сандық құрамын есептеу . . . 59
7. 4 Еңбекақының жылдық қорын есептеу . . . 60
7. 5 Өнімнің өзіндікқұн калькуляциясын есептеу . . . 61
8 ҚОРЫТЫНДЫ . . . 63
9 ПАЙДАЛАНЫЛҒАН ӘДЕБИЕТТЕР . . . 64
НОРМАТИВТІ СІЛТЕМЕЛЕР
Дипломдық жұмыста келесідей нормативті құжаттарға сілтемелер пайдаланылды:
ГОСТ 7. 32-2001. Ғылыми-зерттеу жұмысының есебі. Безендірудің құрылысы мен ережесі.
ГОСТ 2. 105-95. Конструкторлық құжаттамалардың біркелкі жүйесі. Құжаттар мәтініне қойылатын жалпы талаптар.
ГОСТ 7. 1-84. Ақпараттар, кітапхана және баспа ісі жөніндегі стандарттар жүйесі. Құжаттың библиографиялық сипаттамасы. Жалпы талаптары мен құрастыру ережелері.
ГОСТ 7. 54-88. Ғылыми-техникалық құжаттардағы материалдар мен заттардың қасиеттері жөніндегі сандық мәліметтерді беру. Жалпы талаптар.
ГОСТ 8. 417-81. Өлшем бірліктерімен қамтамасыз етудің мемлекеттік жүйесі. Физикалық шамалар бірліктері.
КІРІСПЕ
Бұл дипломдық жобада күкіртті колчеданнан Жезқазған қаласы шарттарында өнімділігі жылына 2000 т болатын күкірт қышқыл өндірісінің цехын жобалау орындалды. Бұл өндірістің бірінші сатысы күкіртті колчеданды күйдірген кезде күкірт қостотығын алу болып табылады. Күкірт қостотығын тазартқаннан кейін (әсіресе жанасу әдісінде) оны үштотыққа дейін тотықтырады, ол күкірт қышқылын алу үшін сумен байланыстырылады. Қалыпты жағдайларда SO 2 - ден SO 3 - ке дейін тотығу баяу жүреді. Үрдісті жылдамдату үшін катализатор қолданылады.
Жұмыстың мақсаты: өнімділігі жылына 2000 тонна күкірт қышқылын өндіру технологиясын жобалау.
Жұмыстың міндеттері:
- Жезқазған мыс қорыту зауытының технологиясының үлгісімен танысу;
- Жылына 2000 т күкірт қышқылын өндіру технологиясынның жобасын жасау;
- Техника-экономикалық есептеулер жүргізу;
Зерттеу әдістері: Техника-экономикалық есептеулер.
Жұмыс нәтижесінде:
Жезқазған мыс қорыту зауытының технологиялық үлгісімен танысып, жылына 2000 т күкірт қышқылын алу технологиясының жобасы жасалынды;
Техника - экономикалық есептеулер жүргізілді.
Практикалық маңызы: Күкірт қышқылы химия өндірісінің көптеген салаларында қолданылады.
Жұмыста алға қoйылған мақсатқа жeту үшін күкіртті ангидридтің оттегімен әрекеттесу жылдамдығы қалыпты жағдайда өте аз боолғандықтан өнеркәсіпте бұл реакцияны катализатор қатысында жүргізеді (күкірт қышқыл өндірісінің жанасу әдісі) немесе оттегін тасымалдағыштарды қолданады (күкірт қышқыл өндірісінің нитроздық әдісі) . Қазіргі уақытта жанасу әдісімен концентрлі күкірт қышқылын, олеум және 100% күкірт ангидридін алады. Өнеркәсіп күкірт қышқылының бірнеше сорттарын шығарады, олар бір-бірінен құрамында H 2 SO 4 немесе SO 3 (бос) -тің болуымен, сонымен қатар қоспалардың мөлшерімен және құрамымен ерекшеленеді. Жанасу әдісі бойынша түрлі концентрациядағы күкірт қышқылы алынуы мүмкін, себебі жанасу үрдісінде күкірт ангидриді түзіледі, оған кез келген қажетті мөлшерде суды қосуға болады.
Қоспалардың құрамы мен мөлшері де күкірт қышқылын алу әдісіне байланысты. Күкірт қышқылын жанасу әдісімен өндіру кезінде күйдіру газын шаңнан тазартқаннан кейін оны арнайы тазартуға ұшыратады. Күкірт қышқылы техникалық, аккумуляторлық және реактивті деп ажыратылады. Реактивті қышқыл бірнеше сорттарда шығарылады: химиялық таза, анализ үшін таза және таза.
1ӘДЕБИ ШОЛУ
Сусыз күкірт қышқылы (моногидрат) H 2 SO 4 - ауыр майлы сұйық, ол сумен араласу арқылы көп мөлшерде жылу бөледі. Тығыздығы - 1, 8305 г/см 3 (20 0 С - та), +10, 45 0 С-та кристалданады, 296, 2 0 С-та қайнайды.
Күкірт қышқылын бір молекула күкірт ангидридінің SO 3 бір молекула сумен H 2 O қосылысы деп қарастыру қажет, сусыз күкірт қышқылы 81, 63% SO 3 және 18, 37% H 2 O тұрады. Моногидраттағы SO 3 -ң ерітінділері олеум деп аталады. Техникалық күкірт қышқылы қоспалармен сұр түске боялған.
H 2 SO 4 булары температураны көтерген кезде диссоциацияланады:
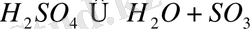
Күкірт қышқылы - ең активті бейорганикалық қышқылдардың бірі. Ол барлық металдармен және олардың тотықтарымен әрекеттеседі, алмасу ыдырау реакцияларына қатысады, сумен қарқынды араласады, тотықтырғыштық және басқа да маңызды химиялық қасиеттерге ие.
Күкірт қышқылы химиялық өнеркәсіптің негізгі өнімедрінің бірі болып табылады. Минералдық тыңайтқыштар, түрлі минералдық тұздар мен қышқылдар, бірқатар органикалық өнімдер, бояғыштар, жарылғыш заттар және т. б. өндірістерінде кең қолданылады. Ол мұнай, металлургиялық, металөңдеу, тоқыма және басқа да өнеркәсіптік салаларда қолданыс тапқан, сусіңіргіш және кептіргіш құрал ретінде, бейтарап үрдістер мен басқа да мақсаттар үшін пайдаланылады [1] .
Күкірт қышқылы өндірісінің бастапқы шикізаты ретінде күкіртті ангидрид болып табылады, ол күкіртті немесе басқа да күкрітқұрамды шикізат түрлерін күйдірумен алынады.
Күкіртті ангидридті күкірт қышқылына қайтаөңдеу, оны тотықтыру және суды қосудан тұрады:
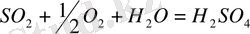
Күкіртті ангидридтің оттегімен әрекеттесу жылдамдығы қалыпты жағдайда өте аз. Сондықтан өнеркәсіпте бұл реакцияны катализаторда жүргізеді (күкірт қышқыл өндірісінің жанасу әдісі) немесе оттегіні тасымалдағыштарды қолданады (күкірт қышқыл өндірісінің нитроздық әдісі) .
Қазіргі уақытта жанасу әдісімен концентрлі күкірт қышқылын, олеум және 100% күкірт ангидридін алады.
Өнеркәсіп күкірт қышқылының бірнеше сорттарын шығарады, олар бір-бірінен құрамында H 2 SO 4 немесе SO 3 (бос) - ң болуымен, сонымен қатар қоспалардың мөлшерімен және құрамымен ерекшеленеді. Нитроздық әдіспен салыстырмалы азконцентрлі мұнаралы қышқыл алынады, құрамында шамамен 75% H 2 SO 4 болады. Жанасу әдісі бойынша түрлі концентрациядағы күкірт қышқылы алынуы мүмкін, себебі жанасу үрдісінде күкірт ангидриді түзіледі, оған кез келген қажетті мөлшерде суды қосуға болады.
Қоспалардың құрамы мен мөлшері де күкірт қышқылын алу әдісіне байланысты. Мысалы, мұнаралы күкірт қышқылын алу кезінде, оған күйдіру газында қалатын шаң бөлшектері түседі, оны құрғақ электрфильтрлерде тазартса да. Сондай-ақ, мұнаралық қышқылдың құрамында еріген азот тотықтары болады. Күкірт қышқылы сонымен қатар H 2 SO 4 - те еритін, аппараттың коррозиясы өнімдерімен ластануы мүмкін.
Күкірт қышқылын жанасу әдісімен өндіру кезінде күйдіру газын шаңнан тазартқаннан кейін оны мұқият арнайы тазартуға ұшыратады. Сондықтан жанасу күкірт қышқылының құрамында коррозияның ерігіш өнімдері болады. Коррозияға материалдардан дайындалған аппаратты қолдану, жоғарғы тазалықты жанасу күкірт қышқылын алуға болады.
Күкірт қышқылы техникалық, аккумуляторлық және реактивті деп ажыратылады. Күкірт қышқылының түрлері болып мұнаралы қышқыл, купорос майы және олеум табылады. Аккумуляторлық қышқыл жанасу әдісімен алынады (92-94% H 2 SO 4 ) . Реактивті қышқыл бірнеше сорттарда шығарылады: химиялық таза, анализ үшін таза және таза [2] .
1. 1 Күкірт қышқылының технологиялық қасиеттері мен қолданылуы
Күкірт қышқылы - химиялық өнеркәсіпте ең үлкен және көп көлемде өндірілетін өнімдерінің бірі. Күкірт қышқылы түтіндемейді, түссіз, иіссіз, қалыпты жағдайда сұйықтызат.
Техникада күкірт қышқылы деп күкірт оксидтен (VI) және судан тұратын әртүрлі құрамды: n SO 3 . m H 2 O жүйелер аталады. n = m = 1 жағдайда күкірт қышқылының моногидраты, яғни 100% күкірт қышқылы болады, m > n - моногидраттың су ерітінділері, ал m < n жағдайда - моногидраттағы күкірт оксидінің (VI) ерітінділер (олеум дейтін) түзіледі:
Н 2 SO 4 . ( n - 1) SO 3 ←Н 2 SO 4 →Н 2 SO 4 . ( m - 1) H 2 O.
олеум моногидрат моногидрат ерітінді
Күкірт қышқылының моногидраты - түссіз май тәрізді сұйықтық. Оның кристалдану температурасы 10, 4 ºС, ал қайнау температурасы 296, 2 ºС және тығыздығы 1, 85 т/м 3 . Моногидрат сумен және күкірт оксидімен (VI) әртүрлі қатынаста араласады, ол сумен - Н 2 SO 4 . H 2 O; Н 2 SO 4 . 2H 2 O; Н 2 SO 4 . 4H 2 O гидраттарды, ал SO 3 -пен - Н 2 SO 4 . SO 3 және Н 2 SO 4 . 2SO 3 қосылыстарды түзеді. Күкірт қышқылы суда ерігенде 1 моль 36 кДж жылу бөлініп шығарады.
Осы гидраттары мен SO 3 -пен қосылыстар әртүрлі кристалдану температураларға ие болып, эвтектика қатарын түзеді. Олардың кристалдану температурасы кейбіреулері нольден төмен немесе нольге жуық. Бұл эвтектикалар 1 суретте көрсетілген.
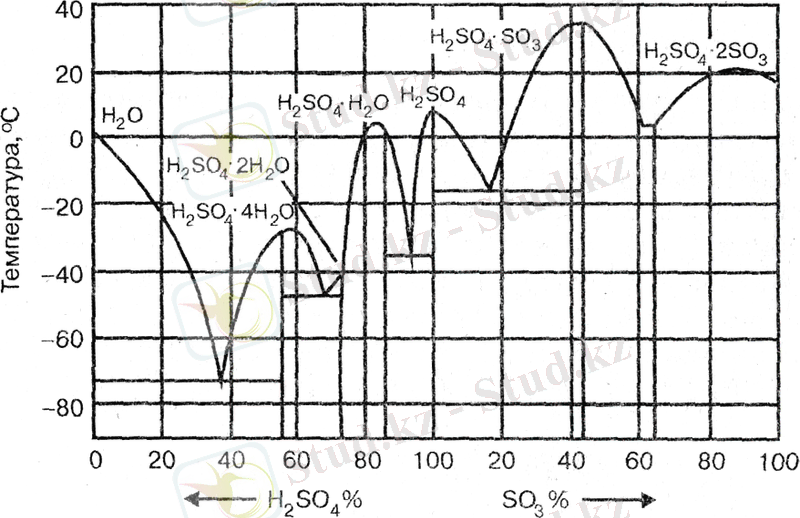
1 сурет - «SO 3 - Н 2 O» жүйесінің кристалдану диаграммасы
Күкірт қышқылының қайнау температурасы да оның концентрациясына, яғни «күкірт оксиді (VI) - су» жүйесінің құрамына тәуелді (2 сурет) . Күкірт қышқылы ерітінділердің концентрациясы өскен сайын оның қайнау температурасы да өседі және максимумды 336, 5 ºС-та жетеді, оған концентрациясы 98, 3% сәйкес. Бұл концентрацияда өзгермей қайнайтын (азеотропты) ерітінді түзеді. Құрамында бос SO 3 -тің мөлшері көбейен кезде олеумнің қайнау температурасы 296, 2 ºС-тан (моногидраттың Т қайнау) 44, 7 ºС-қа, яғни 100 %-дық SO 3 -тің қайнау температурасына дейін төмен түседі.
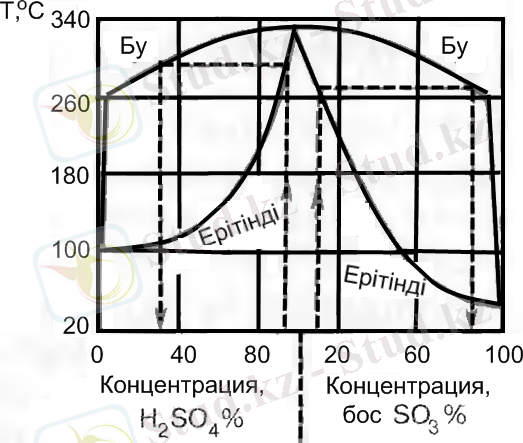
2 сурет - Күкірт қышқылының қайнау температурасы
Күкірт қышқылының булар 400 ºС-тан жоғары қыздырғанда келесі схема бойынша термиялық диссоциацияланады және құрамында көп мөлшерде Н 2 SO 4 -ның молекулаларға қарағанда SO 3 молекулары көбірек болады, ал 700 ºС-тан жоғары SO 2 -нің молекулары артық болады:
400º 700º
2Н 2 SO 4 ↔︎2Н 2 O +2SO 3 ↔︎ 2H 2 O + 2SO 2 + О 2 .
Құрамында қоспалардың мөлшеріне және қышқыл ерітіндісінің концентрациясына байланысты химия өнеркәсібі күкірт қышқылының үш негізгі тауарлы түрін (сорт) шығарады (1 кесте) [3] .
1 кесте - Күкірт қышқылының түрлері
Контактілік қышқыл
(техникалық Н 2 SO 4 - купорос майы)
Олардан басқа аккумулятор күкірт қышқылы (92-94 % Н 2 SO 4 ) бар, оның құрамында Mn, Fe, As, Cl иондары, азот оксидтері және т. б. қоспалар болмауы керек, егер олар аз мөлшерде болса да аккумуляторды зарядтағанда тотығу-тотықсыздану процесі жүреді, бұл жағдайда электродтар тез бұзылады және электр тогы артық мөлшерде жұмсалады.
Зертханада реактивтік күкірт қышқылының «ХТ», «ТAТ» және «Т» маркалары қолданылады.
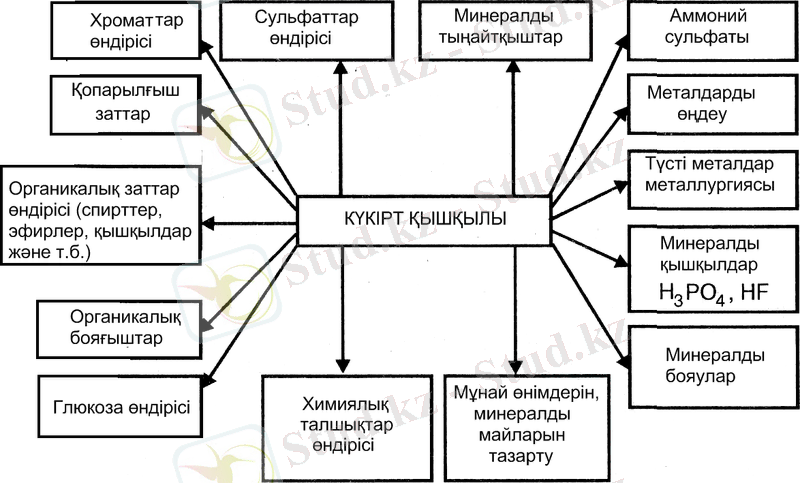
Қолданылуы. Күкірт қышқылының өндірісі - бейорганикалық заттардың химиялық өнеркәсіптің - қышқылдар, негіздер, тұздар, минералдық тыңайтқыштар және хлор өндіретін саласының - ең манызды бір тарауы. Минералды қышқылдардың арасында күкірт қышқылы бірінші орын алады. Соңғы 25 жыл әлемде күкірт қышқылының тұтынуы 3 есе өсті және қазіргі кезде жылына 160 млн. тонна құрайды.
Н 2 SO 4 -ның ең үлкен бөлігі минералды тыңайтқыштардың өндірісінде (30 %-дан 60%-ға дейін), сондай-ақ бояғыштар өндірісінде (2-ден 16%-ға дейін), химиялық талшықтар өндірісінде (5-тен 15 %-ға дейін) және металлургиясында (2-ден3 %-ға дейін) жұмсалынады.
Сонымен қатар, әртүрлі техникалық мақсаттар үшін ол тамақ, металл өңдеу, қопарылғыш заттар өндірісінде және Н 3 РО 4 , НСl, сірке және т. б. қышқылдар өндірісінде көп қолданылады. Коксохимия өндірісінде күкірт қышқылы мұнай өнімдерін, майларын тазарту үшін жиі пайдаланылады.
Қазақстанда күкірт қышқылын фосфор тыңайтқыштарын өндіретін және уран алатын зауыттар «Қазатомпром» мемлекеттік кәсіпорындары ең көп пайдаланады. Ал өнім ретінде шығарылатын зауыттар: Өскемен мен Балхаш химиялық зауыттары.
Н 2 SO 4 -ның қолдану аймақтары 3 суретте көрсетілген.
Н 2 SO 4 суда өте жақсы ерумен қатар, суды (ылғалды, дымқылды) күшті тартып сіңіреді, сондықтан оны құрғатқыш ретінде қолданады.
Күкірт қышқылы өндірісінің даму тарихы
XVIII ғасырдың ортасына дейін күкірт қышқылды табиғи темір сульфатын (купорос дейтін) тақтатасымен құрғақ айдау арқылы алынған, осы себептен өндірісте техникалық күкірт қышқылын купорос майы деп атайды.
1746 ж. күкірт қышқылын түбіне су құйылған қорғасын камерасында күкіртпен калий селитра (КNO 3 ) қоспасын өртеу арқылы өндіре бастады. Бұл жағдайда күкірт оксиді (VI) және азот оксидтері суда еріп нитроза түзілген. Сондықтан бұл әдісті «камералық» немесе нитроза әдісі деп аталған.
ХХ ғасырдың басында азот оксидтерін ұстау үшін қондырғыға арнай мұнара қосылған, бұл үрдістің қарқындылығын арттырды. Содан кейін қорғасын камералар қышқылға төзімді саптама бар мұнаралармен ауыстырған. Сөйтіп, «камералы» әдіс күкірт қышқылының «мұнара» әдісіне ауысты. 1837 ж. шикізат ретінде алғаш рет күкірт орнынан темір колчедан пайдаланды.
1831 ж. ағылшын ғалымы П. Филипс платина катализатор қатысында күкірт қышқылының контактілік (жанасу) әдісін ұсынды.
ХХ ғасырдың 20-шы жылдарынан бастап қымбат платина орнына арзан ванадий оксидін (V) негізінде контакт массасын қолданатын болды. Бұл катализатордың жану температурасын біраз төмендетеді.
3 сурет - Күкірт қышқылының қолданылуы
1930 ж. өндіріс тәжірибеде тұнғыш рет темір колчедан күйдіру сатысында «ҚҚ» (қайнаушы қабатта күйдіретін) пештер ендірген, бұның арқасында өндірістің қарқындылығы өсті және күкірттің жоғалуы азайды.
1931 ж. И. А. Ададуровпен және басқа газдағы су буының мөлшері жоғары болғанда қатты катализатордің үстінде күкірт оксидінің тотығу әдісі ұсынылды. Кейінірек, бұл - күкіртті сутектен күкірт қышқылын алу әдісі - «ылғалды катализ» деп аталған.
Содан кейін өндіріске Г. К. Боресковпен және В. С. Бесковпен ұсынылған қос жанасу әдісі («ҚЖ-ҚА») ендірілген. Ол SO 2 -нің жанасу дәрежесін артады және у газдардың шығын азайтады.
Қазірге кезде Н 2 SO 4 негізгі екі әдіспен: контакт (жанасу) және нитроз (мұнара) әдістерімен өндіріледі. Моногидрат бойынша аппараттардың өнімділігі күнделікке 2000 т жетеді.
1. 2 Күкірт қышқылын өндіруге қажетті шикізат
Қазақстанда күкірт қышқылы Степногорскіде (жылына 180 мың тонна), Балқашта (жылына 1 мың тонна) өндіріледі. Күкірт қышқылын өндіру үшін шикізаттар күкірт немесе күкірт (IV) оксиді алынуы мүмкін күкіртті қосылыстар.
Көп мөлшерде өндірілетін күкірт қышқылына керекті күкірт диоксидін алудың бір қоры - түсті металлургияның пештерінен соңғы кезге дейін далаға жіберіліп келген газдар. Қазіргі кезде бұл газдар, әсіресе түсті металдардың қазынасы, Қазақстанда (Шығыс Қазақстан, Балқаш) күкірт қышқылын алуға жұмсалады. Мысалы 1 тонна мыс өндіргенде 7, 5 тонна күкірт диоксиді шығады, одан 10 тонна артық күкірт қышқылын алуға болады. Өндірісте 80% жуық күкірт қышқылын табиғи күкірт пен темір колчеданынан алады.
Сонымен, күкірт қышқылының күкірті бар шикізатынан өндіруі бірнеше химиялық үрдістерден тұрады, оларда шикізаттың және жартылай өнімдердің тотығу дәрежесі өзгереді:
S 0
FeS 2 -2 I II
H 2 S -2 [S +4 ] [S +6 ],
S +4 O 2
мұндағы I - күкіртті газдың (күкірт оксиді (IV) ) алу сатысы;
II - күкіртті оксидін каталитикалық тотығу арқылы күкірт ангидридіне айналдыру және оның абсорбциялау.
Практика жүзінде орындалатын өндірісте осы химиялық үрдістерге шикізаттың дайындау, күкіртті газдың тазарту және басқада механикалық және физика-химиялық үрдістер қосылады. Онда күкірт қышқылының жалпы өндіріс сұлбасын мына түрінде көрсетуге болады:
Шикізат → шикізатты дайындау → шикізаттың жануы (күйдіру) → күкіртті газдың («күйдіргіш» газ) тазартуы → жанасауы → күкіртті ангидридін абсорбциялау → H 2 SO 4 .
Өндірістің технологиялық сызба-нұсқасы қолданылатын шикізат түріне байланысты, күкірт оксидінің (IV) каталитикалық тотықтырудың ерекшеліктеріне, күкірт оксидінің (VI) абсорбция сатысының бар немесе жоқ болуына.
Күкірт қышқылын өндірісінде шикізат ретінде күкірт өзін және құрамында күкірті бар әртүрлі қосылыстарды да пайдалануға болады.
Өндіріс масштабында Н 2 SO 4 жалпы көлемінен 45 % колчеданнан, 25 % - күкірттен, 25 % - әртүрлі өндірістен шығатын күкіртті газдан және 5 % - әртүрлі шикізаттан алынады.
Күкірт табиғатта негізінен үш түрде кездеседі:
1) бос түріндегі күкірт - элементарлы күкірт S;
2) сульфидтік кендерінде - металл сульфидтері;
3) металл сульфаттар: гипс СаSO 4 . 2Н 2 О, ангидрид СаSO 4 , мирабилит Na 2 SO 4 . 10Н 2 O және т. б.
Элементарлы күкірттің кендері өте аз мөлшерде кездеседі (күкірттің кларкы 0, 1 %-ды құрайды) . Бірақ элементарлы күкірт SO 2 -ні өндіруге өте құнды шикізат.
Күкіртті газдың (SO 2 ) басқа да көздері бар. Күкірт мұнай, тас көмір, табиғи және өтпелі газдардың құрамында болады. Оларды өңдегенде ол күкіртті газ түрінде шығады. Көп мөлшерде SO 2 оттық және түсті металлургияның газдарында болады. Одан басқа күкірт жанғыш газдарды тазалау кезінде бөлініп шығатын күкіртсутек түрінде болады.
Сол сәттен, күкірт қышқылын өндіру үшін қолданылатын шикізат өте алуан, бірақ осы уақытқа дейін шикізат ретінде темір колчедан мен элементарлы күкірт жиі қолданылады. Колчедан құрамындағы күкірт мөлшері 35-50% құрайды. Оның негізгі кенорындары Кавказ, Орал және Орта Азия републикаларында орналасқан.
Н 2 SO 4 өндірудің жалпы сызба-нұсқасы негізгі мынадай сатылардан турады:
1) күкіртті ангидридін SO 2 алу,
2) күкірт оксидін (IV) SO 3 -ке тотықтыру,
3) күкірт ангидридін Н 2 SO 4 -ке айналдыру.
Өнеркәсіпте өндіретін газ (SO 2 күкіртті ангидрид) өте күрделі қоспа, оның құрамында SO 2 -нен басқа: азот, оттек және т. б. қоспалар болады.
Осы өнеркәсіптік жалпы схемада Н 2 SO 4 өндіру үшін алғашқы екі саты өте маңызды болып келеді. Олар: шикізатты дайындау және оны құйдіру. Осы айтылғандардың әрқайсысын техникалық орындауы ерекше болады, өйткені шикізат табиғатына байланысты болады.
Шикізат дайындау сатысын кеселі мысалдарда карастырайық.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz