Натрий (Na): физика-химиялық қасиеттері, алынуы және қолданылуы


Н а т р и й
Таңбасы Na. Аr = 22, 989; М(Na) = 22, 989 г/моль.
Электрондық қүрылымы: 11 Na 1s 2 2s 2 p 6 3s 1
Ашылуы
1807 жылдың 19 қарашасында Хэмфри Дэви жаңа натрий және калий элементтерін ашқандығын жария етті. Араға бір жыл салып Гей-Люссак және Луи Тенар күйдіргіш натрмен темірді әрекеттестіріп натрийді алды.
Г. Деви сол кездер үшін мүмкін емес заттар туралы хабарлайды. Ол ұшпайтын сілтілердің (яғни сондірілген ісбеспен натрий және калийдің көмірқышқылды тұздарының әрекеттесу өнімдерінің) ыдырауын тәжірбиелік жолмен жүргізеді, ал бұл өз кезегінде осы ұшпайтын сілтілердің негізінде жататын, жаңа және кереметтей дененің бөлінуіне әкелген. Бұрын көпке дейін сілтілерді жай зат деп есептеген, ал енді олардың күрделі екендігі айқындалады. Бұл қосылыстар электр тогының әсерінен ыдырап, әртүрлі, бірақ химиялық қасиеті бойынша ұқсас элементтер бөлінеді. Деви олардың біреуін поташқа сәйкес «потассий», ал екіншісін содыға ұқсас етіп «содий» деп атайды. Швед химигі Я. Берцелиус 1811 жылы «содий» атауын арабтың «натрон» - соды сөзінен алып, натрий атауына өзгертеді.
Алынуы
1. Натрий-балқыған натрий гидроксидін электролиздеу арқылы алынады:
NaOH ↔︎ Na + + OH -
Катод (болат) : Nа + + е - → Nа
Анод (графит) : 40Н - е - → 2Н 2 0
2. Натрий алудың техникалық - балқытылған натрий гидрототығын электролиздеуде. Мұнда темір электродтарын пайдаланады және процесті 325 0 С кезінде жүргізеді. Кейде тотықсыздандырушы ретінде көмірді де қолданады. Қызара қыздырылған кездегі көмір натрий гидрототығын тотықсыздандырады:
4NaOH + 2C = 2Na + Na 2 SO 4 + 2H 2 + CO 2
3. Балқыған хлорлы натрий және хлорлы кальций қоспасының элсктролизі. Хлорлы кальций балқу температурасын төмендету (600°С дейін) үшін қосылады.
2NaCl → 2Na + Cl 2
Катод (болат) : Nа + +е - → Nа (сұйық балқыма)
Анод (графит) : 2Сl - - е - → С1 2 ↑.
Физикалық қасиеті.
Нат р и й -күміс түсті ақ металл. Ол жұмсақ: пышақпен оңай кесіледі және пластилин не замазка тәрізді саусақпен уқаланады. (оған құрғақ немесе керосинге малынған саусақпен ғана қол тигізуге болады) . Натрий жеңіл металдар қатарына жатады. Натрий металдық жылтыры бар, ауада тез тотығатын элемент. Сілтілік металдар тобына жатады. Ол судан сәл жеңіл, бірақ керосиннен ауыр. Егер оның бір түйірін керосинмен бірге пробиркада қыздырса, натрий тез балқиды және пішіні сынап тамшысына ұқсас тамшыға айналады: натрий оңай балқиды және электр тогын өте жақсы өткізеді. Натрийді керосин бойында сақтайды. Физикалық қасиеттері жөнінен натрий нағыз металл. Натрий тек қана бір изотоптан 23 Na тұрады.
Химиялық қасиеті.
Табиғаттағы қосылыстары
NaСІ - тастұз (каменная соль)
Na 2 SO 4 - тенардит
Na 2 S 0 4 ∙ 10Н 2 О - мирабилит немесе Глаубер тұзы
NaNO 3 - Чили селитрасы
Na 3 [AlF 6 ] - криолит.
1. Фтор, хлор атмосферасында натрий өздігінен тұтанып түз түзеді:
2Na + F 2 = 2NaF
2Na + Cl 2 = 2NaCl
2Na + Br 2 = 2NaBr
2Na + I
2
 2NaJ
2NaJ
2. Натрий, оттекпен оңай тотығады және пероксид түзеді:
2Nа + 0 2 = Nа 2 0 2 натрий пероксиді.
Температураны көтеру және қысымды арттыру асқын пероксид түзілуіне әкеліп соқтырады:
Nа + 0 2 = Nа0 2 .
Сілтілік металдардың топша бойымен жоғарыдан төмен қарай пероксид және асқын пероксидтерінің тұрақтылығы арта түседі.
Натрий оксиді төмендегі өзгеріс бойыншатүзіледі:
Nа 2 0 2 + 2Nа= 2Nа 2 0
Аталған қосылыс натрий азиді мен натрий селитрасының вакуум жағдайында әрекеттесуінен де түзіледі:
5NaN 3 + NaNo 3 = 3Na 2 O + 8N 2 ↑
Пероксидтер және асқын пероксидтер иондық тор құрылымынан тұратын тотықтырғыштық қасиетке ие қатты заттар, сумен әрекеттесіп сутек асқын тотығын түзеді:
Na 2 O 2 + 2H 2 O = 2NaOH + H 2 O 2
2NaO 2 + 2H 2 O = 2NaOH + H 2 O 2 + O 2
Пероксид құрамына диамагнитті ион [O] 2- , ал асқын пероксид құрамына парамагнитті ион [O] - кіреді. Na 2 O 2 немесе NaO 2 алюминий ұнтағымен, ағаш үгіндісімен немесе өзге жанғыш заттармен аз ғана су не күкірт қышқылының қоспасы қатысында күшті жарқылмен жарылыс береді.
2Na 2 O 2 + 2CO 2 → 2Na 2 CO 3 + O 2
Na 2 O 2 + CO→ Na 2 CO 3
реакцияларына оттегі регенерациялау негізделген.
3Na 2 O 2 + 2Al → 2 NaAlO 2 + 2Na 2 O
Қышқылмен әрекеттесіп сутегі пероксидін түзеді:
Na 2 O 2 +2HCl → 2NaCl + + H 2 O 2
Натрий оксиді сумен әрекеттесіп сілті түзеді. Ал, қатты күйдегі натрий гидроксидіне озонмен әсер етсе, озонид түзіледі:
4NaOH + 4O 3 = 4NaO 3 + 2H 2 O + O 2
Озонид құрамындағы [O 3 - ] ионы парамагнитті . Озонидтер - тұрақсыз, кәдімгі жағдайдың өзінде оңай ыдырайтын қосылыс.
2NaO 3 = 2NaO 2 + O 2
Озонид су, қышқылдармен белсенді түрде әрекеттеседі:
4NaO 3 + 2H 2 O = 4NaOH + 5O 2
2O 3 - - e - → 3O 2 0 1
O 3 - + e - → O 2 0 + O 2- 2
4O 3 - → 5O 2 + 2O 2-
4NaO 3 + 2H 2 SO 4 → 2Na 2 SO 4 + 2H 2 O + 5O 2
Күкіртпен әрекеттесу барысыңда натрий, сульфидтермен қатар полисульфидтер де түзеді. Литий тек дисульфид түзсе, натрийде күкірт саны беске дейін теңеледі:
2Na + S
 Na
2
S
Na
2
S
Na
2
S + (n-1) S
 Na
2
S
n
Na
2
S
n
Мұндағы: n беске дейн өзгереді.
Натрий сульфиді ылғалды ауада тиосульфатқа айналады
Na 2 S + 2O 2 + H 2 O → Na 2 S 2 O 3 + 2NaOH
S 2- - 8e - → [SO 3 S] 2- 1 тотықсыздандырғыш
O 2 +4e - → 2O 2- 2 тотықтырғыш
S 2- + 2O 2 → S 2 O 3 + 4O 2-
S 2 О 3 2- ионы [S0 3 S] 2- екені және ион деп ата- латыны есте болуы керек. Біз көп жағдайда тиосулъфат анион деп атай береміз.
Вакуум жағдайында натрийді селен және теллурмен қосып балқыту натрий селенидін және теллуридін береді:
2Na + Sе = Nа 2 Sе
2Na + Те = Nа 2 Те
Селенид және теллурид су қатынасында ыдырайды:
Nа 2 Sе + 2Н 2 0 = 2NаОН + Sе + Н 2
3. Натрий литийге қарағанда, азотпен жай қыздырғанда әрекеттеспейді. Литийден өзге сілтілік металдар нитридін алу үшін азот атмосферасында металл буына электр разрядымен әсер ету керек.
6Na + N 2 = 2Na 3 N
Түзілген натрий азиді «суға өш» (гигроскопичен) ылғалды бойына тез тартады, онымен белсенді түрде әрексттесіп, аммиак түзеді:
Na 3 N + ЗН 2 0 =ЗNаОН + NН 3 ↑.
Натрий фосфидін алу үшін элементтерді тікелей әрекеттестіреді немесе натрийдің сұйық аммиактағы ерітіндісіне ақ фосфор қосады:
ЗNа + Р = Nа 3 Р
2Nа + 5Р = Nа 2 Р 5 .
Фосфид сумен өте жақсы әрекеттеседі, яғни гидролизге ұшырайды: Nа 3 Р + ЗН 2 0 = ЗNаОН + РН 3 ↑
Натрий арсениді фосфидтерге қарағанда тұрақсыздау және ылғал қатысында жылдам ыдырайды:
Nа 3 Аs + ЗН 2 0 = ЗNаОН + АsН 3
Натрий карбидін қызған натрийге ацетилен қосу арқылы алады:
2Na + С 2 Н 2 =Nа 2 С 2 +Н 2 ↑
Ескерту: Литий карбидін литийді көміртекпен тікелей әрекеттестіру арқылы алуға болады. Ал
 сілітілік өзге металдар карбидін
(N
а
, K, R
b
, Cs)
оларды ацетилен қосу арқылы алады.
сілітілік өзге металдар карбидін
(N
а
, K, R
b
, Cs)
оларды ацетилен қосу арқылы алады.
Натрий ацетилениді, литий ацетилениді сияқты сумен әрекеттесіп ацетилен және гидроксид түзеді:
Nа 2 С 2 + 2Н 2 0 → 2NaОН + С 2 Н 2 ↑
5. Натрий өзге сілітілік металдармен қатты ерітінді түзбейді, алайда калиймен 12, 3°С балқитын К-Nа құймасын береді. Бұл қасиеті жөнінен, ол литийге жақын келеді.
Натрий - сұйық алюминиймен араласпайтын литийге қарағанда - алюминий, галлий, индий, қалайымен араласып, интерметаллидтер түзеді. Сынаппен амальгама береді. Аммиактағы ерітіндісі қорғасын, сурьма, висмуттармен бинарлы қосылыстар береді:
4Na + 9Pb
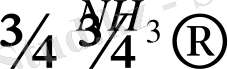 Na
4
Pb
9
жасыл түсті ерітінді
Na
4
Pb
9
жасыл түсті ерітінді
3Na + 7Sb
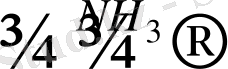 Na
3
Sb
7
қызыл түсті ерітінді
Na
3
Sb
7
қызыл түсті ерітінді
3Na + 7Bi
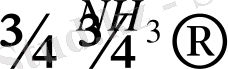 Na
3
Bi
7
қоңыр түсті ерітінді.
Na
3
Bi
7
қоңыр түсті ерітінді.
Осы аммиакта алынған бинарлы қосылыстар ерітінділерін электролизге ұшыратқанда, катодта натрий бөлінеді:
Nа + Нg →NаНg натрий амалгамасы.
6. Натрий сутекпен әрекеттесіп тұзтектес гидрид түзеді:
2Na + Н 2 = 2NаН.
7. Натрий күрделі заттармен де оңай әрекеттеседі.
Натрий, литийге қарағанда сумен белсенділеу әрекеттесіп, сутек және гидроксид түзеді:
2Na + 2Н 2 0→ 2NaОН + Н 2 ↑
Осы орайда, сілтілік металдарды қышқылдармен әрекеттестіргенде ол су молекуласымен бе, әлде қышқыл молекуласымен бе бірінші әрекеттестінін анықтау мақсатында реакция үшін Гиббс энергиясының өзгерісіне талдау жасалық.
Мысалы: 1) Na + Н 2 0→NaОН + 0, 5Н 2
∆ г G° = ∆G° f (NаОН) - ∆G° f (Н 2 0) = (-419, 2) -(-237, 8) =-181, 4 кДж.
- Na + НСl → NаСІ + 0, 5Н2↑
∆ Г С° = ∆G° f (NаС1) - ∆G° f (НС1) = (-384, 0) -(-131, 2) = -252, 8 кДж. Келтірілген екі реакция үшін Гиббс энергиясының өзгерісін салыс-тырамыз:
∆ Г С°(2) < ∆ Г С°(1), яғни (-252, 8) < (-181, 4) .
Демек, натрийдің суға қарағанда қышқылмен әрекеттесуі термодинамикалық тұрғыда тиімді және бірінші кезекте қышқылмен әрекеттесіп тұз түзетіндігін білдіреді.
2Na + Н 2 S0 4 → Nа 2 S0 4 + Н 2 ↑
10Nа + 12НNO 3 (конц. ) = 10NаNOз + N 2 + 6Н 2
Na° - e - →Nа + 10 тотықсыздандырғыш
2N 5+ + 10 e - → N 2 11 тотықтырғыш
8 Nа + 10HNO 3 (сұйық) = 8NaNO 3 + NH 4 N0 3 + ЗН 2 О
Nа 0 е - → Nа + 8 тотықсыздандыршш
N 5+ + 8 e - → N 3- 1 тотықтырғыш
8. Натрий жоғары температурада төмендегідей де тотықсыздандырғьштық қасиет көрсетеді:
4Nа + ТiСІ 4
Ті + 4NаС1
8Na+ Na 2 S0 4
4Nа 2 0 + Nа 2 S
Na 0 - e- → Na + 8 тотықсыздандырғыш
S 6+ + e - → S 2- 1 тотықтырғыш
К 2 ZrҒ 6 ] + 4Na
Zг + 2КҒ + 4NаҒ
4Nа + ZгС1 4
Zг + 4NаС1
2Nа +2NH 3 + 2
С2NаСN + ЗН 2
Натрий асқын тотығы (оксиді) Na г 0 2 - өте белсенді тотықтырғыш: онымен жанасқан кездегі сірке қышкылы жанады. Nа 2 0 2 оттектің артық мөлшерінде натрий жанған кезде түзіледі де көп мөлшерде жылу бөлінеді:
2Na + O 2 = Na 2 O + 124ккал
Техникада Na 2 O 2 (оксилитті) алюминийлік ыдыста натрийді өртеп алады. Ол -сарылау түсті ұнтақ, оны Кипп аспабында (аппаратында) тығыздалған түрінде оттектің бір қалыпты берілетін көзі ретінде пайдаланады.
Сумен Nа 2 0 2 әрекеттесуі сілті мен сутек асқын тотығының түзілуімен жүреді:
Na 2 O 2 + 2Н 2 0 = 2NаОН + Н 2 0 2
Әртүрлі материалдарды ағарту үшін, жууғыш ұнтақтарды дайындау және т. б. үшін Nа 2 0 2 пайдалану осы қасиетке негізделген.
Кейбір заттармен (көмір, фосфор, алюминий, темір ұнтағымен, органикалық заттармен) ылғал қатысында Nа 2 0 2 соншалықты қызу әрекеттеседі, бұл реакциялар өздігінен тұтанумен және тіпті қопарылыспен қатар жүреді.
Көмір кышқылды газ натрий асқын тотығымен карбонатқа байланысады, тағы да оттек болінеді:
2Nа 2 0 2 + 2С0 2 = 2Nа 2 СО 3 + 0 2 ↑
Немесе
Nа 2 O + 2КО 2 + 2С0 2 = Na 2 С0 3 + К 2 СО 3 + 20 2 ↑
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz