Ерігіштік көбейтінді және гетерогенді тепе-теңдік: тұнба түзілуі мен еріту шарттары


ӘРЕКЕТТЕСУШІ МАССАЛАР ЗАҢЫ ЖӘНЕ ГЕТЕРОГЕНДІ
ТЕПЕ-ТЕҢДІК
Еріткіш көбейтіндісі
Жүйелер гетерогенді және гемогенді болып бөлінеді. Беттік шекарасы жоқ біртекті жүйелер гомогенді жүйелерге жатады. Тұздардың қышқылдар мен негіздердің судағы ерітінділері және бір-біріне жақсы еритін сұйықтар да гомогенді жүйелер болып табылады.
Гетерогенді жүйелер табиғаты әртүрлі екі немесе бірнеше фазадан тұрады. Фазалар бір-бірімен беттік көзқарастарымен бөлінеді. Мысалы; газ -сұйық, газ-қатты зат, сұйық-сұйық, сұйық - қатты зат. Фаза арасындағы процестер аналитикалық химияда тұндыру, еріту, айдау, экстракция процестерінде кеңінен қолданылады. Фазалар арасында жүретін процестер әрекеттеуші массалар заңына бағынады, себебі кесімді уақытта фазалар арасында тепе -теңдік орналады.
Тұндыру реакцияларды орындаған кезде осындай гетерогенді жүйелерімен кездесу тура келеді. Мысал ретінде AgCl тұзының қанық ерітіндісінен тұратын жүйені қарастырса, ол екі қарама-қарсы процестен тұрады.
AgCl AgCl Ag(шур) + Cl - (шур)
Тұнба ерітінді қанық ерітінді
Егер ерітінді қанықпаған болса, еру процесі тұну процесіне қарағанда басым болады. Ал аса қанық ерітінді декерісінше тұнба түзу процесі басым болады. Біз алған мысалда өру процесімен қатар түзілген Ag пен Ul иондарының кездесіп соқтығысу нәтижесінде белгілі уақыттан кейін кері процесс-тұнба түзу процесі жүреді. Қарама-қарсы процесстердің жүруі динамикалық тепе-теңдік күйге алып келеді. Қанық ерітінділерде фазалар шекарасында тепе-теңдік орналған жағдайда кесімді уақытта Ag және Cl иондарының бірдей саны ериді және тұнбаға түседі. Осы орын алған тепе-теңдікке әрекеттесуші массалар заңын қолдануға болады.
Толығырақ тепе-теңдік күйге тоқталатын болсақ, онда:
- Ag -иондарының ерітіндідегі ауысу жылдамдығы (V) қатты фазаның бетін ауданының бір бөлігіне келетін Ag иондарының концентрациясына тура пропорционал, яғни:
V 1 =k 1 A 1
k 1 -тұрақты шама, AI-тұнбаның беттік ауданы, тұрақты шама.
Сонымен қатар Ag - иондарының тұнбаға түсуі мына жағдайлармен анықталады:
1. кесімді уақытта Ag ионадырының тұнбаның беттік ауданымен түйісуіне тура пропорционал, демек [Ag + ] ;
2. беттік ауданда орналасқан Cl - ионадырының санына да тура пропорционал, яғни:
V 2 =k 2 A 2 [Ag + ]
Тепе-теңдік орналған кезде:V 1 =V 2 яғни k 1 A 1 =k 2 A 2 [Ag + ]
3. Сол сияқты Сl иондарының ерітіндіге ауысуының жылдамдығы ғана теңдеумен анықталады:
V 3 =k 3 A 2
Ал керісінше Cl иондарының тұнбаға түсуі мынаған тең болады:
V 4 =k 4 A 1 [Cl - ]
Тепе теңдік жағдайда:
V 3 =V 4 k 3 A 2 =k 4 A 1 [Cl - ]
Осы жүйенің жалпы тепе-теңдік күйін сипаттайтын теңдау шығару үшін 7. 3 пен 7. 6. теңдеулерді бір-біріне көбейтеді. Сонда:
K 1 A 1 k 3 A 2 =k 2 A 2 [Ag + ] k 4 A 1 [Cl - ]
Немесе:
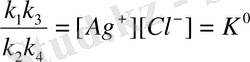
Мұнда k 1 k 3 /k 2 k 4= K 0 тұрақты шама, оны концентрациялық өрігіштік көбейтіндісі деп атайды да белгілейді. Яғни кавар еритін электролиттің ерітіндісіндегі иондары концентрациясының көбейтіндісі белгілі температурада тұрақты шама, оны ерігіштік көбейтіндңсң /ЕК с / деп атайды.
Бұл константаны ерігіштік константаны деп атауға да болады, себебі оны анықтайтын еріген заттың концентрациясы.
Кей кезде ерігіштік көбейтіндісінің орнына оның көрсеткішімен пайдаланады: рЕК=-lg
Ерігіштік көбейтіндісін активті концентрациясы арқылы өрнектеуді термодинамикалық ЕК а деп атайды. Мысалы: AnBm=nAnB
EK n =n n (A) . a m (B) =C n (A) . C m (B) . f n (A) . f m (A)
EK 0. f n (A) . f m (B)
EK n -термодинамикалық ерігіштік көбейтіндісі
АК - активтік көбейтіндісі
Өте нашар еритін электролиттерде термодинамикалық және концентрациялық ерігіштік көбейтінділері бір-біріне тең болады. Керісінше электролиттің ерігіштігі жоғары болса, онда f бірге тең болмайды.
Тұнба құрамында бірнеше компоненнтер концентрациясының көбейтіндісіне тең. Мысалы, Mg, NH, PO
EK = [Hg 2+ ] [NH + 4 ] [PO 3- 4 ]
Егер тұнба құрмында бірдей иондар бірнеше болса /ЕК/ ерігіштік көбейтіндісінің формаласында бұл иондар концентрацисын сол ионның санына тең дәрежеде алады. Мысалы, Са 3 (PO 4 ) 2
EK =[Hg 2+ ] [NH + 4 ] [PO 3- 4 ] 2
Жалпы күйді қарастырсақ: AnBm-nA m+ +mB n-
EK (AnBm) =[A m+ ] n [B n- ] m =ИК
МК-иондар көбейтіндісі.
Бұл тепе-теңдіктен мынадай қорытынды жасауға болады:
- Егер нашар еритін электролит иондарының концентрациясының мондық көбейтіндісі /ИК/ ерігіштік көбейтіндісінен төмен болса, яғни ЕК, онда ерітінді қанықпаған, мұндай жағдайда тұнба түзілмейді.
- Егер иондық көбейтіндісі ИК нашар электролиттің ерігіштік көбейтіндісінен жоғары болса /ИК > ЕК/ ерітінді аса қанық болғаны. Жүйеде тепе-теңдік орнамастан бұрын тұнба түзіледі.
- ИК-ЕК тең болған кезде, ерітінді қамық, жүйеде динамикалық тепе-теңдік орын алады. Егер иондардың концентрациясы өзгеретін болса, тепе-теңдік екі жақтың біріне ығысады.
Аналитикалық химияда кей жағдайларда ерігіштік көбейтіндісі ұғымы орнына тұнба түзілу константасын пайдаланады:
 / ЕК
/ ЕК
Тұнба түзілудің шартты жағдайын ескеру үшін тұнба түзілудің шартты константасын
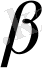 пайдаланады.
пайдаланады.
Мұны түсіну үшін, мысал ретінде MnS тұнбасының түзілуін қарастыруға болады: Mn 2 +B 2 MnS
MnS түзілу константасы
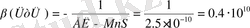
Бұл тұнба тек S 2- - иондарының қатысында жүреді, ал S 2 иондамының концентрациясы ерітіндінің рН-на тәуелді, себебі S 2- bjylfhs H + иондарымен жанама реакцияға қатысып H 2 S түзеді. Мысалы, рН-ы 2 тең 0, 1 моль/л H 2 S ерітіндісіне [S 2- ] мына теңдеумен анықталады:
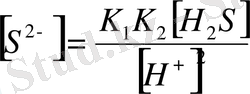 , яғни 2, 5, 10
-17
моль/л тең болады. Осы ерітіндідегі бос S
2-
иондарының үлесі:
, яғни 2, 5, 10
-17
моль/л тең болады. Осы ерітіндідегі бос S
2-
иондарының үлесі:
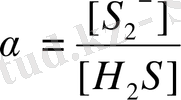 тең болады, немесе
тең болады, немесе
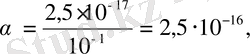 ал
ал
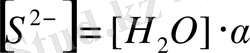
Сонда осы жағдайда тұнбаның түзілу константасы мына теңдеумен анықталады:
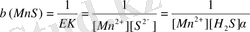
немесе
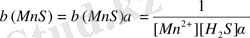
яғни
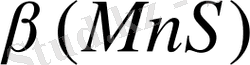 - тұнба түзілудің шартты константасы.
- тұнба түзілудің шартты константасы.
Қарастырылып отырған мысалда:
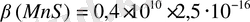
Егер шартты константаның мәні бірдей төмен болса, онда тұнба түзілмейді /немесе күшті қышқылдарда ериді/. MnS тұнбаға түспейді.
Ерігіштік көбейтіндісі және ерігіштік
Ерігіштік дегеніміз - қатты заттың ерітіндіге ауысып, гомогенді жүйе түзуі. Мысалы, АВ қосылыстың қанық ерітіндісін қарастыратын болсақ:
АВ А+В
Бұл теңдеуден I моль АВ еріген кезде І моль А және І моль А және І моль В түзілетінін көруге болады, яғни [A] =C (AB), [B] =C(AB) моль /д/ ал С(АВ) -АВ қосылысының молярлық ерігіштігі, оны В немесе S әрпімен белгілеуге болады.
Енді осы алынған мәіндері концентрациялық ерігіштік көбейтіндісіне қойып, қосылыстың ерігіштігін анықтауға болады.
ЕК (АВ) =[A] [B] =C (AB) . =C 2 (AB)
C (AB) =

Егер нашар еритін электролеттің құрамы күрделі болса:
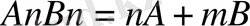

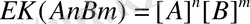
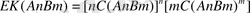
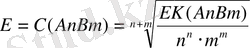
нашар еритін электролидттер әр түрлі зарядталған иондардан тұратын болса олардың ерігіштіктерін салыстыру үшін ерігіштік мәнін пайдалану қажет. Мысалы,
ЕК(AgCl) =1, 70 . 10 -10 EK (AgCl 4 ) =1, 110 -12
Яғни, Ag 2 Cro 4 ерігіштік көбейтіндісі AgCl көбейтіндісіне қарағанда төмен, бірақ ерігіштігі жоғары.

Ерігішті г/л айналдыру үшін алынған мәндері қосылыстардың молярлық массасына көбейту қажет.


Қосылыстың өрігіштігі неғұрлым болса, еру процесі соғұрлым баяу жүреді.
Суда нашар еритін электролиттердің өрігіштігін түрлерімен ерекшеленеді. 1/Массалық ерігіштік/Сm/
Массалық концентрация 1л қаныққан ерітіндідегі еріген заттың грамм мөлшерімен анықталады /г/л/: Cm=
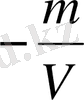
Мұнда: m-еріген заттың грамм мөлешрі /г/
v-қаныққан ерітімдінің көлемі /л/
2/ Молярлық ерігіштік.
Молярлық ерігіштік нашар еритін электролиттің І л қаныққан ерітіндісіндегі заттың моль санымен анықталады /моль/л/
Е(АВ) =
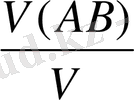 ; мұнда Е/АВ/-қосылыстың молярлық ерігіштігі /моль/л/.
; мұнда Е/АВ/-қосылыстың молярлық ерігіштігі /моль/л/.
V/АВ/-заттың мөлшері /яғни моль саны/;
V-ерітіндінің көлемі /л/. Алдыңғы теңдеудің былай деп жазуға болады:
Е(АВ) =
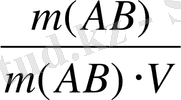 мұнда m(AB) еріген заттың грамм мөлшері, /г/
мұнда m(AB) еріген заттың грамм мөлшері, /г/
М/АВ/-оның молярлық массасы, /г/моль/. V-көлем /л/.
Молярлық ерігіштікті массалық ерігіштікке айналдыру үшін жоғарыда айтылғандай, оны заттың молярлық массасына көбейту керек:
Cm=E(AB) (AB)
Көптеген қосылыстардың молярлық ерігіштігі анықтамаларда келтірілген. Бірақ ерігіштік түрлі жағдайларға /еріткіштің, еритін заттың табиғатына, температураға т. б. / байланысты өзгеріп отырады.
Ерігіштікке еріткіштің табиғаты да әсер етеді. Мысал ретінде CuCl 2 түрлі еріткіштерде қарастыруға болады /100 г еріткіштегі еріген заттың грамм мөлшері/.
AK[Ca 2+ ] [SJ 4 2- ] f Ca 2+f SO4 2-m(1, 47 . 10 -2 ) 2. (0, 412) 2 =3, 67 . 10 -5
Ерігіштігі орташа болатын қосылыстардың активтік коффициентін ескерген жөн.
Тұнбалардың ерігіштігіне түрлі жағдайлардың әсері
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz