Азот тотығының бидай алейрон клеткаларының программаланған өліміне әсері


Әл - Фараби атындағы Қазақ Ұлттық Университеті
Биология факультеті
Генетика және молекулалық биология кафедрасы
БIТIРУ ЖҰМЫСЫ
Азот тотығының бидай алейрон клеткаларының программаланған өліміне әсері.
РЕФЕРАТ
Бiтiру жұмысы 30 беттен, 4 суреттен, 2 кестеден және 77 сiлтеме әдебиеттерден тұрады.
Жұмыстың мақсаты: Азот тотығының бидай алейрон клеткаларының программаланған өліміне әсер ету ерекшеліктерін зерттеу.
Жұмысты жасау үшiн объект ретiнде: Қазақстан 4 сортты гексаплоидты бидайдың (Triticum aestivum) дәндері қолданылды.
Жұмыс барысында келесi әдiстемелер қолданылды: Бiркелкi буферлiк жүйедегi ПААГ электрофорезi, агарозды гельдегі электрофорез, спектрофотометриялық әдістеме.
Кiлттiк сөздер: азот тотығы, клеткалардың программаланған өлімі, тотықтырушы агенттер, антиоксидантты ферменттер, алейрон қабаты, сутегінің асқын тотығы, α-амилаза.
ҚЫСҚАРТЫЛҒАН СӨЗДЕР ТІЗІМІ
ОБТ- оттегінің белсенді түрлері
АБҚ - абсциз қышқылы
ГҚ - гиббереллин қышқылы
ГГПФ -
NO - азот тотығы
SNAP - S-нитрозо-N-ацетилпенициламин
КПӨ - клетканың программаланған өлімі
ПААГ - полиакриламидтік гель
О * - супероксид радикалы
Н 2 О 2 - сутегінің асқын тотығы
МАЗМҰНЫ
КIРIСПЕ. … . . . 5
1 ӘДЕБИЕТКЕ ШОЛУ. . . . . . 6
1. 1 Аст ық тұқымдастарының алейрон қабаттары . . . . . . 6
1. 2 Гиббереллин қышқылының метаболизмі . . . 8
1. 3 α-амилазаның функциясы мен құрылысы . . . 11
1. 4 Азот тотығы. . . . . 13
2 ЭКСПЕРИМЕНТТІК БӨЛІМ . . . 16
2. 1 МАТЕРИАЛДАР МЕН ЗЕРТТЕУ ӘДІСТЕРІ . . . … . . . . . … . . . 16
2. 1. 1 Бидай дәнінің жекелеген алейрон ұлпасын бөліп алу… . . . 16
2. 1. 2 Бидай дәнінің жекелеген қабатын инкубациялау шарттары . . . 16
2. 1. 3 Сутегінің асқын тотығының мөлшерін анықтау …… . . . … . . . …. . 17
2. 1. 4 Клеткалық және секрецияланған α-амилаза ферменттерін экстракциялау және олардың белсенділігін анықтау . . . 17
2. 1. 5 ДНҚ-ны бөліп алу әдісі. . . . . 18
3 НӘТИЖЕЛЕР ЖӘНЕ ОЛАРДЫ ТАЛҚЫЛАУ. . . . 19
4 ҚОРЫТЫНДЫ. . . …… . . . 25
5 ҚОЛДАНЫЛҒАН ӘДЕБИЕТТЕР ТIЗIМI. . … . . . 26
КIРIСПЕ
Бидай дәнінің өнуі барысында оның алейрон қабаты бірқатар гидролитикалық ферменттерді (соның ішінде α-амилазаны ) синтездеп, оларды секрециялайды. Бұл гидролазалардың синтезінің индукциясы ұлпада гиббереллин қышқылының (ГҚ) болуына тәуелді. Гиббереллинге - тәуелді гидролазалардың синтезі осы фитогормонның табиғи антагонисті болып табылатын - абсциз қышқылымен (АБҚ) тежеледі [1] .
Дәннің алейрон қабатындағы клеткалар онтогенездің келесі кезеңдерінде элиминацияға ұшырайды. Алейрон қабатындағы клеткаларының осы өлімі программаланған сипатта жүреді, яғни генетикалық жағынан детерминацияланған деген болжам бар (апоптоз) [2; 3] .
Алғашқы жұмыстарымызда біздер бидай дәнінің алейрон қабатындағы және эндосперіміндегі клеткалардың программаланған өлімінің (КПӨ) морфо - биохимиялық белгілері анықтап, сипаттаған болатынбыз [4; 5] . Бидай дәнінің алейрон қабатындағы КПӨ-ң орындалуы барысында супероксид (О*), сутектің асқын тотығы (Н 2 О 2 ) сияқты оттегінің белсенді түрлерінің (ОБТ) және антиоксидантты ферменттік жүйелердің (супероксиддисмутаза, аскорбатпероксидаза, каталаза және т. б. ) маңызды рөл атқаратындығы анықталған [6] .
КПӨ-ң реттелуінде азот тотығының (NO) маңызды рөл атқаратындығы белгілі [6] . NO- газтәрізді бос радикал, клеткааралшық зат пен плазматикалық мембранадан оңай диффузияланады. Ол клеткаішілік мессенджерлік жүйенің бір бөлігі бола тұра, NO- ң жануарлар жүйесіндегі физиологиялық үрдістеріне кең көлемді әсер ету қасиетімен ерекшеленеді [7] .
Қазіргі кезде әдебиеттерде жинақталған мәліметтерге қарағанда, NО сонымен қатар өсімдіктерде жүретін көптеген физиологиялық үрдістерге қатысатындығын көрсетеді: патогенге жауап реакциясы, өніп-өсу, фитогормондардың мөлшері, сонымен қатар КПӨ (апоптоз) . [8] . Соя клеткаларының культурасында NO мен ОБТ арасындағы әрекеттесу нәтижесінде КПӨ-нің орындалатыны белгілі болды. NO жеке өзі клеткалардың өлімін индукциялай алмайды, сонда КПӨ-нің жүзеге асуы NO: супероксид қатынасы арқылы детерминацияланатыны көрсетілген.
Осы мәліметтердің барлығы өсімдіктер клеткасында программаланған өлімнің жүзеге асуы барысында NO ОБТ-ң клеткадағы мөлшерін реттеуде маңызды рөл атқаратындығын дәлелдейді.
Осыған орай бұл жұмыста біздер клеткаішілік оттегі радикалдарының мөлшерін реттеудегі NO рөлін зерттедік. Бидай дәнінің алейрон қабатындағы клеткалардың функционалдық белсенділігінің реттелу механизмдері қарқынды зерттеліп жатқанымен [1-3], әлі секреторлық белсенділікті бақылауда және клеткалардың өліміндегі азот тотығының рөлі толық анықталмаған, тіпті зерттелмеген деуге болады.
1 ӘДЕБИЕТКЕ ШОЛУ
- Астық тұқымдастарының алейрон қабаттары
Астық тұқымдастарының алейронын зерттеу кем дегенде екі ғасырға созылып келеді. Астық алейроны өсімдіктердің ең қарқынды түрде зерттеліп келе жатқан ұлпаларының бірі болып табылады. Сыра қайнатуда және ашытқы дайындауда астық алейроны маңызды орын алатындықтан химия және биология мамандары шамамен 200 жыл бұрын арпаның маңызын егжей-тегжейлі зерттей бастады [9] .
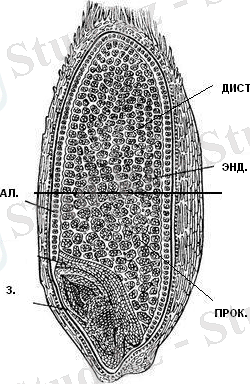
ЕСКЕРТУ: АЛ. - бидай дәнінің алейрон қабаты; ЭНД. - бидай дәнінің крахмалды эноспермі; ПРОК. - бидай дәнінің проксимальды бөлігі; ДИСТ. - бидай дәнінің дистальды бөлігі. 3 - бидай дәнінің ұрығы
Сурет 1- Бидай дәнінің құрылысы
Бидай дәнінің эндоспермі тозаң қапшығында, орталық клетканың аталық жыныс клеткасымен ұрықтану нәтижесінде пайда болатын, триплоидты ұлпа (1-сурет) . Тозаңдану процесінен кейін шамамен 8-10 тәуліктен соң, дән эндоспермі крахмалды эндоспермге және алейрон қабатына дифференциацияланады [10] . Алайда, ұрықтанған бір клеткадан пайда болатынына қарамастан, алейрон ұлпасы мен крахмалды эндосперм клеткаларының өлуі әртүрлі уақытта жүзеге асады. Крахмалды эндосперм клеткалары бидай дәнінің пісіп-жетілу барысында өліп, дән қуысын белокты және крахмалды гранулалар түрінде толтырып тұрады деген болжам бар. Ал алейрон клеткалары, дәннің пісіп-жетілу сатысында еш өзгеріссіз сақталып, тек қана оның өніп-өсу сатысын, гидролитикалық ферменттерді синтездеп, секрециялау арқылы индукциялағаннан кейін ғана элиминацияланады [11] .
Алейрон қабатының онтогенетикалық программаланған клеткалар өлімі (ПКӨ) апоптотикалық сипатта жүзеге асатыны анықталған [12-14] . Бұл процестің белсенділігінің артуымен, геномдық ДНҚ молекуласының фрагментациялануымен үйлесіп, фитогормондар - гиббереллин және абсциз қышқылдарымен бақыланылатыны көрсетілген [15] .
Жоғарыда айтылғандай, алейрон клеткаларының негізгі қызметі гидролитикалық ферменттерді (α-амилазаны қоса) синтездеп, крахмалды эндоспермге секрециялау.
Алейрон клеткаларының ультра құрылымы олардың қызметін көрсетеді. Дәндегі алейронның көптеген көрсеткіштері оның ерекше және жан-жақты тәжірибелік жүйе болуын қамтамасыз етеді. Астық тұқымдастарының алейрон қабаты біртекті, жоғары дифференциалданған клеткалардың бір қабатынан (сұлы, жүгері, қара бидай, бидай) немесе бірнеше қабатынан (күріш, арпа) тұрады [16] . Пісіп-жетілген, құрғақ алейрон клеткалары қалың, геммицеллюлозалық қабырғамен қоршалған және олар ешқандай да клеткалық бөлінуге ұшырамайды. Алейрон қабаттарын жабысып қалған өлі крахмалды эндоспермнен ажыратып алуға болады және ажыратып алынған алейрон ұлпасынан ферменттердің көмегімен протопластардың біртекті популяциясын дайындауға да болады [17] . Осындай жолмен жекеленіп алынған протопластар, тұтас алейрон ұлпалары сияқты гиббереллинге тәуелді α-амилаза изоферментінің активтенуі және синтезін қамтамасыз ететіні көрсетілген. Жекеленген протопластар алу әдістемесі сұлы және арпа алейрон ұлпасына қатысты жасалынған [18] Біздің лабораторияда бидай алейрон ұлпаларынан жекеленген протопластарды бөліп алудың және тазалау, оларды концентрлеу үшін фракциялаудың модификацияланған әдістемесі ұсынылған [19] . Ферменттік өңдеу арқылы алынған бидай алейрон протопластарының шығымы шикі ұлпаға шаққанда -35х10 6 клетка/1 г болды. Протопластарды фиколл градиенттінде центрифугалау әдістемесі тіршілік дәрежесі жоғары клеткалар фракциясын алуға мүмкіндік берді (шамамен 80-85 %) .
Алейрон клеткаларының цитоплазмасына белоктар қорынан тұратын көптеген вакуольдер тән, оларды көбінесе алейрондық түйіршіктер деп те атайды, олар бүкіл клеткаларды алып жатады. Бұл органелла алейронның гормондар әсеріне қайтаратын реакциясында негізгі қызмет атқарады. Протеиндердің қоры бар вакуольде гиббереллинмен өңделгеннен кейін гидролизге ұшыраған протеиндерді секреторлық белоктардың түзілуіне қажетті аминқышқылдармен қамтамасыз ету үшін қор ретінде сақтай бастайды [20] . Протеиндердің қоры бар вакуольдер, сондай-ақ, астық тұқымдастардың дәндеріндегі минералдардың негізгі қоймасы болып табылады. Олардың құрамынан минералдар фитин түрінде бөлініп алынған. Фитин К + , Mg 2+ , және Ca 2+ иондары мен фитинді қышқылынан (гексофосфат) түзілген кристалды, ерімейтін комплекс болып табылады. Бұл кристалды қосынды, глобоид деп те аталады. Рентгендік микроанализ нәтижелері бойынша дән құрамындағы РО 4 3+ , К + , Mg 2+ және Ca 2+ иондарының шамамен 75% алейрон қабаттарында сақталады [21] . Алейрон немесе протопластардың инкубациялық кезеңінде вакуольдер көлемдері ұлғайып, бір-бірімен орталық үлкен бір вакуоль түзілгенше қосыла бастайды. Инкубациялық ортада гиббереллин болған жағдайда клеткалар мен протопластардағы алейрон қабаттарының вакуольдену процесі жылдамдай түседі. Бейтарап майларды сақтайтын липидтік қосындылар немесе олеосомдар да алейрон клеткаларының маңызды органеллалары болып табылады, олар клетканың бүкіл кеңістігінің 30% алып жатқан үшглицеридтік негізден тұрады [22] . Алейрон клеткаларындағы олеосомдар эндоплазмалық торда пайда болып, кейіннен эндоплазмалық торға және протеиндердің қоры бар вакуольдер бетіне бекінген күйде болады. Олеосомдардың вакуольдер бетіне бекініп жатуы вакуолдердің кейбір түрлері тікелей эндоплазмалық тордан пайда болады деген болжамды растайды. Қор ретінде сақталған бейтарап майлар алейрон клеткаларын көміртегі көзімен де қамтамасыз етеді, эндоспермді мобилизациялау басталғанға дейін клетка көміртегіні осы жерден жұмсай алады, сонымен бірге мұндағы май қышқылдары мембрананы түзуге пайдаланылады. Бұл май қышқылдарының алейрон клеткалары арқылы метаболизденетініне бірнеше дәлелдер бар. Алейрон клеткаларында малатсинтетазадан және изоцитрат лиазадан тұратын көптеген глюкоксисомалар да болады [23; 24] және оқшауланып алынған алейрон қабаттары сахарозаны синтездей алады.
Жоғарыда айтылғандай, алейрон клеткалары - жоғары деңгейде дифференциацияланған ұлпа. Бұл ұлпаның негізгі қызметі - гидролитикалық ферменттерді (альфа-амилазаны қоса) синтездеп, крахмалды эндоспермге секрециялау. Олай болса, алейрон ұлпаларында оның секреторлық қызметіне байланысты эндоплазматикалық тор, Гольджи аппараты, митохондриялар өте жақсы дамыған.
Аталған гидролитикалық ферменттердің ішінде α-амилаза, дәннің өніп-өсуіне қатысты маңызды болып табылады. Крахмалды эндоспермге секрецияланған α-амилаза крахмалды қанттарға дейін ыдыратып, өсімдіктің өніп-өсуіне қажет энергиямен қамтамасыз етеді [25; 26] .
α-амилаза ферментінің практикалық маңыздылығына байланысты (ауыл-шаруашылығы, сыра дайындау, нан өндіру, фармакология және т. б. ) оларды зерттеу жұмыстарына ғалымдар ертеден көңіл аударуда. Осыған орай альфа-амилаза ферментінің құрылысы мен қызметі келесі бөлімде терең қарастырылады.
1. 2. Гиббереллин қышқылының метаболизмі
Гиббереллиндер - химиялық тұрғыдан табиғаты дитерпеноидты биологиялық активті қосылыстарға жатады. Олар барлық зерттелген жоғарғы сатыдағы өсімдіктердің ұлпаларында табылған. Қазіргі кезде гиббереллиндер қарқынды зерттелуде, себебі олар өсімдік организмдеріндегі алуан түрлі физиологиялық процестерді реттеуге қатысады [27-29] .
Ең алғаш рет 1926 жылы Кусова деген жапон ғалымы, күріш тұқымының қалыпты өсуіне кедергі болатын паразиттік саңырауқұлақтарында ( Gibberella Fugjikuroi ) бірінші рет, гиббереллин фитогармонын тапты. Гибберелин қышқылын (ГҚ) 1930 жылы жапон биохимиктері химиялық сипаттама беріп, таза күйде бөліп алды. Осы кезге дейін гибберелиндердің 65-тен аса түрлері бөлініп, химиялық статусы анықталды. Оның ішінде, ең жақсы зерттелгені - Гиббереллин қышқылы 3 (ГҚ 3 ), ол Gibberella Fugjikuroi саңырауқұлағында түзіледі [30; 31] .
Гибберелин қышқылы 4-А, В, С, және Д сақиналарынан түзілген, 4 изопрендік сақинадан құралған тетрациклді дитерпеноид болып табылады. Гибберелиндердің химиялық құрлымының негізінде гиббереллан қаңқасы жатыр. Гибберелиндер өзара А сақинасында қаныққан байланыстар, гидрок-сильді және карбоксильді топтардың, сонымен қатар, осы топтардың орнала-суымен ажыратылады. Гиббереллин молекулаларының тетрациклді ядро-сында бірнеше тұрақты орынбасарлары болады: С-7-де карбоксильді топ; С-17-де экзометиленді қос байланыс; С-18-де СН 3 топ; С-19 -лактон немесе карбоксильді топ орналасқан [32] . Басқа орынбасарлардың айырмашылығы неме-се олардың ұқсастығы барлық гиббериндердің алуан түрлілігін анықтайды. Көміртегінің атомының санына сәйкес, гибберелиндер екі топқа бөлінеді: 20 көміртекті және редукцияланған 19 көміртекті. Энт-гибберелан С 20 гибберелиндерінің молекулалық бастамасы болып табылады. 10-шы жағдайда 20 көміртекті гибберелин қышқылдарының қосымша метильді, гидроксиметильді, карбоксильді топтары болады [33] . С 19 гибберелині келесі негізгі көміртекті қаңқасының модификациялануы және С 20 атомының аластатылуы нәтижесінде түзіледі. С 20 гибберелиндер физиологиялық активті емес және де олар С 19 гибберелиндердің биогенетикалық бастаушысы болып табылады [34] . Жоғарыда айтылғандай, ГҚ тетрациклді дитерпеноидтар класына жатқызылады, сондықтан да олардың биосинтезінің алғашқы сатысы ацетил Со А-дан (ГГПФ) дейін полизопренойдтар үшін ортақ болады [35-37] . Гибберелиндердің синтезінің бірінші фазасы (ГГПФ-ГА 12 -альдегид) жоғарғы сатыдағы өсімдіктерде қандай болса, саңырауқұлақтар үшін де тура сондай ( Gibberella Fugjikuroi ) . Бірінші этапта, ГГПФ копалилпирофосфат және кейіннен энт-кауренге айналады. Бұл айналу тізбегі екі типті активтілік көрсететін энт-кауреназа арқылы катализденеді. Гибберелин 12 альдегидтен бастап гибберелиндерге дейінгі сатысы Gibberella Fugjikuroi саңырауқұлағында толығымен анықталған. Кейбір жағдайларда аталмыш саты жоғарғы сатыдағы өсімдіктердің клеткадан тыс жүйелерінде зерттелген [38; 39] . Gibberella Fugjikuroi саңырауқұлағының культурасы жоғарғы сатыдағы өсімдіктерге қарағанда, өсу ортасына көп мөлшерде гибберелин қышқылын бөледі. Бұл олардың (ГҚ-ның) алынуы мен таза күйде көшіруін оңайлатады. Сонымен қатар in vitro жағдайда саңырауқұлақ клеткалары жақсы өседі және ортадағы экзогенді гибберелиндер түзуге қажет бастаушы заттарды тез сіңіре алады. Атап айту керек, Gibberella Fugjikuroi В1-41а мутантарымен жүргізілген жұмыс ең нәтижелі болып шықты. Бұл мутанттар энт-кауреннің тотығуын қамтамассыз ете алмайды. Алайда, мутанттағы гибберелиндердің биосин-тездің келесі сатыларын жүзеге асыратын ферменттердің сақталатыны анық-талды. Сондықтанда тек экзогенді бастамаларды қосып оның қандай соңғы өнімге айналатынын бақылауға болады [28] . Gibberella Fugjikuroi В1-41а мутанттарына жүргізілген эксперименттің негізінде, ГҚ-ның биосинтез жолы гибберелин 12- альдегиді сатысында екі тармаққа бөлінетіні анықталды: 1) 3 бета гидроксильденудің ерте жолы және 2) 3 бета гидроксильденуді айналып өту жолы [40] . Бірінші жолдың ГҚ 3 -ның және басқа жақсы зерттелген 3-бета оксигибберелиндердің түзілуіне әкелетіні көрсетілді. Екінші жол 12 және 19 гибберелин қышқылдарының түзілуіне әкеледі. Соңғы жылдары гибберелиндердің синтезін зерттеу, жоғарғы сатыдағы өсімдіктердің, жоғарыда айтылып өткен екі жолдан бөлек, тағы бір типті С-13-гидроксильденудің ерте жолы бар деуге мүмкіндік берді [36] . Ең соңында осы барлық альдегид жолдарының алмасу мүмкіндіктері С 19 және С 10 атомдарының арасындағы лактонды сақинаның ажырауына әкеледі. Гибберелин-А 12 -альдегидтінің энт-кауреннен түзілуін зерттеудегі эксперименттерде аралық буындардың созылғыш қабықтарына және қараңғыда өсірілген жүгерінің өсінділерінің гомогенатына енгізілген 17-13С, 3 Н-кауреноидтар қолданылды. Тәуелсіз биохимиялық және физика-химиялық әдістер, капилярлы газды хромотографияны қолдана отырып, алғаш рет өсімдіктердің вегетативтік ұлпаларындағы энт-кауреннің гибберелиндерінің түзілуінің 5 метаболитикалық сатысы ашылды. Олар: энткауренол, энткаурен қышқылы, энт-альфа гидроксикаурен қышқылы, гибберелин А 12 -альдегид [41] .
1) Сонымен көптеген көрсеткіштердің бірлестігі С-19 гибберелиннің ГҚ 3 мысалында биосинтездің негізгі этаптарын айқындап түсіндіреді, гибберелиндердің тегі жалпы тетроциклиндер болып табылады.
2) Энт-кауреннің бірнеше тізбектелген тотығу реакцияларының айналуы: кауренол-кауренал-каурен қышқылы-20 көміртекті А 12 -альдегид;
3) а 12 -альдегидінің әртүрлі гибберелиндерге дейін тотығуы.
Ең басты мәселе, ГҚ биосинтезіне жауапты ферменттерді анықтау. Әзірге олардың табылғандары аз. Біртіндеп терпен тізбегінің С 5 -С 10 -С 15 -С 20 ұзаруын катализдейтін геранил-геранилпирофосфат синтетаза ферменті бөлініп алынған [42] . Кауренсинтетаза 2 белсенді орталықтардан тұрады, оның біріншісі капалилпирофосфаттың түзілуін катализдейді, екіншісі кауренге циклдейді [43] . Сонымен қатар, монооксигеназаларда микросомалық ферменттер табылған, олар ГҚ 12 -альдегидті С 20 және С 19 -гибберелиндерге айналдырады [44] .
Хлорхалинхлорид және АМО-1618 геранил-геранилпирофосфаттан копалинпирофосфаттың түзілуін, оның кауринге циклденуінің Фосфон Д стадиясын тежейді. Анцилиндал кауренінің тотығуын ингибрлейді [45; 46] . ГҚ-ның өсімдіктердің бойымен қозғалуы базипетальды бағытта жүреді. Көбіне флоэмада және аз мөлшерде сұйық заттармен ксилеманың бойында. Табиғи гибберелиндер өсімдікердің бойында көбіне бос қышқыл түрінде кездеседі. Соңғылары комплексті түрде болады, мұнда гибберелиндер төменгі молекулалы заттармен коваленттік байланыс арқылы байлнысады. Жиі сипатталғандары ацетаттар, бетта-глюкопироноидтер, бетта-глюказилды эфирлер, Н-пропилді эфирлер. Коньюгацияланған ГҚ-ның негізгі ерекшелігі олардың биологиялық активтілігінің төмендеуі [28] . Өсімдік онтогенезіндегі гибберелиндердің құрамының өзгеруі көп қызығушылық тудырады. ГҚ деңгейі, арпаның 2-3 жапырақты және түктелу фазаларында жоғарлайды, яғни сабақтың ұзына бойы өсу барысында белсенді болады, ал сабақтың өсуі әлсіреген кезде белсенділігі төмендейді [47] . Осыған ұқсас көрсеткіштер қосжарнақты өсімдіктерде байқалған [48; 49] . Сонымен қатар жапырақтың құрамындағы гибберелиндердің мөлшері өсу деңгейіне қарай артып отырады [50-52] . Оның артуы жапырақтың өсу кезеңі аяқталуға жақын уақытта байқалады, ол кезде жапырақтар фитогармон түзілу орталығы және өсімдік ағзасының басқа мүшелеріне оның доноры болып табылады. Жоғарыда айтып өткендей гибберелиндер кең көлемде өсімдік клеткаларының физиологиялық процестеріне: гүлденуіне, жақсы жеміс беруіне, фотосинтезге, сабақ пен тамырдың ұзарып өсуіне және басқа үрдістерге әсерін тигізеді.
1. 3. α-амилазаның функциясы мен құрылысы
Қазіргі кезде ″амилаза″ терминімен көмірсулар метоболизмінде басты рөл атқаратын глюкоген, крахмал және басқа да полисахаридтерді ыдырату қабілеті ие ферменттер тобын айтады [53; 54] .
Амилолитикалық топ негізінен екі түрлі ферменттерден тұрады: эндо амилаза және экзо амилаза. Эндоамилазалар тобына α-амилаза жатады, ал экзо амилазаларды β-амилаза және γ-амилаза ферменттері құрайды.
Өсімдік клеткаларында полисахаридтердің пайдаланылуы бірнеше биохимиялық этаптардан тұрады: эндо амилазалар күрделі полимер тізбектерінің ішкі молекулалық байланыстарын үзіп, ерігіш өнімдердің пайда болуын қамтамасыз етеді [55] . Бұл процестегі α-амилазаның (1, 4-глюкон-4-гликогидролаза) алатын орны зор. Аталмыш фермент интакті полисахаридтердің ыдырауын жүзеге асырады [56] .
α-амилазалар қазіргі кездегі классификация бойынша гидролаза класына, гликозидаза подкласына жатады. Фермент әсері төрт немесе одан да көп Д-глюкозадан құралған полисахаридтердің СО-С байланысына бағытталған және 1, 4 α-глюкозидтік байланыстың эндогидролизін қамтамасыз етеді. α-амилаза әсерінен пайда болған декстриндерді β және γ амилаза, декстриназа ферменттері қарапайым қанттарға дейін ыдыратады [57] . α-амилаза ферменттерінің астық тұқымдастарының өнуінде маңызды рөлі дәлелденген. α-амилазасы жоқ дәндер өніп-өсу қабілетінен де жұрдай болады [58] .
Ғылыми әдебиеттердің деректері бойынша өсімдік α-амилаза ферменті жануар және саңырауқұлақтар α-амилазасы сияқты гликопротеин болып табылады, яғни көмірсутекті компоненттері болады [59; 60] .
Молекулалық структурасы жағынан жақсы зерттелген Aspergillus oryzat α-амилазасы (ТАКА-амилаза А) болып табылады. ТАКА-амилаза А ферментін гидролиздеу нәтижесінде гликопротеид молекуласы бөлініп алынған [61] . Динитрофенил, гидразин және периодатты тотықтыру тәжірибелері ферменттің көмірсутекті бөлігінің белок молекуласымен аспарагин амин қышқылы арқылы амидті байланыспен қосылғанын көрсетеді. N- соңы және С- соңы амин қышқылдарын анықтау үшін әртүрлі әдістер қолданылды: N-соңғы амин қышқылдары үшін динитробензол дансилхлорид, ал С-соңғы аминқышқылдары үшін карбоксипептидаза қолданылды. Осы тәжірибелер нәтижесінде ферменттің N-соңында H 2 N-ала-гли-асп-глу-сер-ала-лей-тир- . . . , ал С-соңында серин аминқышқылдары болатыны анықталды [61; 62] . Сонымен қатар оның олигосахаридті өзегі: Aln-[x] -Сер/тир үш пептидтік тізбегінен байланысатыны және көмірсутекті тобының гетерогенділігі дәлелденді [63; 64] . Көмірсутекті бөлігінің қызметі оның фермент каталитикалық активтілігіндегі маңызы туралы деректер жоқ.
α-амилаза изоферменттерінің клондалған кДНҚ-лы және арпа алейрон клеткаларының ДНҚ фрагменттерінің нуклеотидтік тізбегін анықтау жұмыстары аталмыш ферменттердің аминқышқылдық тізбегін толық талдауға мүмкіндік берді [65] . Бұл зерттеу жұмыстарының нәтижесінде α-амилазаның аспарагин және глутамин амин қышқылдарына бай біртізбекті белок екені анықталды. Сонымен қатар, асп-гли-сер-пептидтік тізбегінің ферменттің сигналды бөлігінде ғана болатынын және оның функциональды активті изоэлектрлік нүктесі жоғары фермент түрінде кездесетіні анықталды. Осы деректерге сүйене отырып, авторлар изоэлектрлік нүктесінің жоғарғы мәнді α -амилаза глюкопротеин екендігі туралы болжам жасады. Сонымен қатар, арпа дәніндегі α-амилаза полипептидінде N-ацетилглюзамин глюкоза және манноза 0, 5 моль/л мөлшерде болатыны анықталды [66] . Күріш дәнінің қалқан тканін зерттеу барысында пісіп-жетілген α-амилаза молекулаларының барлығының табиғаты гликопротеидті екені анықталған [67; 68] .
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz