Диатомит тасымалдағышты палладий нанокатализаторларын әзірлеу және өсімдік майларын селективті гидрлеу


Мазмұны
КІРІСПЕ . . .
1. Әдеби шолу
1. 1. Диатомит
1. 1. 1. Диатомиттің физика-химиялық қасиеттері
1. 2. Гидрогенизация қатты тағамдық майларды алу әдісі ретінде
1. 3. Гидрогенизация процесінің физикалық сатылары
1. 4. Гидрогенизация сатысының химиялық сатылары
1. 4. 1. Гидрлеу процесінің жылдамдығы
1. 4. 2. Катализаторлық улар
1. 4. 3. Катализатордың меншікті бетінің реакция жылдамдығына әсері
1. 5. Қанықпаған май қышқылдарын селективті гидрлеу
1. 5. 1. Селективтілікке әсер ететін факторлар
1. 5. 2. Қанықпаған май қышқылдарының изомеризациясы
1. 5. 3. Гидрлеу кезіндегі жанама реакциялар
1. 6. Майды гидрлеу катализаторлары
1. 6. 1. Өндірісітк гетерогенді гидрлеу катализаторлары
2. Тәжірибелік бөлім
2. 1. Жоғары қысымды каталитикалық қондырғы
2. 1. 1. Гидрленетін зат
2. 1. 2. PRICAT никель катализаторы
2. 1. 3. Жасалған палладий катализаторы
2. 2. Зерттеу әдістері
2. 2. 1. Соя майын гидрлеу
2. 2. 2. Алынған үлгілердің негізгі физико-химиялық көрсеткіштерін анықтау
3. Нәтижелер және талдау
4. Қорытынды
Кіріспе
Қазіргі кезде Қазақстанда гидрлеу процестерінде шетелдік катализарлар қолданылады, осыған байланысты маңызды мәселелердің бірі жоғары талғампазды және белсенді, сонымен қатар өзіндік құны төмен отандық катализатор өндіру болып табылады. Қазіргі таңда өсімдік майларын гидрлеу ауқымды өндіріс салаларының бірі. Осы күнге дейін отандық өндірушілер шетелдік катализаторларды осы өндірісте қолданып келеді. Отандық өнімнің өзіндік құнын төмендету мақсатында отандық шикізат - диатомитті катализатор тасымалдағыш ретінде қолдану арқылы майларды гидрлеудің жаңа катализаторын жасау.
Қазіргі таңда маргарин және аспаздық майларды алу мақсатында жоғары температурада (180-230 о С) пирофорлы никель катализаторында гидрлеуді жүргізеді. Осындай жағдайда никель майдың компоненттерімен әсерлесуі мүмкін, нәтижесінде май ерігіш тұздар түзіледі де, түзілген тұзды тағам өніміне жіберуі мүмкін. Никель катализаторы арқылы алынатын өнімдер МСТ талаптарына физика-химиялық көрсеткіштері бойынша толықтай сай келмейді: қаттылығы төмен, қаныққан қышқылдардың мөлшері және балқу температурасы жоғары.
Төмен температурада (70-150 о С) гидрлеу процесін жүргізуге мүмкіндік беретін жоғары селективті наноқұрылымды палладий катализаторын жасақтау жоғарыда аталып өткен кемшіліктерді жоюға септігін тигізеді, ең басты түрде экологиялық таза тағам өнімдерін алуға жол ашады.
Жұмыстың мақсаты: диатомиттің физика-химиялық және текстуралық қасиеттерін зерттеу негізінде каталитикалық жүйелер жасау.
Ғылыми жаңалығы мен теориялық маңызы: диатомит модификацияға оңай ұшырайтыны және каталитикалық жүйелерді жасау үшін жақсы негіз болатыны анықталдым:
- гидрогенизация және изомеризация реакцияларын, алкандар мен циклоалкандардың тотығуна бағытталған реакциясын жүргізу үшін.
Пайдаланылған әдебиеттер: Қазақстандық, Ресейлік және шет ел зерттеушілерінің оқулықтарындағы мәліметтер, ғылыми - әдістемелік мақалалармен интернет сайттары кіреді.
1 Әдеби шолу
1. 1 Диатомит
Диатомит тұну нәтижесінен пайда болған жеңіл, жер және бос жыныс, негізінен екі атомды балдыр қаңқаларының қалдықтарынан қалыптасады: диатомеи және радиолярии. Диатомит микроскопиялық екіатомды балдыр, олардың өлшемдері 0, 75-тен 1500 мкм-ге дейін ауытқиды, кейде бұл жынысты инфузорлық жер немесе тау ұны деп те атайды. Кремнеземнің кремнийлі қаңқасының негізгі компоненттерін судың әртүрлі дәрежедегі мөлшері (опалдар) SiО 2 _ nH 2 О құрайды. Диатомит үшіншілік және төртіншілік кезеңдегі тау жыныстарының кремнийлі, тұнбалы жыныстарынан пайда болған, негізінен балдырға қатысты екіатомды, бір жасушалы су өсімдіктерінің тасқа айналған қалдығын құрайды.
Диатомиттер (немесе кизельгур) екі атомды балдырлардың пайдалы қазбаларының кен орындары болып табылады, дегенмен мұндай өндірістер миоценнен бастап, жас модеміне қарай салыстырмалы түрде шектеулі болып келеді. Ескі кен орындар тектоникалық процестер салдарынан зардап шекті, нәтижесінде пайдалы қазбалардың кристалдық фазасы мен құрылымынң өзгерісіне алып келді.
Диатомит табиғи материал, теңіз немесе көлде өскен екіатомды балдыр қалдықтарынан түзіледі. Диатомит өнімінің қолданыс аясы өте кең, мысалы: бекіту, қаттылықты арттыру, органикалық қатты заттарды беріктендіру, қатты беттер арасындағы адгезияны төмендету, тұтқырлықты арттыру, гидрофобты эффекті, абсорбент және катализатор [4] .
Диатомит (SiО 2 _ nH 2 О) немесе екіатомды жердің түсі жұмсақ, бозаң болып келеді, негізінен бір жасушалы балдырлардың сулы кремнеземінен тұрады. Диатомит екіатомды балдырлардың кең аумақтағы пішіні мен өлшемін қамтиды, құрамында 10-200 цт, 80-90% дейінгі мөлшерде бостықты құрайды [9] . Диатомиттің құрылысы өте кеуекті, тығыздығы төмен және беттік ауданы үлкен. Өндірісте диатомитті әртүрлі сусындарды, бейорганикалық және органикалық заттарды тазалау үшін фильтрат және мұнай өндірісінде адсорбент ретінде қолданады. Дегенмен, диатомит айрықша химиялық және физикалық қасиетке ие және оны ағызынды суларды тазарту үшін адсорбент ретінде қолдану саласы толығымен зерттелмеген [10, 11] .
1. 1. 1 Диатомиттің физика-химиялық қасиеттері
Табиғи диатомит минералының текстуралық, құрылымдық және химиялық қасиеттері 110-нан 500ºС-қа дейінгі күйдіру температурасына тәуелді. Бұл тәуелділіктер химиялық анализ, термогравиметриялық анализ, сынап арқылы кеуекті өлшеу, БЭТ әдісі арқылы меншікті бетті өлшеу, шынайы тығыздықты өлшеу, рентген фазалы анализ және сканирлеуші микроскопия әдістерін пайдалану арқылы анықталды.
Химиялық құрамы
Бастапқы диатомиттің химиялық құрамын индукциялық плазмамен байланысқан атомды-эмиссиялық спектроскоп OPTIMA-4300D (Perkin Elman) құрылғысында анықтадық.
Ауада кептірілген диатомит үлгісінің, мәлеметтер бойынша, құрамы:
SiO 2 - 60-70 %;
Al 2 O 3 - 9, 0 %;
TiO 2 - 0, 72%;
Fe 2 O 3 - 0, 33%;
CaO - 0, 42%;
MgO - 0, 96%;
Na 2 O - 0, 89%;
K 2 O - 1, 07%;
P - < 0, 01%;
S - 0, 09%;
Қалғаны Н 2 О
Текстуралық қасиеттері
Диатомит үлгілерін 110-500ºС температурада қыздырып, кешенді фихика-химиялық әдістер көмегімен текстуралық қасиеттері анықталды. Үлгінің меншікті бетін (S менш , м 2 /г) шартты цилиндрлік кеуектерді (БЭТ әдісі) қолдану арқылы, азоттың жылулық десорбциясы әдісі көмегімен анықтады. Кеуектердің қосынды көлемі (VΣ, см 3 /г) мен кеуектердің өлшем бойынша таралуы сынап арқылы кеуекті өлшеуAutoPore IV 9500 құрылғысында зерттелді. Кеуектердің көлемін үлгінің қаныққан тамшы жұтуы мөлшері бойынша (ылғал сиымдылық) қосымша әдісі қолданылды. Шынайы тығыздықты (ρ шын ., г/см 3 ) (110 және 500ºС үлгілері үшін) Автопикнометр-1320 құрылғыснда, камераны He толтыру арқылы анықтады.
Үлгінің кеуектілігін (ε, %) (110 және 500ºС үлгілері үшін) келесі формула көмегімен анықтады:
VΣ·ρ шын ·100/( VΣ·ρ шын +1) .
1. 2 Гидрогенизация қатты тағамдық майларды алу әдісі ретінде
Органикалық заттардың қатты дене қатысындағы жүйелік зерттеулерінің бастамасын XIX-XX ғғ П. Сабатье (1897 ж. ) және В. Н. Ипатьев (1900 ж. ) бастаған болатын. Қаныққан май қышқылдары мен сутегі буларын никель арқылы өткізіп, тасымалдауышта отырғызып, П. Сабатье ең алғаш рет гидрлеу әдісі арқылы стеарин қышқылын алған болатын. Ал В. Н. Ипатьев әртүрлі гетерогенді катализаторлар қатысында температура мен сутек қысымының химиялық ауысулар бағыты мен жылдамдығына әсерін ең алғашқы болып байқады және зерттеді.
Осы уақытта сабын, шам және технологиялық майлағыштар өндірісінде қатты, жоғары температурада балқитын майлар мен май қышқылдарына деген сұраныс айтарлықтай жоғары болды.
XIX ғ соңында маргарин мен аспаздық май өндірісі дами бастады, мұнда май негізін сұйық өсімдік майлары мен кокос, пальма және тез балқитын жануар майларының фракциясы қоспалары құрады. Осы секілді таптырмайтын «қатты» майларды алмастыру үшін ерекше қасиеттері бар гидрленген майларды алу талап етілді.
1901-ден 1903 ж аралығында В. Норман егер, сутекті диспергірлеп және жұқа ұсақталған катализаторды суспензияласа май қышқылдары мен майларды гидрлеуді сұйық фазада да жүзеге асыруға болатындығын анықтады. Осы жаңалық арқасында майларды гидрлеудің өндірістік негізі қаланды. Бірінші дүние жүзілік соғыс басында көптеген елдерде сұйық және жануар майларынан гидрленген (қатқан) майларды өндіру өндірістері бар болатын [1] .
Әдетте, балқу температарсы мен химиялық тұрақтылығын арттыру үшін әртүрлі өсімдік және жануар майларының қанығу дәрежесін төмендеткен дұрыс. Мысалы, сабынды алу үшін синтетикалық каучук өндірісінде, бутидиен мен стиролдың сополимеризациясы кезінде эмульгатор ретінде алдын ала гидрлеу арқылы қатайған жұмсақ майларды қолданады [3] .
Гидрлеу процесінің маңызы - өсімдік және жануар майларының майқышқылды құрамын мақсатты түрде қаныққан май қышқылдарына (глицеридтердің ацильді топтары) сутегін қосу және катализатор қатысында әртүрлі химиялық ауысуларды жүзеге асыру арқылы өзгерту болып табылады.
Майқышқылды құрамының өзгеруі өсімдік және жануар майларының глицеридті құрамы мен қасиеттерінің өзгеруіне алып келеді: тотықтығу және термиялық әсерге деген тұрақтылығы артады, балқу температурасы, иілгіштігі мен қаттылығы.
Гидрлеуге соя, күнбағыс, мақта, рапс, жержаңғақ, қыша және т. б. кейбір сұйық өсімдік майларын, жартылай қатты консистенцияға ие пальма, пальма ядролы және кокос майларын, еріген тағамдық жануар майларын, техникалық жануар майларын және техникалық малардан бөлініп алынған бос май қышқылдарын ұшыратады [1] .
Мақта, соя және басқа да өсімдік майларын қатты жануар майларына ұқсату үшін гидрлеуге ұшыратады, алынған өнімнен маргарин, аспаздық майлар мен сабын алу үшін пайдалануға болады. Гидрлеуге болатын өсімдік және жануар майларын алдымен рафинирлеу мен ағарту процесіне ұшыратады [2] .
Гидрленген өсімдік және жануар майларының маңызы қолданылу саласының бірі - маргарин өнімдерінің өндірісі болып табылады [6] .
Майларды (және май қышқылдарын) гидрогенизациялау реакциясына үш негізгі компонент қатысады: сұйық (балқыған) майлар, газ тәрізді сутегі мен майларда ерімейтін қатты катализатор. Химиялық реакция жүру барысында сурегі майда дайын еріген күйде болады, осындай жағдайда катализатор бастапқы агрегаттық күйін сақтап қалады. Осылайша, гидрогенизация процесі сұйық - қатты дене жүйесінде өтеді, мұнда сұйықтық - сутегінің майда еріген қоспасы, ал қатты дене, жоғарыда айтылып өткендей, - катализатор болып табылады. Әртүрлі агрегаттық күйде өтетін процесті гетерогенді деп атайды. Сәйкесінше, майлардың қаты катализатордағы гидрогенизациясы сұйық фазалы гетерогенді каталитикалық процес болып табылады [5] .
Гидрлеудің тереңдігі мен параллельді реакциялардың өтуі қанықпаған май қышқылдарын бастапқы шикізаттың химиялық құрамы мен өнімнің гидрленуіне байланысты өлшенеді.
Жануар және өсімдік майларын жартылай (селективті) гидрлеу арқылы балқу теспературасы 31-34 °С, қаттылығы 160-320 г/см және ион саны 62-82 болатын, маргарин және аспаздық майлардың негізгі (құрылым түзгіш) компоненттері ретінде қолдануға болатын иілгіш майларды алады [1] .
Майды гидрогенизациялауды жоғары дәрежедегі селективтілікпен жүргізуге тырысады, себебі стеарин қышқылының көп мөлшері майдың адам ағзасында қорытылуын нашарлатады және оның сапасын төмендетеді [17, 18] .
Жануар және өсімдік майларын қаныққан шексіз сутек байланыстарымен гидрогенизациялағанда кеңістіктік, жақтық және құрылымдық изомерленуі жүреді. Түзілген изомерлер бастапқы майлардан физика-химиялық қасиеттерімен ерекшеленеді. Мысалы, цис-цис -линоль қышқылы физиологиялық активті, ал оның кеңістіктік транс-транс-конфигурация изомері ондай активтілік қасиетке ие емес [19] . Цис-транс -формасының активтілі төмен. Бұл құбылыстың механизмі келесідей, транс-транс -линоль қышқылы ағзада арахидон қышқылына айналмайды. Полиқаныққан май қышқылдарының физиологиялық қасиеті - линоль, арахидон - айналым процесін амтамасыз ететін жасушаның жол ашар немесе липидті құрылымы емес, сонымен қоса арахидон қышқылының циклді пероксидтерін синтездеуші материал, адам тіршілік процесін реттеуші материал болып табылады [20] .
1. 3 Гидрогенизация процесінің физикалық сатылары
Жоғарыда айтылып өткендей, шексіз қосылыстарды катализатода қанықтыру гетерогенді процесс болып табылады, мұнде негізгі химиялық процесс катализатор бетінде өтеді. Сондықтан, химиялық ауысулар өтуі үшін гидрленетін майлар мен сутектің катализатор бетімен жанасуы керек.
Егер реакторда қозғалмайтын катализатор беті, оның үстінде гидрленетін сұйықтық қабаты, ал ол қабаттың үстінде - газ тәрізді сутек қабаты болатын болса, онда алдымен газ тәрізді сутек молекуласы бөлуші шекара арқылы сұйық фазаға өтеді (газ - сұйықтық бөлу беті) . Осыған сәйкес, процестің бірінші физикалық сатысы - сутектің сұйықтық қабаты бетінде еруі болып табылады.
Келесі физикалық саты - еріген сутек молекуласының сұйық фаза көлеміндегі диффузиясы болып табылады.
Кез келген ерітіндіде заттың молекуласы үздіксіз және хаосты қозғалыста болады, оның жылдамдығы ерітіндінің өлшемдері мен температурасы, табиғатына байланысты болады. Қаншалықты температура жоғары болса, соншалықты молекула өлшемі соншалықты кіші болады, сонымен қоса молекуланың ерітіндідегі қозғалысы соншалықты жоғары жылдамдықпен өтеді. Осындай құбылыс газ фазасында да байқалады.
Жеке молекулалардың қозғалысы нәтижесінде ерітіндінің кез келген бөлігінде концентрацияның теңесуі байқалады, дәлірек айтқанда берілген молекуланың жоғары концентрациядан төмен концентрацияға өтуінің мақсатты ауысуы жүреді. Берілген заттың осындай мақсатты ауысуы (мысалы, еріген сутегі) молекулалық диффузия деп аталады.
Газ -сұйықтың бөлу шекарасында сутегі ерітндісі сұйықтықта жылдам қанығады, дәлірек айтқанда концентрация шартының мүмкін болатын максималды мәніне жетеді. Сұйықтық қабатының терең қабатын сутегі алдымен мүлдем болмайды. Сондықтан сутегі молекуласы сұйықтық қабатының бетін оның көлеміне диффузиялайды да, сұйықтық - қатты дене (катализатор) бөлу шекарасына дейін жетеді.
Үшінші физикалық саты - сутектің сұйық фазадан өтіп, катализатор бетіне диффузиялануы.
Сутегімен қатар катализатор бетіне гидрленетін заттың молекуласы да диффузияланады, гидрогенизация кезінде бұл молекулалардың концентрациясы катализатор бетіне беріледі және заттардың диффузиялық алмасуының қозғаушы күші пайда болады - сұйықтық фазасы көлемінің және катализатор бетіндегі концентрацияның әртүрлігі.
Осылайша, гидрогенизацияны жүргізу үшін келесі физикалық сатылардың өтуі қажет:
- сутегінің газ - сұйықтық шекарасында еруі;
- еріген сутегінің газ - сұйықтық бөлу шекарасында диффузиялануы;
- еріген сутегі мен май молекулаларының сұйық фаза көлемінен сұйықтық - катализатор бөлу шекарасы бетінде диффузиялануы;
- гидрленген молекулалардың катализатор бетінен сұйық фаза көлеміне ауысуы.
Реагенттердің катализатор бетіне және реакция өнімдерінің катализатор бетінен диффузиялану секілді физикалық сатыларды массаалмасу сатысы деп аталады.
Жоғары температурда сұйықтықтағы молекулалық диффузия айтарлықтай жай жүреді, сондықтан молекулалық диффузияның массаламасуы да жай өтеді. Реагенттердің катализаторға деген қозғалысын және реакция өнімін тездету үшін механикалық араластыру және сутегінің сұйықтықта барботажын жүргізеді.
Араластырғыш арқылы араластыру ұнтақ тәрізді катализатордың сүйықтық фазасында бірқалыпты таралуына мүмкіндік береді. Соның арқасында, біріншідіен, әрбір катализатор бөлшегінің сұйықтық қабатындағы қалыңдығы азаяды, екіншіден, қол жетімді катализатор беті артады, себебі жоғарғы қабаты төменгі қабатымен ұштаспайды, үшіншіден, сұйықтықты өзіне қатысты араластырғанда заттың сұйықтықтағы концентрациясының теңесуі жылдам жүреді, төртіншіден, қарапайым араластырғыш конструкциямен де араластыру жүргізген кезде газ және сұйытық фазасының бөлу шекарасының беті артады [5] .
1. 4 Гидрогенизация сатысының химиялық сатылары
Майдың гидрлеу процесі сутегі мен катализатор қатысындағы бірнеше химиялық реакциялардың жиынтығы болып табылады:
- сутектің қанықпаған этиленді қышқылдарына қосылуы, нақтырақ айтқанда гидрлеу:
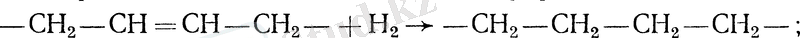
- қанықпаған қышқылдардың жақтық изомерлерінің түзілуі (этиленді байланыстың көміртекті тізбекті молекланы бойлай көшуі) :

- қанықпаған қышқылдардың геометриялық изомерлерінің түзілуі (цис-транс-изомерия) :
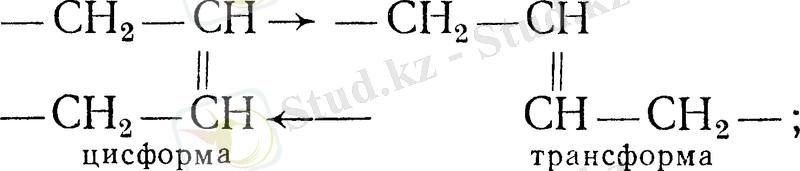
- май қышқылдарының триглициридте қайта құрылуы (переэтерификация) .
Бұл реакциялардың сипаттамасы мен қарқындылығын гидоленген майлардың қасиеті мен глтцеридті құрамы анықтайды [1] .
Гидрогенизация процесінің басымдылығы жоғары алғашқы үш реакция болып табылады [4] .
1. 4. 1 Гидрлеу процесінің жылдамдығы
Химиялық реакцияның жылдамдығы - бірлік реакциялық кеңістікте бірлік уақыт ішінде әсерлесетін бастапқы заттардың біреуінің мөлшерінің өзгеруін айтады [9] .
Көлем бірлігіндегі заттың мөлшері заттың концентрациясы, олай болса химиялық реакцияның жылдамдығы - бірлік уақыттағы әрбір әсерлесуші заттардың (немесе реакция өнімінің) концентрациясының өзгерісі болып табылады. Гидрлеудің жылдамдығын келесі формула бойынша анықтауға болады:
V г = - (С с - С б ) /( t а - t б ),
Мұндағы, С с - гидрлеу қосылысының соңғы концентрациясы, С б - гидрлеу қосылысының бастапқы концентрациясы, t а - реакцияның аяқталу уақыты, t б - реакцияның басталу уақыты.
Соңғы концентрация әрқашан да бастапқы концентрациядан төмен болғандықтан, гидрлеу жылдамдығының оң мәнін алу үшін формула алдына «минус» таңбасын қоямыз.
Заттың өзінің концентрациясының орнына гидрленетін топтардың концентрациясын пайдалануға болады, мысалы, қанықпаған - СН = СН - байланысын гидрлеу жағдайында. Май немесе май қышқылдарының қанықпаған байланыстарында концентрация мәнін осы заттардың иод саны арқылы көрсетеді.
1. 4. 2 Катализаторлық улар
Катализатордағы негізгі раекцияға қатысушылардан адсорбциялық беріктілігі жоғары заттарды каталитикалық улар деп атайды, себебі олар жүйедегі басты мақсатты компоненттердің активтенуіне кедергі жасайды, катализаторды улайды [5] .
Гетереогенді катализаторлардың улануы удың немесе химиялық айналулар өнімінің катализатор бетінде адсорбциясы кезінде туындайды. Улану қайтымды және қайтымсыз болуы мүмкін [10] .
Майдағы барлық табиғи бояғыштар гидронизация катализаторының улары болып табылады. Олар катализаторда берік адсорбцияланады да және оның бетін қоршап тастайды, нәтижесінде глицеридтің шексіз қышқылдарының катализатор бетінде адсорбциялануын тежейді. Кейбір заттар катализаторда гидрленеді немесе ыдырайды, содан кейін катализатор глицеридтерді хемосорбциялау қасиетін қалпына келтіреді.
Катализаторлық уларға: гидоргенизация процесі кезінде бұзылатын каротиноидтар; госсипол және оның фосфаттар, майлы қышқылдар, сабын және күкірт қосылыстары. Госсипол және оның туындылары катализаторды кайтымсыз улайды. Бос майлы қышқылдар және оның сабындары катализатор металымен әрекеттеседі де, берік никельді (немесе мысты) сабын беттік қабықшасын түзеді, олар катализатордың активті орталықтарын қоршайды.
1. 4. 3 Катализатордың меншікті бетінің реакция жылдамдығына әсері
Жоғарыда гидрогенизация реакциясы катализатор бетінде жүретіндігі айтылып өткен болатын. Онда адсорбцияланған молекула мен атом бетінде қозғала алады. Активтелген атомдар мен молекулалардың соқтығысуы нәтижесінде химиялық реакциялар жүреді. Сондықтан, катализаторда адсорбцияланған молекулалардың концентрациясы жоғары болған сайын, олардың соқтығысуы ықтималдығы жоғары болады, соқытығысу қаншалықты жоғары болса, соншалықты реакция жылдамдығы жоғары болады. Екінші жағынан, катализатор беті үлкен болған сайын, адсорбцияланатын заттар соншалықты көп болады және соншалыұты мөлшерде заттар өзара реакцияласады [5] .
Каталитикалық процестер катализатордың тек қана жекелеген аймақтарында - активті орталықтарында жүреді. Гомогенді катализ жағдайы секілді активті орталықтарда аралық (беттік) қосылыстар түзіледі. Сондықтан катализатор бетінің күйі маңызды рөл атқарады. Катализато активтілігі жоғары болған сайын, оның меншікті бетті соншалық үлкен және кристал құрылымында соншалықты ақаулар көп болады [8] .
Сәйкесінше, гетерогенді каталитикалық раекцияның жылдамдығы катализатор бетінің өлшеміне және онда реакцияласатын заттардың концентрациясына тәуелді. Сондықтан, меншікті беті үлкен болатын катализаторды жасақтауға және қолдануға ұмтылады. Мысалы, кизельгурда тұндырылған өндірісітк никель катализаторында меншікті бет шамамен 1 г никельге 100 м 2 құрайды. Меншікті беті одан да үлкен катализаторлар да бар.
Процестің кез келген сәтіндегі гидрогенизация жылдамдығын теориялық тұрғыда келесі формуламен анықтауға болады:
V м = аП м С к С с С м ,
мұндағы, а - пропорционалдық коэффициенті, П м - катализатордың меншікті беті, С к - гидрленетін майдағы катализатор концентрациясы, С с - катализатор бетіндегі сутегі концентрациясы, С м - катализатор бетіндегі май концентрациясы.
Сұйық фазада еріген, газ фазасындағы белгілі қысымдағы сутегінің мөлшері елеулі әсер етеді. Екінші жағынан, катализаторда адсорбцияланған сутегінің мөлшері сұйық фазадағы концентрациясына тәуелді болып келеді, сутегі қысымы төмен айтақтарда берілген тәуелділік қарама-қарсы сипатқа ие болып келеді.
Өндірістік процесс шарты кезінде катализатор бетінде гидрленетін заттардың концентрациясы мен сұйық фазаның көлемі пропорционалдық сипатқа ие. Сәйкесінше, катализатор бетінде гидрленетін заттардың концентрациясын йод санына алмастыруға болады.
Кейбір жағдайларда гидрогенизация жылдамдығы сутегі қысымының және катализатор концентрациясының артуымен өседі, бірақ йод санының төмендеуімен гидрогенизация жылдамдығы төмендейді. Сонымен қоса, гидрогенизация жылдамдығы температура жоғарылауымен де артады.
Егер процестің физикалық және химиялық сатыларын қарастыратын болсақ, барлық сатының жылдамдықтары өзара байланысты екенін көруге болады. Егер таңдалған жағдайларда катализаторда гидрогенизация жылдамдығы өте жоғары, ал сутегінің газ көпіршіктеріндегі диффузия жылдамдығы төмен болатын болса, онда катализаторда адсорбцияланатын сутегі күрт төмендейді және сәйкесінше гидрогенизация жылдамдығы да төмендейді. Гидрогенизация жылдамдығы бірлік уақытта катализатор бетінде реакцияласатын сутегі мөлшері сол уақыт аралығында катализаторға келіп түсетін газ фазасындағы сутегі мөлшерімен теңескенге дейін төмендей береді.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz