Жалпы химияның зертханалық жұмыстары: оқу-әдістемелік нұсқаулық


Мазмұны
- Кіріспе 4
- Қауіпсіздік техника ережелері 4
- Жұмысты орындау және есеп беру реті 5
- Зертханалық жұмыстардың мазмұны 6
№1 зертханалық жұмыс. Бейорганикалық қосылыстардың
негізгі кластары 6
№ 2 зертханалық жұмыс. Химиялық кинетика және химиялық
тепе-теңдік 10
№ 3 зертханалық жұмыс. Ерітінділердің қасиеттері 15
№ 4 зертханалық жұмыс. Электролиттік диссоциация 18
№ 5 зертханалық жұмыс. Металдар коррозиясы 22
№ 6 зертханалық жұмыс. Көмірсутектер. Алкандар және
алкендер 27
№ 7 зертханалық жұмыс. Спирттер. Бір және көп атомды
спирттер 32
№ 8 зертханалық жұмыс. Карбон қышқылдары. Бір негізді карбон
қышқылдары 37
- Әдебиеттер тізімі 40
- Қосымшалар 42
КІРІСПЕ
Химия пәні - жаратылыстану ғылымын құрайтын жүйенің маңызды бір бөлігі. Басқа жаратылыстану ғылымдары сияқты, ол тек табиғатты зерттеп қана қоймайды, сонымен бірге студенттерді тәжирибелік іс-әрекетке үйретіп, өз елінің материалдық дамуының ғылыми негіздерімен де таныстырады.
Барлық мамандық студенттеріне арналған бұл құралда химия курсын меңгеруге арналған оқу жоспарының ерекшеліктері есепке алынған.
1 Қауіпсіздік техника ережелері
1. 1 Реактивтерді пайдалану ережелері
1. 1. 1 Ерітінділер мен құрғақ реактивтерді пластмасса немесе шыны ыдыстарда сақтау керек.
1. 1. 2 Егер реактивтің мөлшері көрсетілмесе, онда оны аз мөлшерде алу керек.
1. 1. 3 Реактивтің артығын сол реактив сақталған ыдысқа қайтадан құюға болмайды.
1. 1. 4 Реактивті пайдаланып болған соң ыдыстың аузын жауып, орнына қойып қою керек.
1. 1. 5 Құрғақ реактивті арнайы шпательмен алып, пайдаланып болған соң оны сүртіп қою керек.
1. 1. 6 Егер реактив сұйық болса, онда оны таза пипеткамен алу керек.
1. 1. 7 Реактивтің дәмін көруге болмайды.
1. 2 Химиялық зертханада жұмыс жасаған кездегі қауіпсіздік техникасы ережесі
1. 2. 1 Зертханалық жұмыстарды opындaғaндa оқытушы берген нұсқауларды қатал caқтay керек.
1. 2. 2 Тұтанғыш, жанғыш заттармен жұмыс iстегенде, оларды от көзiнен алыс ұстау керек.
1. 2. 3 Сұйық және қатты заттар салынған сынауықтардың аузын өзiңе немесе жанында тұpғaн жолдасыңа қаратып қыздырмау керек.
1. 2. 4 Ыстық заттарды қысқышпен ұстау керек.
1. 2. 5 Уландырғыш және иiсi бар заттармен жұмысты тартпа шкафтарда жасау керек.
1. 2. 6 Концентрленген кышқылдар және сiлтiлермен жұмыс iстеген кезде ұқыпты және өте сақ болу керек. Концентрлi қышқылдарды сұйылтқанда, әрқашан суға қышқылды бiртiндеп кұю керек, керiсiнше жасауға болмайды.
1. 2. 7 Тәжiрибе жасап жатқан кезде зертханада орынсыз қозғалыс жасау, тамақ жеу, су iшу, тeмекi шегу және сырт киiммен отыруға болмайды.
1. 2. 8 Зертханалық жұмыстарды бiтіргеннен кейiн әрбiр студенттің жұмыс орнын тазалап, пайдаланған ыдыстарды жуып, жауапты лаборантқа өткiзiп кeтyi керек.
1. 3 Жазатайым жағдайларда бiрiншi дәрiгерлiк жәрдем көрсету
1. 3. 1 Қышқылмен күйгенде, күйген жердi сумен көп қайтара жуып, 3 % ас содасының epiтiндiciмeн шайып, вазелин жағады.
1. 3. 2 Сiлтiлермен күйгенде, күйген жердi сумен көп қайтара жуып, бiр пайызды cipкe қышқылының ерітіндісімен шайып, вазелин жағады.
1. 3. 3 Отқа күйгенде глицерин немесе этил спиртiне батырылған таза мaқтaны пайдаланады. Аса қaтты күйгенде, калий перманганатының концентрлi ерiтiндiciн қолданады.
1. 3. 4 Егер уландырғыш заттар әcepiнeн тыныс органдары қабынып, адам улана бастаса, онда оны тез арада ауаға шығарып, дем алдыру керек.
2 Жұмысты орындау және есеп беру реті
2. 1 Жұмысты орындау реті
2. 1. 1 Алдымен оқулықтың жұмысты орындауға қажетті бөлімдерін, дәріс конспектілерін қарап, жұмыстың мазмұнымен танысу керек.
2. 1. 2 Жұмысты бастау алдында оған қажетті жабдықтардың бар жоғын тексеру керек.
2. 1. 3 Жұмыс кезінде осы нұсқауда көрсетілген операциялардың тәртібін және дәйектілігін сақтау керек.
2. 1. 4 Қауіпсіздіктің барлық шараларын сақтау, жанғыш затарды сақтықпен қолдану керек.
2. 1. 5 Тәжірибе барысын мұқият бақылау және оның барлық детальдарын байқау керек.
2. 1. 6 Жұмысты орындап болғаннан кейін жұмыс орнын ретке келтіру керек.
2. 2 Есеп беру реті
Тәжірибені орындау барысында бақылау нәтижелерін және өтіп жатқан реакциялардың теңдеулерін тәжірибені аяқтап болған соң дереу арнайы дәптерге жазу керек:
1. Жұмыстың мақсаты
2. Жұмысты жүргізу реті
3. Аспаптардың нұсқасы
4. Тәжирибенің нәтижелері мен қортындылар
5. Бақылау сұрақтарына жауаптар
3. Зертханалық жұмыстардың мазмұны
№ 1 зертханалық жұмыс
Бейорганикалық қосылыстардың негізгі кластары .
Жұмыстың мақсаты: бейорганикалық қосылыстарды жіктеу, олардың арасындағы генетикалық байланыс және құрамы мен қасиеттері жайлы алған білімді жинақтап тұжырымдау.
Құралдар мен реактивтер: зертханалық сынауықтар, газ шығаратын түтігі бар сынауықтар, мәрмәр, CaO, Zn (түйіршіктері), H 2 O (дистилденген), ерітінділер (0, 1 н) : HCl, Ca(OH) 2 , NaOH, H 2 SO 4 , CuSO 4 , ZnCl 2 , NaCl, Na 2 CO 3 , AlCl 3 , Na 2 SO 4 , BaCl 2 , фенолфталеин, метилоранж, әмбебап индикаторлық қағаз.
Жай заттар. Молекулалары бір элементтің атомдарынан тұрады. Химиялық реакцияларда басқа заттардың түзілуімен ыдырай алмайды.
Күрделі заттар (немесе химиялық қосылыстар) . Молекулалары әр түрлі элементтің атомдарынан тұрады. Химиялық реакцияларда бірнеше басқа заттардың түзілуімен ыдырайды.
Оксидтер (негіздік, қышқылдық, амфотерлік)
Негіздік оксидтер деп қышқылдар немесе қышқылдық оксидтермен әрекеттескенде тұздар түзетін оксидтерді атайды. Негіздік оксидтерге негіздер сәйкес келеді. Мысалы, СаО кальций оксидіне Са(ОН) 2 кальций гидроксиді сәйкес келеді.
Қышқылдық оксидтер деп негіздермен немесе негіздік оксидтермен әрекеттескенде тұздар түзетін оксидтерді атайды. Олар сумен әрекеттескенде қышқылдар түзіледі. Мысалы, көміртек (ІV) оксиді - СО 2 көмір қышқылын- Н 2 СО 3 , азот (V) оксиді - N 2 O 5 азот қышқылын -HNO 3 түзеді.
Қышқылдық оксидтер сәйкес қышқылдардан суды бөлу жолымен де алынуы мүмкін, сондықтан оларды қ ышқылдық ангидридтер деп те атайды.
Амфотерлі оксидтер деп қышқылдармен де, негіздермен де әрекеттескенде тұздар түзетін оксидтерді атайды. Амфотерлі оксидтерге ZnO, Al 2 O 3 , SnO, SnO 2 , PbO 2 , Cr 2 O 3 жатады.
Қышқылдар деп ерітіндіде диссоциацияланып, сутек иондарын түзе алатын заттар аталады. Қышқылдарға тән қасиеттер олардың негіздермен, негіздік және амфотерлі оксидтермен әрекеттесіп тұз түзе алулары. Мысалы:
2HNO 3 +Cu(OH) 2 =Cu(NO 3 ) 2 +2H 2 O
2HCl+CaO=CaCl 2 +H 2 O
H 2 SO 4 +ZnO=ZnSO 4 +H 2 O
Құрамында оттектің бар болуына байланысты қышқылдар оттекті (H 2 CO 3 , HNO 3 ) және оттексіз (HCl, HBr, H 2 S) болып бөлінеді. Қышқыл молекуласында металл атомдарымен алмаса алатын сутек атомдарының санына байланысты қышқылдар бір негізді (HCl, HNO 3 ), екі негізді (H 2 SO 3 , H 2 CO 3 ), үшнегізді (H 3 PO 4 ) және т. б болып бөлінеді.
Негіздер - ерітіндіде диссоциацияланып гидроксид-иондарын (ОН - ) түзе алатын заттар. Негіздер қышқылдармен, қышқылдық немесе амфотерлік оксидтермен әрекеттесіп, тұз түзе алады:
KOH+HCl=KCl+H 2 O
Ba(OH) 2 +CO 2 =BaCO 3 +H 2 O
2NaOH+Al 2 O 3 =2NaAlO 2 +H 2 O
Негізге қосыла алатын протондар (Н + ) санына байланысты негіздер бір қышқылды (LiOH, KOH, NH 4 OH), екі қышқылды (Ca(OH) 2 , Fe(OH) 2 ) және т. б болып бөлінеді.
Амфотерлі гидроксидтер - сулы ерітінділерде қышқылдармен де, негіздермен де әрекеттесе алады.
Zn(OH) 2 +2HCl=ZnCl 2 +2H 2 O
Zn(OH) 2 =H 2 ZnO 2
H 2 ZnO 2 +2NaOH=Na 2 ZnO 2 +2H 2 O
Амфотерлі гидроксидтерге Zn(OH) 2 , Al(OH) 3 , Pb(OH) 2 , Sn(OH) 2 , Cr(OH) 3 жатады.
Тұздар қышқыл молекуласындағы сутек атомдарының металл атомдарымен толық немесе жартылай алмасу нәтижесінде түзілетін өнімдер немесе металл гидроксиді молекуласындағы гидроксо топтардың қышқыл қалдықтарымен толық немесе жартылай алмасу нәтижесінде түзілетін өнімдер. Қышқыл молекуласындағы сутек атомы толық алмастырылса орта тұздар, ал жартылай алмастырылғанда қышқыл тұздар (гидротұздар) түзіледі. Қышқыл тұздар көп негізді қышқылдардан алынады.
Негіздер молекуласындағы гидроксотоптар қышқыл қалдықтарымен жартылай алмастырылғанда негіздік тұздар (гидроксотұздар) түзіледі. Мысалы:
Н 2 SO 4 +NaOH=NaHSO 4 +H 2 O
Fe(OH) 3 +H 2 SO 4 =FeOHSO 4 +2H 2 O
Жұмысты орындау реті
1 тәжірибе. Негіздік оксидтердің қасиеттерін зерттеу
Екі сынауыққа кальций оксидін салыңыз. Бірінші сынауыққа су, содан кейін фенолфталеиннің бір тамшысын тамызыңыз, ал екіншісіне тұз қышқылын құйыңыз. Реакция барысы қалай өтіп жатқанын белгілеп, химиялық реакция теңдеулерін жазыңыз. Бірінші сынауықта фенолфталеин неге қызылдау түске боялғанын түсіндіріңіз.
2 тәжірибе. Қышқылдық оксидтердің қасиеттерін зерттеу
Қышқылдық оксид алу үшін сынауыққа мәрмәрдің бірнеше кесегін салып, тұз қышқылын қосыңыз. Содан кейін сынауықты газ шығаратын түтігі бар тығынмен жауып, түтіктің ұшын дистилденген су құйылған сынауыққа салып біраз уақытқа қалдырыңыз, біраз уақыт өткен соң, түтікті кальций гидроксиді бар сынауыққа салыңыз. Не байқадыңыз?
Суы бар сынауықта реакцияның өткеніне көз жеткізу үшін оған әмбебап индикатор кағазын салыңыз, ал тағы бір қағазды басқа сынауыққа дистилденген су құйып, оған да индикатор қағазын салып, түстерін салыстырыңыз. Бақылағанқ ұбылыстарға түсініктеме беріңіз. Сәйкес химиялық реакция теңдеулерін жазыңыз.
3 тәжірибе. Сілтілер және қышқылдар ерітінділерінің ортасын
анықтау
Бір сынауыққа натрий гидроксидінің ерітіндісін, ал екіншісіне күкірт қышқылын құйып, әмбебап индикатор қағазының көмегімен ортасын анықтаңыз. Электролиттік диссоциация теңдеуін жазыңыз.
4 тәжірибе. Қышқылдардың қасиеттерін зерттеу
а) Сынауыққа күкірт қышқылының ерітіндісін құйып, әмбебап индикатор қағазының көмегімен ортасын анықтаңыз. Осы сынауыққа қышқылдың мөлшеріндей мөлшерде сілті ерітіндісін құйып, қайтадан ерітіндінің ортасын анықтаңыз. Неге әмбебап индикатор қағазы түсін өзгертті? Химиялық реакция теңдеуін жазыңыз.
б) Сынауыққа металл мырышының түйіршігін салып, күкірт қышқылының ерітіндісін құйыңыз. Не байқадыңыз? Химиялық реакция теңдеуін жазыңыз.
5 тәжірибе. Негіздерді алу және олардың қасиеттерін зерттеу
Сынауықтағы мыс сульфатының ерітіндісіне натрий гидроксидінің ерітіндісін тұнба пайда болғанша құйыңыз. Түзілген тұнбаны екіге бөліңіз. Бір бөлігіне натрий гидроксидінің ерітіндісін, екінші бөлігіне күкірт қышқылының ерітіндісін қосыңыз. Барлық қажетті реакция теңдеулерін жазыңыз және бұл реакция нәтижесінде пайда болған өзгерістерді белгілеңіз.
6 тәжірибе. Амфотерлік гидроксидті алу және қасиеттерін зерттеу
Амфотерлі гидроксид алу үшін мырыш хлориді тұзының ерітіндісіне натрий гидроксидін тамшылатып тұнба пайда болғанша құйыңыз. Алынған тұнбаны екі бөлікке бөліп, бір бөлігіне сілті, ал екінші бөлігіне қышқыл қосыңыз. Не байқадыңыз? Химиялық реакция теңдеулерін жазыңыз.
7 тәжірибе. Тұздардың металдармен әрекеттесуі
Сынауыққа мыс сульфатының ерітіндісін құйып, оған мырыш металының түйіршігін салыңыз. Не байқадыңыз. Химиялық реакция теңдеуін жазыңыз.
8 тәжірибе. Тұздардың бір-бірімен өзара әрекеттесуі
2 сынауыққа натрий сульфатының ерітіндісін құйыңыз. Біріншісіне натрий хлоридінің, ал екіншісіне барий хлоридінің ерітіндісін қосыңыз. Неге реакция тек 2-ші сынауықта ғана өтіп жатыр? Химиялық реакция теңдеуін жазыңыз.
Бақылау сұрақтары:
- Қандай оксидтер негіздік, қышқылдық және амфотерлік деп аталады?
- Негіздік, қышқылдық және амфотерлік оксидтерге қандай жалпы қасиеттер тән?
- Қандай заттар негіздер, қышқылдар деп аталады?
- Қандай химиялық реакция бейтараптану реакциясы деп аталады?
- Кальций және мыс сұйылтылған күкірт қышқылымен қалай әрекеттеседі?
- Kелесі тұздардың диссоциация теңдеулерін жазыңыз: K2SO4, KHSO4, Fe(OH) 2Cl, FeCl3
- Барий сульфатын алудың барлық мүмкін химиялық реакция теңдеулерін жазыңыз.
- Неге күміс нитраты тұз қышқылымен де, натрий хлоридімен де әрекеттеседі? Сәйкес теңдеулерді молекулалық және иондық түрде жазыңыз.
№2зертханалық жұмыс
Химиялық кинетика және химиялық тепе-теңдік
Жұмыстың мақсаты: әрекеттесуші заттардың концентрацияларының, температураның химиялық реакция жылдамдығына, заттар концентрациясының химиялық тепе-теңдіктің ығысуына әсер етуін зерттеу.
Құралдар мен реактивтер: зертханалық сынауықтар, химиялық стакан, пипеткалар (5мл), термометр(50-100 0 С-ға дейін), шпатель, электр пеші, Na 2 S 2 O 3 (5% ерітіндісі), KCl (құрғақ тұз), ерітінділер (0, 1 н) : H 2 SO 4 , FeCl 3 , KCNS немесе NH 4 CNS.
Химиялық реакцияның жылдамдығын кесімді уақыт ішінде (секунд, сағат, жыл) реакцияласушы заттардың концентрацияларының өзгеруімен өлшейді.
Концентрация дегеніміз көлем бірлігіндегі заттың мөлшері.
Реакция жылдамдығы әрекеттесуші заттардың табиғатына, олардың концентрациясына, температураға және жүйедегі тәуелді.
Әрекеттесуші массалар заңы)
Химиялық реакциялардың жылдамдығы әрекеттесуші заттар концентрацияларының көбейтіндісіне тура пропорционал.
Мысалы, А+В 2 →АВ 2 реакциясы үшін, әрекеттесуші массалар заңы келесі түрде өрнектеледі:
v=k [A] ·[B 2 ]
Бұл теңдеуде [A] және [B 2 ] - реакцияға түсетін заттардың концентрациялары, ал пропорционалды коэффициент - k реакция . Жылдамдық тұрақтысы- k әрекеттесуші заттардың табиғатына тәуелді болады. Әрекеттесуші массалар заңының математикалық өрнегі, яғни кинетикалық теңдеуі А+2В=АВ 2 реакциясы үшін келесі түрде өрнектеледі:
v=k [A] ·[B] 2
Гетерогенді реакцияларда қатты күйдегі заттардың концентрациялары реакция барысында өзгермейді, сондықтан әрекеттесуші массалар заңыныңкинетикалық теңдеуіне қосылмайды.
Химиялық реакция жылдамдығының температураға тәуелділігі Вант-Гофф ережесімен анықталады: температура әрбір 10 0 С-қа өзгергенде реакция жылдамдығы 2 - 4 есе өзгереді:
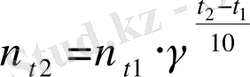 мұндағы
γ
- температуралық коэффицент.
мұндағы
γ
- температуралық коэффицент.
Химиялық реакция жүргенде бастапқы заттардың концентрациялары азаяды, бұл тура реакция жылдамдығының кемуіне алып келеді. Егер реакция қайтымды болса, онда реакция тура және кері бағытта да жүре алады. Тура және кері реакциялардың жылдамдықтары бірдей болғанда химиялық тепе-теңдік күйі пайда болады және реакцияға қатысушы заттардың концентрациялары ары қарай өзгермейді.
А + В ↔︎ С + Д реакциясы үшін:
тура реакция жылдамдығы v → =к → [А] ·[В]
кері реакция жылдамдығы v ← =к ← [С] ·[Д]
Химиялық тепе-теңдік күйінде v → = v ← , яғни к → [А] ·[В] = к ← [С] ·[Д]
Осыдан,
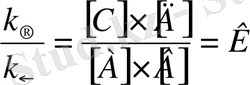 , мүндағы К-реакция тепе-теңдігініңтұрақтысы.
, мүндағы К-реакция тепе-теңдігініңтұрақтысы.
Тепе-теңдік тұрақтысының өрнегіне кіретін концентрациялар тепе-теңдік концентрациялары деп аталады. Тепе-теңдік тұрақтысы неғұрлым үлкен болса, соғұрлым реакция өнімдерінің шығымы көп болады.
Химиялық термодинамикада химиялық реакцияның жалпы жағдайы
аА+вВ→сС+дД үшін тепе-теңдік тұрақтысы:
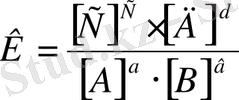
Гетерогенді жүйеде тепе-теңдік тұрақтысыныңөрнегіне тек сұйық және газ күйдегі заттардың концентрациялары кіреді, себебі қатты заттардың концентрациялары тұрақты болып қалады.
Катализатор тепе-теңдік тұрақтысының мәніне әсер етпейді, себебі ол тура және қайтымды реакциялардың белсендіру энергиясын төмендетеді. Катализатор реакция өнімдерінің шығымына әсерін тигізбейді, ол тек тепе-теңдікке жетуді жылдамдатады.
Реакцияныңжүру жағдайы өзгергенде, (температура, қысым, реакцияға қатысатын заттардың концентрациялары) тура және кері үрдістердің жылдамдықтары бірдей өзгермейді, сондықтан химиялық тепе-теңдік бұзылады. Реакцияның берілген бір бағытта өтуі нәтижесінде бастапқыдан өзгеше, жаңа химиялық тепе-теңдік күйі орнайды. Бір тепе-теңдік күйден жаңа тепе-теңдік күйге өту химиялық тепе-теңдіктің ығысуы деп аталады. Бұл ығысудың бағыты Ле-Шателье - Браун принципіне бағынады: Егер тепе-теңдік күйдегі жүйеге бір әсер тигізілсе, онда тепе-теңдік сол әсерді азайту бағытына қарай ығысады.
Мысалы, температураның жоғарылауы тепе-теңдіктің жылуды сіңіруімен, яғни жүйені суытумен жүретін реакция бағытына ығысуына; қысымның жоғарылауы тепе-теңдіктіңгаз тәріздес заттардың мольдерініңжалпы санының азаюы бағытына, яғни қысымның төмендеуіне алып келетін бағытқа ығысуына; жүйеден реакция өнімдерінің біреуін алып тастау тепе-теңдіктің тура реакция жағына ығысуына; бастапқы заттардың біреуінің концентрациясының азаюы тепе-теңдіктің кері реакция бағытына ығысуына алып келеді.
Жұмысты орындау реті
1 тәжірибе. Реакция жылдамдығының әрекеттесуші заттардың концентрациясына тәуелділігі
Натрий тиосульфаты мен күкірт қышқылы арасындағы реакция нәтижесінде ақ лай түрінде элементарлы күкірт түзіледі.
Na 2 S 2 O 3 + H 2 SO 4 → Na 2 SO 4 + SO 2 + H 2 O+S
Реакция жылдамдығын ерітіндінің лайлана басталуына дейінгі уақыт бойынша білуге болады.
Сыртында сызықтары барнөмірленген сынауықтарда концентрациялары әртүрлі натрий тиосульфатының ерітінділерін дайындайды.
№1 сынауыққа 9 мл Na 2 S 2 O 3 ерітіндісін құяды, ал №2 сынауыққа 6 мл Na 2 S 2 O 3 ерітіндісінжәне 3 мл дистилденген су құяды, №3 сынауыққа 3 мл Na 2 S 2 O 3 ерітіндісін және 6 мл дистилденген су құяды. Басқа үш сынауыққа 3мл-ден күкірт қышқылын құяды. Тәжірибе былай жүргізіледі:
№1 сынауықтағы натрий тиосульфатының ерітіндісіне күкірт қышқылының ерітіндісін құйып, секундомермен ерітінділерді бір-біріне қосқаннан бастап лай пайда болғанға дейінгі уақытты анықтайды. Лайланудың стандартты деңгейі сынауық сыртындағы сызықтың көрінбей кеткені бойынша анықталады. Осындай тәжірибені №2, №3 сынауықтағы натрий тиосульфат ерітіндісімен де жүргізеді.
Алынған мәліметтерді келесі кестеге толтырады:
Уа-қыт
τ, c
Салыс-тырмалы жылдам-дық
v =1/τ
. (
анықталады), . ? .
2 тәжірибе.
10 0 С- 2-4 есеартады (Вант-Гоффережесі) .
Сызығыбарбірсынауыққа 5 , албасқасынауыққа 5 млкүкіртқышқылынқұяды. (сумоншасы) 5 минутқасалады.
, , (сызық көрінбеуі керек) пайда болуына дейінгі уақытты анықтайды.
Содан кейін басқа сынауықтағы 5 мл натрий тиосульфатының ерітіндісін және 2-ші сынауықтағы 5 мл күкірт қышқылының ерітіндісін су моншасында 30 0 С-ға дейін қыздырады (термометрді натрий тиосульфаты бар сынауыққа салу керек), ерітінділерді бір-біріне құйып, 30 0 С температурадағы реакция жылдамдығын анықтайды.
Осындай тәжірибені 40 0 С температураға дейін қыздырылған ерітінділермен де жүргізеді.
Тәжірибе нәтижелерін кестеге толтырады.
Темпера
тура, 0 С
Салыс-тырмалы жылдамдық
v =1/τ
Реакцияның салыстырмалы жылдамдығының температураға тәуелділігін көрсететін график салыңыз. Реакцияның температуралық коэффициентін мына формуламен есептеңіз:
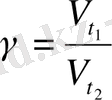
3 тәжірибе. Заттардың концентрацияларының химиялық тепе-теңдікке әсері
4 мл сұйылтылған FeCl 3 ерітіндісін және 4 мл KCNS- калий роданидінің сұйытылған ерітіндісін сынауықта араластырыңыз.
Ерітінді түсінің өзгеруі аз диссоциацияланған молекулалардың, яғни Fe(CNS) 3 пайда болуына байланысты болады:
FeCl 3 +3KCNS = Fe(CNS) 3 +3KCl
Осы реакция үшін тепе-теңдік тұрақтысын есептеңіз.
Алынған ерітіндіні 4 сынауыққа теңдей бөліңіз.
Бірінші сынауыққа 2-3 тамшы концентрлі темір (III) хлоридін, екінші сынауыққа 2-3 тамшы концентрлі калий роданидінің ерітіндісін, үшінші сынауыққа калий хлоридінің бірнеше кристалын салыңыз. Осы үш сынауықтағы ерітінділердің түсін төртінші сынауықтағы ерітіндінің түсімен салыстырыңыз.
Әр сынауықта темір роданидінің концентрациясы қалай өзгерді?
Химиялық тепе-теңдік тұрақтысының өрнегін пайдалана отырып, ерітінділер түсінің өзгеруін түсіндіріңіз және тепе-теңдіктің ығысу бағытын анықтаңыз. Қайтымды реакцияны аяғына дейін қалай жеткізуге болады?
Бақылау сұрақтары:
1. Әсер етуші массалар заңын тұжырымдаңыз және оны келесі қайтымды құбылыстарға қолданыңыз:
2CO+O 2 =2CO 2
C+H 2 O (бу) =СO+H 2
FeCl 3 +3KOH→3KCl+Fe(OH) 3
2KClO 3 =2KCl+3O 2
2. Неге температураның жоғарылауы реакция жылдамдығына үлкен әсерін тигізеді?
3. Тепе-теңдік тұрақтысы нені сипаттайды?
4. Ле-Шателье ережесінің негізінде соңғы тәжірибедегі тепе-теңдіктің ығысуын қалай түсіндіруге болады?
№3 зертханалық жұмыс
Ерітінділердің қасиеттері
Жұмыстың мақсаты: заттарды еріткен кезде жүретін құбылыстарды және ерітінділердің қасиеттерін зерттеу.
Құралдар мен реактивтер: сынауықтар, химиялық стакан, фарфор табақша, термометр (бөліну аралықтары 1 0 С), электр пеші, мақта, H 2 O(дистилденген), құрғақ тұздар: CuSO 4 , CuSO 4 •5H 2 O, NH 4 NO 3 , CH 3 COONa, CaCl 2 , NaCl, KOHтүйіршіктері), NaCl(10% ерітіндісі) .
Ерітінділердің түрлері:
а) белгілі бір температурада еритін зат ары қарай ери алмайтын ерітіндіні қаныққан ерітінді деп атайды.
ә) белгілі бір температурада заттың біраз мөлшері әлі де ери алатын ерітіндіні қанықпаған ерітінді дейді.
в) еріген заты көп ерітіндіні концентрлі деп, ал еріген заты аз ерітіндіні сұйылтылған ерітінді деп атайды.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz