Полимерге иммобилизацияланған Cu(II) комплекстері қатысында алкилароматты көмірсутектерді сұйықфазада оксигенирлеудің кинетикасы мен механизмі


ӘЛ-ФАРАБИ АТЫНДАҒЫ ҚАЗАҚ ҰЛТТЫҚУНИВЕРСИТЕТІ
Химия факультеті
Катализ, коллоидты химия және мұнай химиясы кафедрасы
БІТІРУ ЖҰМЫСЫ
Алкилароматты көмірсутектерді оксигенирлеу реакциясының полимерметалды комплекспен катализденуі
Орындаған :
4 курс студенті Кожалакова Н. А.
Ғылыми жетекші :
х. ғ. к., доцент Ташмухамбетова Ж. Х.
х. ғ. к., в. н. с. Шокорова Л. А.
Қорғауға жіберілді
Катализ, коллоидты
химия және мұнай
химиясы кафедрасының
меңгерушісі,
х. ғ. д., профессор Мусабеков К. Б.
Алматы 2009 ж.
Реферат
Бітіру жұмысы 49-беттен, 24-суреттен, 1-кестеден, 44-қолданылған әдебиеттен тұрады.
Түйінді сөздер ─ мұнай химиясы, сұйықфазалы катализ, ауыспалы валентті металдар комплекстері, полимерлі матрицаға бекітілген катализатор, тотығу, қаныққан көмірсутектер, оттек.
Зерттеу нысаны ─ Алкилароматты көмірсутектер
Жұмыстың мақсаты ─ Алкилароматты көмірсутектерді сұйықфазада тотықтыру процесін «жұмсақ» жағдайда жүргізетін (оттекті атмосфералық қысымда, 70-90ºС температурада) ең тиімді катализаторларды жасау және тотығу процесінің қолайлы параметрлерін анықтау.
Алкилароматты көмірсутектерді оттекпен сұйықфазада полимерге (поливинилпиролидонға) иммобилизацияланған катализатор қатысында тотықтыру процесінің кинетикасын және механизмін зерттеу.
Жұмыста химиялық, физикалық және физика-химиялық зерттеу әдістері қолданылды. Алкилароматты көмірсутектерді ауыспалы валентті металдар қосылыстары қатысында сұйықфазада оксигенирлеудің әдеби мәліметтері келтірілген.
Алкилароматты көмірсутектерді сұйықфазада полимерлі матрицаға иммобилизацияланған ауыспалы валентті металдар комплексі (Cu(ІІ) ) қатысында оксигенирлеудің кинетикалық заңдылықтары зерттелді. Оттек атомының тотықтырғыштан көмірсутектің С-Н байланысына бірэлектронды, радикалды механизм бойынша тасымалдануы ұсынылды. Процесті сипаттайтын кинетикалық теңдеулері ұсынылған.
Реферат
Дипломная работа 49- стр., 14- рисунков, 1- таблицы, 44- источников литературы
Ключевые слова - нефтехимия, жидкофазной катализ, комплексы переходных металлов, закрепленные на полимерную матрицу, окисление, алкилароматические углеводороды, кислород.
Объект исследования - алкилароматические углеводороды.
Цель работы - разработка высокоэффективных катализаторов в процессе жидкофазного оксигенирования алкилароматических углеводородов в мягких условиях ( атмосферное давление, 70-90°С ) и определение оптимальных параметров процесса оксигенирования.
В работе использованы физические и физико-химические методы исследования. Приведены литературные данные по оксигенированию алкилароматических углеводородов в присутствии комплексов переходных металлов в процессе жидкофазного окисления.
Изучены кинетические закономерности жидкофазного оксигенирования алкилароматических углеводородов ( толуол ) в присутствии комплексов металлов переменной валентности (Сu (II) ), закрепленных на полимерную матрицу.
Предложено кинетическое уравнение, описывающее этот процесс. Предложен механизм процессаа, заключающийся в переносе атома кислорода от окислителя ( O 2 ) к С - Н -связи углеводорода по одноэлекторнному механизму.
Шартты белгілер
RH - толуол;
ПВП - поливинилпирролидон;
К - катализатор;
М - металл;
К i - жылдамдық константасы, c 1 ; моль -1 ; л·с -1 ; моль -2 · л 2 · с -2 ;
α j , β j , γ j - тепе-теңдік константасы, л/моль;
Е # - активтену энергиясы, кДж/моль;
Wо 2 - оттегінің жұтылу жылдамдығы, моль/(л с) ;
Qо 2 - жұтылған оттегі мөлшері, моль/л;
τ - реакция уақыты, с;
φ - тотығу тотықсыздану потенциалы, В;
t - температура, ºС;
Т - температура, К (кельвин) ;
ССІ 4 - тетрахлорметан;
C 6 H 5 CHO- бензальдегид
МАЗМҰНЫ
Кіріспе
1. ӘДЕБИЕТТЕРГЕ ШОЛУ
1. 1 Көмірсутектерді оттегімен тотықтыру
1. 1. 1 Оттегі молекуласының қасиеті
1. 1. 2 Оттегіні металполимерлермен активтеу және байланыстыру
1. 2 Көмірсутектерді оксигенирлеудің механизмі
1. 2. 1 Тізбектің түзілуі
1. 2. 2 Тізбектің жалғасуы
1. 2. 3 Тармақталып тізбектелу
1. 2. 4 Тізбектің үзілуі
1. 3 Полимерге бекітілген металкомплекстердің катализдегі маңызы
1. 4 Көмірсутектердің полимерметалды катализаторлар қатысында тотығу реакциясының механизмі
1. 5 Алкилароматты көмірсутектерді оксигенирлеу
1. 5. 1 Толуолдың каталитикалық тотығуы
1. 6 Алкилароматты көмірсутектердің тотығу реакцияларының механизмі
1. 7 Органикалық қосылыстарды полимерлі матрицаға отырғызылған ауыспалы валентті металдар комплекстері қатысында тотықтыру
2. ТӘЖІРИБЕЛІК ТАЛДАУ
2. 1 Қолданылған заттардың сипаттамалары
2. 2 Әдістемелік бөлім
2. 3 Кинетикалық әдіс
2. 4 Оттек құрамды өнімдерді анализдеу
2. 5 Тәжірибелік мәліметтерді өңдеу әдісі
2. 6 Тәжірибе қателіктері
3. НӘТИЖЕЛЕР ЖӘНЕ ОЛАРДЫ ТАЛҚЫЛАУ
3. 1 Мыс (ІІ) комплексі қатысында толуолды оттегімен тотықтыру.
3. 1. 1 Мыс (ІІ) комплексінің концентрациясының әсері.
3. 1. 2 Полимер (ПВП) концентрациясының әсері
3. 1. 3 Оттегінің парциал қысымының әсері
3. 1. 4 Толуолдың концентрациясының әсері
3. 1. 5 Су мөлшерінің әсері
3. 1. 6 Температураның әсері
3. 1. 7 Өнімнің әсері
ҚОРЫТЫНДЫ
ҚОЛДАНЫЛҒАН ӘДЕБИЕТТЕР ТІЗІМІ
КІРІСПЕ
Тақырыптың өзектілігі. Полиметалды комплекстер негізінде жаңа тиімді, селективті және технологиялық катализаторларды алу мәселесі қазірігі кезде зор маңызға ие болуда. Олар алкилароматты қосылыс негізіндегі оттегі құрамды органикалық заттардың синтезінде қолданылды.
Органикалық заттарды оттегімен тотықтыру- бір ғана сатыда оттекті функцияны кез-келген қосылысқа енгізуге болатын және бағалы химиялық өнім алуға мүмкіндік беретін органикалық синтезде кең таралған маңызды реакциялардың бірі. Экологиялық таза, әрі арзан тотықтырғыштардың бірі - оттек қолданылатын органикалық шикізаттарды тотықтыру процесі гидрлеу, полимерлеу сияқты процестер қатарында экономикалық тиімді болып табылады және химия өндірісінде маңызды орынға ие.
Сонымен қатар экологиялық таза тотықтырғыш - оттегі «жұмсақ» жағдайда (температура 150ºC- ден төмен) әлсіз тотықтырғыш болып табылады және синглетті жағдайда болатын органикалық қосылыстардың молекулаларымен әрекеттесе алмайтын триплетті жағдайда болады. Осыған байланысты газ тәріздес оттегімен сұйықфазада тотықтыру, реагенттерді (субстрат және оттегі) алдын-ала активтендіруді қажет етеді.
Соңғы жылдары оттекті қосылыстарды алу тәсілдерін жүргізуде катализатор ретінде полимерлі матрицаға бекітілген металлкомплексті қосылыстар қолданылады. Мұндай катализаторлар гомогенді және гетерогенді катализаторлардың жақсы қасиеттеріне ие. Бір жағынан олар гомогенді жүйелерге тән жоғары белсенділікке ие, ал екінші жағынан онымен жұмыс жасау жеңіл және реакция өнімдерінен оңай бөлінеді. Полимерлі комплекстің кеңістіктік және электронды құрылымы көп жағдайда оның каталитикалық іс-әрекетінің механизмін анықтайды.
Қазіргі кезде полимерлі матрицаға иммобилизденген катализаторлар қатысындағы бейорганикалық қосылыстардың, көмірсутектердің және т. б. тотығу реакциялары да оттегінің белсенденуіне байланысты көптеген жұмыстар жарық көрген.
Алкилароматты көмірсутектердің оттегімен тотығу реакциясы үшін металл табиғатының - орталық атомның, орталық атомды қоршаған лиганда табиғатының, еріткіштер табиғатының әсері зерттелген. Кинетикалық, потенциометриялық, спектрофотометриялық зерттеулер және квантты-химиялық талдау негізінде процесс механизмі туралы болжамдар ұсынылып, полимерлі комплекстің құрылымының оксигенирлеу реакциясының механизміне әсерін анықтау жұмстары атқарылуда. Ауыспалы валентті металдар комплекстері негізінде алкилароматты көмірсутектерді тотықтырудың сұйықфазалы және иммобилиздеген катализаторлары перспективті болып табылады. Осыған байланысты ауыспалы валенттілікке ие металдар комплекстері негізінде көмірсутектерді тотықтыру үшін гомогенді және иммобилизденген катализаторларды құрудың қажеттілігі туындайды. Бұл катализаторлардың артықшылығы процесті барынша «жұмсақ» жағдайда (Т<150 0 С) жүргізуге және органикалық синтезде одан әрі қолдану үшін көмірсутектерді қажетті құнды өнімдерге ауыстыруға мүмкіндік береді. Сондықтан да химия өнеркәсібінде кеңінен қолдануға кедергі жасайтын активтілігі төмен толуолды каталитикалық оксигенирлеудің жаңа әдістерін дамыту, сұйық фазада полиметалды комплекстері қатысында тотықтыру процесінің кинетикасын зерттеу, әсіресе мұнайға бай Қазақстан үшін өте маңызды болып табылады.
Берілген жұмыстың мақсаты: Алкилароматты көмірсутектерді сұйықфазада тотықтыру процесін «жұмсақ» жағдайларда жүргізетін (оттекті атмосфералық қысымда, 70-90ºC температурада) жоғары тиімді катализаторларды жасау және тотығу процесінің қолайлы параметрлерін анықтау.
Нәтиже жаңалығы: Алғаш рет полимерлі матрицаға (полиакриламид, полиэтиленимин, поливинилпирролидон) иммобилизденген мыс (ІІ) комплексі қатысында алкилароматты көмірсутектерді сұйықфазалы оксигенирлеу процесінің кинетикалық заңдылықтары зерттелді.
Бірінші рет алкилароматты көмірсутектерді (толуолды) «жұмсақ» жағдайда ауыспалы валентті металл комплексі Cu (ІІ) қатысында сұйықфазада тотықтырғанда, әртүрлі бояғыштардың синтезі үшін шикі зат ретінде және әртүрлі фармацевтикалық препараттар синтезі үшін алғашқы қосылыстар ретінде қолдануға болатын, Сu (II) комплексінің негізінде түзілетін бензальдегид негізгі өнім екені көрсетілді.
Тәжірибелік маңыздылығы. Алынған тәжірибе мәліметтері негізінде полимерлі матрицаға (ПВП) иммобилизденген ауыспалы валентті металдар Cu (ІІ) комплексі негізінде төмен температуралы, сұйық фазалы катализаторда жасалынды.
RH - O 2 - CuCl 2 - ПВП - H 2 O - CH 3 CN - CCl 4 каталитикалық жүйеде алкилароматты көмірсутектерді «жұмсақ» жағдайда тотықтырудың кинетикалық заңдылықтарын зерттеу негізінде қаныққан көмірсутектерді тотықтыру процесінің механизмі ұсынылды.
1 ӘДЕБИЕТТЕРГЕ ШОЛУ
1. 1 Көмірсутектерді оттегімен тотықтыру
1. 1. 1 Оттегі молекуласының қасиеті
Түрлі заттарды оттегімен тотықтыру процесі өндірістік өнімдер алудың көзі болып табылады. Процестің жылдамдығы мен бағыты көп жағдайда оттегінің активация мінездемесіне байланысты.
Молекулалық оттегі өте күшті тотықтырғыш болып келеді. Бұл оның электрохимиялық қатардағы алатын орнымен анықталады. Реакцияның (φ) стандартты редокс-потенциалы:
O 2 + 4H + + 4е → 2H 2 O
+1. 23 В тең. Және бұл мән I 2 →IO 3 - (+1. 20 В) немесе Cr 3+ →Cr 2 O 7 2- (+1. 33 В) сияқты редокс жүйелерінің стандартты потенциалдарымен теңеуге болады. Бірақ, көп субстратты молекулалық оттегі реакциялары гомогенді ертіндіде, газ фазасында, бөлме температурасында да өте жай жүреді.
Диоттегіні суға дейін төрт электронды тотықсыздандыру кезінде 491 кДж/моль бос энергия бөліне [1], процесс термодинамикалық өте тиімді. Салыстыру үшін, гипохлоритінің екі молекуласының төрт электронды тотықсыздандыру кезінде 339 кДж/моль (ΔG ° ) : екі молекула хлор -529 кДж/моль бөледі. Оттегі түрлі органикалық субстратты тотықтырады.
Молекулалық оттегінің су ертіндісіндегі тотығу-тотықсыздану және қышқыл-негіздік айналулардың термодинамикалық мінездемелері 1-кестеде келтірілген.
Келтірілген нәтижелерден көргендей оттегінің O-O байланысының үзілуімен жүретін екі электронды тотықсыздану немесе судың екі электронды тотығуы (O = ) кезінде түзілетін диоттегінің тотықсыздануы әлдеқайда тұрақты аралық қосылысы атомарлы оттегі болып табылады.
Диоттегінің тотыққа ауысуы
O 2 + 2H + + 2е → H 2 O 2 , φ = 0, 68 В (1)
151 кДж/моль бос энергияның бөлінуімен жүреді.
Оттегі молекуласының метатұрақтылығын түсіндіру үшін, екі гипотеза ұсынылды. Бір жағынан, жоғарыда көрсетілген толық тотығу- тотықсыздану потенциалы, O 2 молекуласы екі электронды ауысумен тотықсызданған кезде жүзеге асады. Бұл бірінші этапта оттектің бір электронды тотықсыздану сияқты термодинамикалық тиімсіз реакция өту қажет:
O 2 + H + + e →HO 2 (ΔG ° = 15. 4 кДж/моль), φ = - 0, 32 В (2)
Молекулалық оттегінің инерттілігі дәл осы жағдаймен байланыс
1 кесте
Оттегі айналуының термодинамикалық мінездемелері
А-Н Байланыс энергиясы,
кДж/моль
А Гидратация
жылулығы,
кДж/моль
(А/АН(А - ) ), В
Редокс-потенциалы
(АН/А - )
Рк А
O 2 /HO 2 (O 2 - )
HO 2 /H 2 O 2 (HO 2 - )
OH/H 2 O(OH - )
HO 2 /O+H 2 O
O/OH(O - )
O 2 - /HO 2 - (O 2 = )
O 2 /H 2 O(HO 2 - , O = )
O 2 /O+H 2 O
O/H 2 O(OH - , O = )
205
366
499
-
428
-
-
-
-
11. 7
34. 3
23. 0
-
8. 8
-
-
-
-
0. 12(-0. 155)
1. 44(-0. 6)
2. 83(2. 0)
-0. 1
2. 34(1. 6)
1. 03(0)
0. 74, 0. 44
(-0. 1)
2. 6(2. 2, 2. 4)
4. 75
11. 75
14. 0
-
11. 9
17
-
-
-
Басқа жағынан, бос триплетті O 2 молекуласының синглетті молекулалармен реакциясына, спиндерін сақтаған соң, жоғары активациялық энергия тең[2, 3] :
O 2 ↑↑ + RH → HO 2 ↑↑ + R ↑ , O 2 ↑↑ + RH → O ↑ RH, (3)
ал оттегі молекуласын триплетті күйден синглеттіге ауыстыру көп энергияны қажет етеді:
( π *I π *I ) O 2 ↑↑ ↔︎ (π *2 π *0 ) + 167. 2 кДж/моль
Оттегі молекуласы екі жұптаспаған электронымен парамагнитті болып келеді. Бұл екі ээлектрон антибайланыссыз π g - деңгейде, Iπ u орбитальдағы төрт электронның екеуін байланыс эффектімен ауыстырады. Яғни, оттегінің екі атомы бірге бір σ- және бір π- байланысымен байланысып, 12 электроны бар O 2 электронды конфигурациясын осылай жазуға блады:
(2σ g ) 2 (2σ u ) 2 (Iπ u ) 4 (3σ g ) 2 (Iπ g ) 2 (4)
Оттегінің жұптаспаған екі электроны молекуласына бирадикал мінездемесін беріп, реакциялық жұптар парамагнитті металлдардың иондары мен радикалдары болы тиіс.
Оттегінің реакционды қасиеттерін жоғарлатудың бір жолы, ауыспалы металл комплекстерімен химиялық активациялау. Координациялау кезінде π x және π z - орбитальдарының пайда болуы шешіліп, O 2 синглетті күйге көшеді. Оксигенальды комплекстердің үш типі белгілі: π- комплекс (төзімсіз суперкомплекс), π-σ-комплекс (орбитальды) және σ- комплекс (қайтымсыз, төзімді комплекс) . π- комплексте тек π- дативті электрондардың ауысуы, π-σ- комплексте π- дативті және σ- донорлы, ал σ- комплексте - ковалентті байланыстар айқындалады. Одан басқа, оксигенальды қосылыстар моно-[M(O 2 ) ] және биядролы (M 2 O 2 ) болады. σ- комплекстер донорлы лигандалар қатысында оксидтерге ауысады
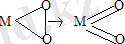
Жоғары валентті комплекстер қасиеттеріне байланысты активтелген оттегі молекуласы тек жұмсақ жағдайда ғана реакцияланып қоймай, субстратқа тиісті белгілі талғампаздыққа ие. [4]
1. 1. 2 Оттегіні металлполимерлермен активтеу және байланыстыру
Тотығу реакциясын тездетудің бір жолы, оттегі молекуласын металлкомплекспен активациялап, кейін активтелген тотықтырғышты субстратпен әрекеттесуі. “Оттегіні активациялау” түсінігі O 2 молекуласының ауыспалы металлдармен тікелей әрекеттесіп, органикалық қосылыстың тотығуына қатысатын аралық бөлшектер түзілуімен түсіндіріледі.
Негізгі қортындылар, мобильді металлокомплекстер әсерінен гомогенді жүйелердегі реакцияларды зерттеу барысында жасалған. [5-9]
Металлокомплекстің O
2
әрекеттесуі, құрамында O
2
-
супероксид ионы, O
2
және μ- пероксокомплексі (MOOM) және байланыстырушы O
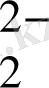 - O
2
ионы бар, металлцентрден бір электронды ауысу арқылы супероксокомплекстің (MO
2
) түзілуімен жүреді. Байланыстырушы ион молекулалық оттегінің H
2
O
2
дейін тотықсыздану өнімі болып табылады.
- O
2
ионы бар, металлцентрден бір электронды ауысу арқылы супероксокомплекстің (MO
2
) түзілуімен жүреді. Байланыстырушы ион молекулалық оттегінің H
2
O
2
дейін тотықсыздану өнімі болып табылады.
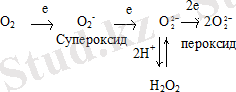
Әдетте, супероксокобальт (3+) интермедиант ретінде түзіліп, тез арада μ-пероксокобальтқа (3+) айналады.
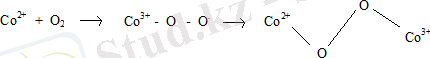
Төмен валентті ауыспалы металлдар Co(I), Ir(I) және тб. үшін де мономолекулярлы пероксокомплекстер түзеді :
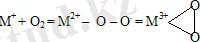
Кобальт (II) макрокомплексінің ПЭИ қатысында, бөлме температурасында, су ертіндісінде оттегімен қайтымды байланысуы- μ -пероксооттегілік аддукт береді. [10] Ол поликатиондағы электростатикалық тебісулер түрінде μ- перожүйенің бұзылуынан пайда болатын, диссоциациялық константаның жоғарылауымен сиппатталады. [11]
2Co 2+ L 6 + O 2 = L 5 - Co 3+ - O - O - Co 3+ + L 5 (5)
Мұндағы, L - мономерлі ?NH-CH 2 -CH 2 -
Осындай полимерлі комплекстердің эффективтілігі (pH=7, 4) миоглобин және гемоглобин деңгейінде болады. Оттегіні полимерлі комплекс және оның төмен молекулалы аналогы ЭДТА мен қайтымды байланыстыруын салыстырса, реакцияның k p мәні:
k p
L 5 -Co 3+ -O 2 -Co 3+- L 5 +ЭДТА Co 3+ ЭДТА + O 2 + комп (6)
мономерліге қарағанда 3-5 есе жоғары. Спиртті ортада RhCl 3 -тің ПЭИ әрекеттесуі кезінде, Rh(III) -ң Rh(II) дейін тотықсыздануы байқалып, соңғысының полимерлі комплексі ауа оттегісімен әрекеттесіп, супероксидті комплекс береді.
Бұдан да көп таралу тапқан, макромолекулалық металлохелаттар. Мысалы, полихелаттарға бекітілген Co(II) оттегімен[12] , регенерацияға бейім моноядерлі суперкомплекс түзеді. Өйткені, мұндай жүйелерде димерлі μ- пероксокомплекс түзілмейді.
Оттегімен байланысу жылдамдығы макрокомплекстің хелатты түйінінің табиғатына байланысты. Полимерлі лигандада оксигенирленген кобальт(II) комплексінің түзілу константасы к = 500л/моль, ал оның төмен молекулалы аналогы РуCo 2+ жағдайында - 13 л/моль. Оттегіні активациялау үшін кобальт комплекстерінен басқа, иммобилизденген Cu(II) косылыстары қолданылады. Мұнда, оттегімен Cu(II) поли (акролин-оксимді) комплексінің байланысу жылдамдығы, макролиганданың молекулалық массасының және бекітілген Cu(II) концетрациясының жоғарылауымен төмендейді. Процесс циклді (пинг-понг) механизмімен жүреді:
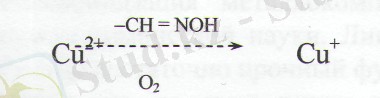
 Концентрациялық қатынасына қатысты адсорбцияланған және десорбцияланған O
g
оттегі мөлшері, оксимді топтардың концентрациясымен байланысты :
Концентрациялық қатынасына қатысты адсорбцияланған және десорбцияланған O
g
оттегі мөлшері, оксимді топтардың концентрациясымен байланысты :
Сол сияқты, оттегінің 2, 3, 6, 7- негізінде Cu(I), Cu(II) және Pd(II) полимерлі хелаттармен адсорбциясы осындай механизммен жүруі мүмкін.
Молекулалық оттегіні активациялау кезіндегі иммобилизденген порфиринді және фталоцианды ауыспалы металл Fe(III), Mn(III), Co(III) комплекстерін пайдалану кезінде көп жетістіктерге жетті. Олар металлферменнтердің модельді жүйесі - металлқұрамды электрон тасымалдағыш ретінде зерттеледі. Оттегі қатысымен кталитикалық реакция альтернативті екі механизммен жүреді: донорлы ( жүру барысында электрон катализатордан тотықтырғышқа ауысады) және акцепторлы ( электрон ауысуы тотығатын субстраттан катализаторға жүреді) .
1. 2 Көмірсутектерді тотықтырудың механизмі .
Көмірсутектердің каталитикалық емес тотығуының жалпы сызбанұсқасы Бах-Энглердің асқын тотығы теориясы [13] мен Семеновпен қалыптасқан және Эмануэль және оның әріптестерімен дамытылған [14, 15] туындала тармақталу арқылы жүретін тізбекті реакция теориясына сәйкес былай болуы мүмкін [16] :
2RH + O 2 → 2R + H 2 O 2 (7)
RH + O 2 → R ̇ + OH ̇ 2 (7')
RH + O 2 → ROO ̇ (8)
ROO ̇ + RH →ROOH + R (9)
ROO ̇ →R'COOH + R"O (9')
ROOH
ROO ̇ + ROH →R' + өнім (9")
R'COR"
ROOH →RO ̇ + ̇ OH
RH
ROOH + RʹCOOH →Rʺ ̇ + өнім
R'COR"
R' ̇, R" ̇, RO ̇, ̇ OH + RH →R ̇ + R'H, RʺH, ROH, H 2 O (10)
ROOH → өнім (молекулярлы ыдырау) (11)
ROO ̇ + ROO ̇ → өнім (12)
ROO ̇ + R ̇ → өнім (13)
R ̇ + R ̇ → өнім (14)
Бұл сызбанұсқа келесі элементар сатылардан тұрады:
- біріншілік бос радикалдар түзетін тізбектің тууы (7, 7')
- RОО ̇ және аралық пероксид RООН-ң түзілуі арқылы тізбектің жалғасуы (8, 9, 9, 9', 9")
- Аралық пероксидтің RО ̇ және ̇ ОН - бос радикалдарына ыдырай жүретін, тізбектің тармақталуы (немесе туындай тармақталу) (10, 10')
- пероксидтің әртүрлі тотығу өнімін түзе молекулалық ыдырауы (12)
- радикалдардың рекомбинациялануының үш түрінен тұратын тізбектің үзілуі (13-14) . Тізбектің түзілуі.
Тізбектің түзілуі (7), (7') реакцияларына сәйкес үшмолекулалы, бимолекулярлы механизм бойынша жүруі мүмкін.
Көмірсутек құрылымы мен тотығу реакциясын жүргізу жағдайларына байланысты екі реакцияның біреуі жүреді.
Полярлы емес еріткіш қатысында тізбектің иницирленуінің үшмолекулалы механизмі келесідей активтену энергиясының мәніне ие (7) :
Е 0 ≈ [q 0 ] + Е 0 ; мұнда q 0 =2Q к-н -138
Е 0 ≈ 20, 95*10 -3 - 41, 9*10 -3 кДж/моль
және пред экспонента мәні А≈10 3 -10 5 л/(моль*с)
Оттегінің парциал қысымын жоғарылатқанда реакция басым, ал көмірсутегінің концентрациясын жоғарылатқанда реакция басымырақ өтеді.
Оттекті активтендіру процесі энергиясы (термиялық, химиялық және т. б. ), ауыспалы валентті металдарды қолданғанда немесе реакциялық ортаның өзара әрекеттесуінен (еріткіш, реакция шикізаты) жүруі мүмкін.
Сұйық фазада тотығу процесінің көмірсутектердің активтендіру механизмі иен радикалдар түзу осы күнге дейін әлі толық анықталмаған. Көп жағдайда тізбек түзу реакциясына катализатордың қатысуы оттегінің металдың координациялық сферасына ену есебінен оның ерекше активтенуіне әкеледі және тек кейбір жағдайда ғана көмірсутектердің активтенуі мүмкін. [17]
1. 2. 3 Тізбектің жалғасуы.
Жүйеде тізбектің туындауы (7, 7') немесе туындала тармақталу (10) нәтижесінде түзілген R радикалы алмасып отыратын екі бимолекулярлы радикалдардың (8) және (9) тотығу өзгерістеріне қатысады. Реакция (14) негізінен активтену энергиясын 16*10 3 -50, 28*10 3 Дж/моль тең. К 2 « К 1 екені белгілі болды (бірнеше ретке) ; бұл реакцияның қоспада пероксид радикалдарының концентрациясы R-дың концентрациясына қарағанда жоғары екенін білдіреді.
Тотығу процесінің басында жұтылған оттек мөлшері түзілген пероксид қосылыстары мөлшеріне эквивалентті болып келеді, бірақ тізбектің жалғсуының соңғы сатыларында бұл заңдылық бұзылады: оттегі қажет мөлшерден артық жұтылады, пероксидтің көптігінен.
Бұл тотығу процесінің бастапқы сатыларына пероксидтер негізгі өнім болады, ал соңғыларына негізінен оттекті қосылыстар үлкен мән атқарады. 200 0 С температурада пероксидті радикалдың ROO көмірсутекпен RН әрекеттесу реакциясы О-Н байланысының үзілуімен (Q OH < 368. 7 кДж/моль) жүреді, бұл реакция - экзотермиялық .
К 1 - К 2 -ден бірнеше ретке үлкен болғандықтан тізбектің жалғасу реакциясының жылдамдығы тек (5) реакциямен, яғни пероксид радикалының комірсутегімен әрекетесуімен анықталады.
Тізбектің жалғасуымен қатар ROO радикалы (5 ' ) реакциясы бойынша изомеризацияға немесе оттегі қосылыстарымен (5 " ) реакциясы бойынша әрекеттесуі мүмкін.
ROO · радикалының оттегі қосылыстарымен әрекеттесу жылдамдығы R і Н байланысының мықтылығы азайған сайын жоғарлайды.
R і Н + ROO ̇ → ROOН + R і ̇ (15)
Реакция қатысында жиналған гидропероксидтер бастапқы көмірсутекпен (10 ' ) реакциясы бойынша әрекеттесіп, радикал түзуі мүмкін. Этиленбензолдың тотығу мысалында [18] (13) пероксид радикалдарының этиленбензолдың гидропероксидімен әрекеттесуінің жылдамдық костантасы бастапқы этиленбензолмен әрекеттесуімен салыстырғанда бір ретке жоғары екенін көрсеткен.
Ауыспалы валентті металл-католизаторын қолданғанда реакцияның жалғасуы мен үзілуі жүруі мүмкін. Бұл катализатордың бос пероксид радикалымен комплекс (К) түзілу қабілетіне байланысты. Реакция жылдамдығының өсуі және оның төмендеуі түзілген комплекстің акивтілігімен анықталады. Катализатордың ROO · - мен әрекеттесу сызбанұсқасы келесідей реакциялармен сипатталуы мүмкін:
ROO ̇ + М → К + RO 2 ̇ (16)
К + RН → КН + R ̇ (17)
- Туындала тармақталу.
Көмірсутектердің сұйық фазада туындала тармақталу реакциясы жүйеде тізбектің туындалуының қосымша актілерін тудыратын бос радикалдарының болуымен түсіндіріледі. Мұндай қосылыстарға гидропероксидтер, альдегидтер және асқынқышқылдар жатады.
Тотығу процесінің бірінші сатыларында аралық өнім ретінде түзілетін гидропераксидттер тізбекті реакцияны радикалдарға (10) реакциясы бойынша
О-О байланысының үзілуі арқылы (байланыстың беріктілігі 125, 7-167, 6 кДж/моль) иницирленуі мүмкін. Сондай-ақ гидропероксидтер бимолекулярлы реакция (10') бойынша да ыдырауы мүмкін.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz