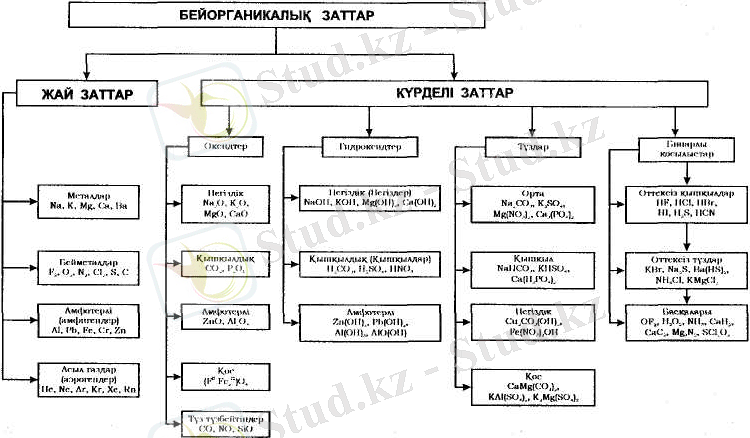
Бейорганикалық заттардың кластары мен негізгі химиялық қасиеттері


Бейорганикалық заттар кластары
Бейорганикалық қосылыстарды жіктеуде алхимиктердің алғашқы тәжірибелерінен бастап, заттардың құрамын, құрылысын және олардың әрекеттесуін зерттеуге арналған жетілген физикалық аспаптары бар ғалым-хи-миктердің қазіргі кездегі жұмыстарына дейін ұзақ дамуы біртіндеп қалыптасты, бүгінгі күндері жалғаса түсуде.
Химиялық элементтер металдық және бейметалдық қасиеттері бар элементтерге бөлінеді.
Көптеген элементтер Периодтық жүйедегі орнына сәйкес бір мезгілде әрі металдық, әрі бейметалдық қасиеттерді көрсетеді. Ондай элементтер екідайлы деп аталады. Үлкен өзіндік химиялық қасиеттерінің ықпалымен жеке асыл газдар - VIIIA-тобы элементтерін бөледі.
Элементтердің бөлінуіне сәйкес жай (бір элементті) заттарды- химиялық элементтердің бос күйінде бола алу түрлерін жіктейді.
Күрделі заттарды (екі немесе көп элементті) қосылыстар табиғатта ең көп тараған элемент оттектің және оттекті қосылысында судың болуына негізделген.
Оттек He, Ne және Аr басқа барлық элементтермен қосылыстар түзеді. Олардың ішінде ОF 2 қосылысы - оттектің дифториді, қалғандары (жалпы формуласы Э х О у -оксидтер, себебі оттек - электртерістігі бойынша фтордан кейінгі екінші элемент. Оксидтер - күрделі заттардың бірінші класы.
Оксидтердің сумен әрекеттесуі (формалды түрде жиі, шын мәнісінде сирек) нәтижесінде гидроксидтер алынады. Химиялық касиеттері бойынша қышқылдық (Н х ЭО у , негіздік және екідайлы [М(ОН) n ] гидроксидтер болып бөлінеді; оларға қышқылдық, негіздік, екідайлы оксидтер сәйкес келеді. Гидроксидтер- күрделі заттардың екінші класы.
Гидроксидтердің әр түрлі типтері бір-бірімен әрекеттеседі және жалпы формуласы М х (ЭО у ) n М n+ катиондары мен ЭО у х- аниондарынан (қышқыл қалдықтарынан) тұратын оттек бар тұздар түзеді. Мұндай тұздар орта тұздар деп аталады, ал егер олардың құрамында химиялық әр түрлі екі катион немесе қышқыл қалдықтары болса, онда оларды қ ос және араластұздар деп атайды. Тұздың қышқыл қалдығында сутек болса, онда қышқыл тұздар, ал гидроксотоп ОН - (кейде О 2- ионы) болса, негіздік тұздар деп атайды. Тұздар- күрделі заттардың үшінші класы.
Күрделі заттардың кең таралған кластарының бірі -бинарлы қосылыстар - оксидтерге, гидроксидтерге және тұздарға жатпайтын бейорганикалық күрделі заттар. Бинарлы қосылыстар күрделі заттардың төртінші класы.
Бейорганикалық заттардың барлық кластары туралы жалпы мәлімет 3. 6-суретте келтірілген.
Жай және күрделі заттар кластарының маңызды мүшелерінің қатысуымен жүретін реакциялардың көптеген мысалдары элементтер және олардың қосылыстарының химиясына арналған § 10-19-тарда көрсетілген.
Гидроксидтер
Гидроксидтер бірқатар элементтер (фтор мен оттектен басқа) атомдары мен гидроксотоптардан ОН - түзіледі:
Э(ОН) n (n = 1÷6)
Гидроксидтердің орто- және мета-пішіндері (n>2 үшін) болады:
Мета-гидроксидтерді «су мөлшері» аз деп есептеуге болады:
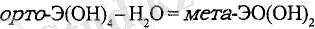
Қышқылдық гидроксидтер
Қышқылдық гидроксидтерде (оттекті қышқылдарында) әрқашан металл атомы орнын баса алатын сутек атомдары болады.
Көптеген типтік қышқылдық гидроксидтер мета- формада болады. Қышқылдық гидроксидтің формуласын жазғанда судағы электролиттік диссоциациялануын еске алып, сутек атомын солдан бірінші орынға қояды (§7-ты қараңыз) : .
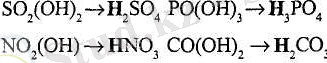
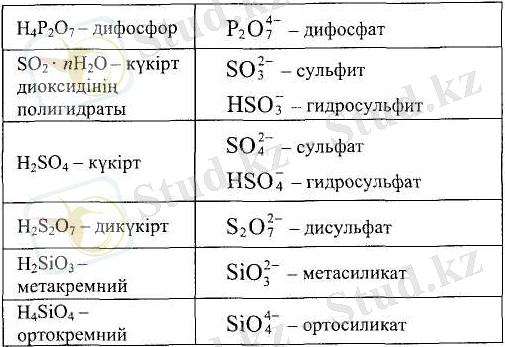
Көп таралған оттекті қышқылдар мен олардың қышқыл қалдықтарының аталуы 3. 11-кестеде келтірілген.
3. 11-кесте. Кең таралған оттекті қышқылдар және қышқыл қалдықтары
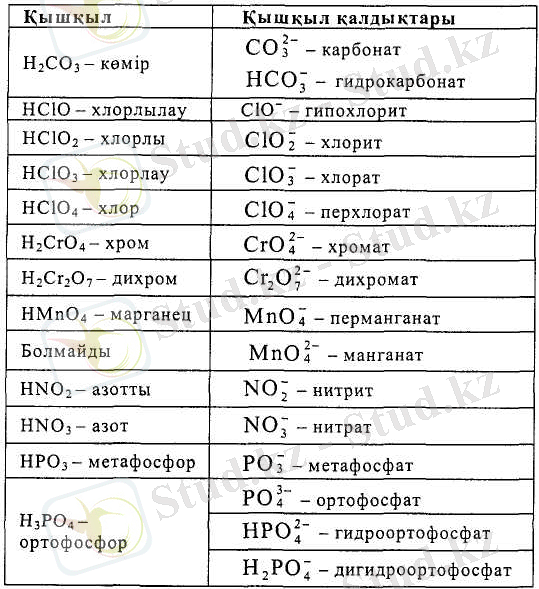
3. 11-кесте. Кеңтаралған оттекті қалдықтар және қышқыл қалдықтары (жалғасы)
Негіздік гидроксидтер
Негіздік гидроксидтерде қышқыл қалдықтар орнын баса алатын гидроксотоптар ОН бар.
Барлық негіздік гидроксидтер ортто-формада болады, олар металл катиондарынан М n+ (п = 1 және 2, кейде 3 және 4) түзіледі:
LiOH - литий гидроксиді
Ва(ОН) 2 - барий гидроксиді
Сu(ОН) 2 - мыс(ІІ) гидроксиді
La(OH) 3 - лантан(III) гидроксиді
Бейтараптау реакциясы
Негіздік және қышқылдық гидроксидтердің маңызды химиялық қасиеттері - олардың әрекеттесіп, тұздар түзуі (бейтараптау реакциясы, немесе тұз түзілетін реакция) :
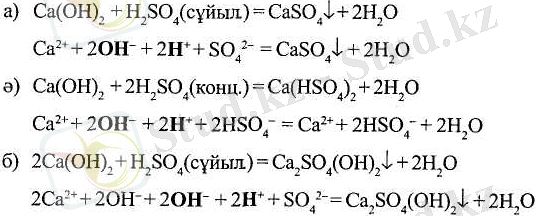
(а) реакциясында екі гидроксидтің толық бейтараптауы жүреді (ОН - :Н + =1:1, реакциядан кейін барлық ОН - топтары мен барлық Н + атомдарының орындары басылады) ; (ә) және (б) реакцияларында қышқылдық және негіздік гидроксидтердің бейтараптауы толық жүрмейді (төрт Н + атомы мен ОН - топтары екеуінің ғана орны басылады) .
Тұздар. Орта тұздар
Тұздардың құрамына М n+ катиондары мен қышқыл қалдықтары кіреді. Егер қышқыл қалдығында сутек болмаса, тұздар орта тұздар деп аталады.
CaSO 4 - кальций сульфаты
Рb(NO 3 ) 2 -қорғасын (ІІ) нитраты
Ва 3 (РО 4 ) 2 - барий ортофосфаты
КСІО 3 - калий хлораты
Орта тұздар - толық бейтараптау өнімдері:
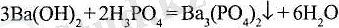
Орта тұздар қышқылдық және негіздік гидрооксидтермен, басқа тұздармен қос алмасу реакциясына түседі:
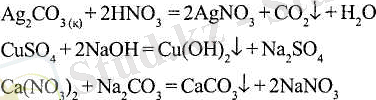
Бұл реакциялар - тұздар алудың кең тараған әдісі. Орта тұздар металдардың қышқылдармен әрекеттесуі кезінде пайда болады:
Fе + H 2 SO 4 (сұйыл. ) = FeSO 4 + Н 2 ↑
C u + 4HNO 3 ( конц . ) = C u (NO 3 ) 2 +2NO 2 ↑ + 2H 2 O
Қышқыл тұздар
Құрамындағы қышқыл қалдықтарында орындары басылмаған сутек атомдары бар тұздар қышқыл тұздар деп аталады.
Ca(HSO 4 ) 2 - кальций гидросульфаты
Fе(НСО 3 ) 2 - темір(ІІ) гидрокарбонаты
Ва(Н 2 РО 4 ) 2 - барий дигидроортофосфаты
ВаНРО 4 - барий гидроортофосфаты
К, ышқыл тұздар- бейтараптауы толық жүрмейтін процестің өнімдері:
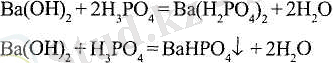
Қышқыл тұздар негіздік гидроксидтердің артық мөлшерімен әрі қарай бейтараптауы мүмкін:
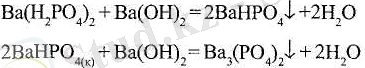
Күшті қышқылдар әлсіз қышқылдардың қышқыл тұздарын ыдыратады:
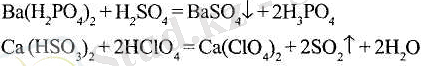
Негіздік тұздар
Құрамында гидроксотоптары бар тұздарды негіздік тұздар деп атайды.
Ca 2 SO 4 (OH) 2 - кальций дигидроксид-сульфаты
CoNO 3 (OH) - кобальт(ІІ) гидроксид-нитраты
Al 2 SiO 4 (OH) 2 - алюминий дигидроксид-ортосиликаты
Кейде негіздік тұздардың формулаларын басқаша жазады: бір жақшаға металл катионы мен гидроксотопты біріктіреді (бірақ бұл қатты тұздар үшін онша нақты емес, себебі М n+ және ОН - иондары кристалдық тордың әр түрлі түйіндерінде орналасады, ал ерітіндідегі тұздар үшін бұл дұрыс) . Формуланы басқаша жазу аталуының өзгеруіне әкеледі:
(CaOH) 2 SO 4 - гидроксокальций сульфаты
(СоОН) NO 3 - гидроксокобальт(ІІ) нитраты
(AlOH) 2 SiO 4 - гидроксоалюминий ортосиликаты
Негіздік тұздардың барлығы дерлік суда аз ериді. Негіздік тұздар - толық емес бейтараптау өнімдері:
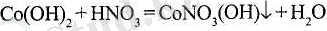
Негіздік тұздардың қышқылдық гидроксидтердің артық мөлшерімен әрі қарай бейтараптауы мүмкін:
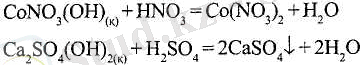
Егер алынған өнімдер бірінің ерігіштігі бастапқы тұздың ерігіштігінен аз болса, сілтілер аз еритін гидроксидтердің негіздік тұздарын ыдыратады (бұзады) :
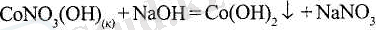
Қос және аралас тұздар
Химиялық әр түрлі екі катионы ( қос тұздар) немесе анионы (аралас тұздар) болады:
KA1(SO 4 ) 2 - калий-алюминий сульфаты
Fe(NH 4 ) 2 (SO 4 ) 2 - темір(ІІ) -диаммоний сульфаты
LiAl(SiO 3 ) 2 - литий-алюминий метасиликаты
Na 3 CO 3 (HCO 3 ) - натрий карбонат-гидрокарбонаты
Na 2 IO 3 (NO 3 ) - натрий иодат-нитраты
Көбінесе қос және аралас тұздар суда аз ериді.
Көптеген қос және аралас тұздарды ерітіндідегі тұздар қоспаларын суыту кезінде бірге кристалдау арқылы алуға болады:
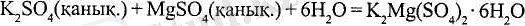
Қышқылдық және негіздік оксидтер
Гидроксидтердің толық дегидраттануы кезінде оксидтер түзіледі:

H 2 SO 4 және Н 2 СО 3 қышқылдық оксидтер, негіздік гидроксидтерге LiOH және Са(ОН) 2 негіздік оксидтер жатады (сәйкес келеді) .
Элементтердің тотығу дәрежелері гидроксидтер мен оксидтерде бірдей болады (Н 2 S VI O 4 →S VI O 3 , Li I OH→Li 2 I O) .
Оксидтердің аталуы:
SO 3 - күкірт триоксиді
СО 2 - көміртек диоксиді
N 2 O S - диазот пентаоксиді
Li 2 O - дилитий оксиді
СаО - кальций оксиді
FеО - темір(І) оксиді
Қасиеттері қарама-қарсы гидроксидтермен немесе әрекеттескенде қышқылдық және негіздік оксидтер сәйкес гидроксидтерінің тұз түзгіштік қасиеттерін сақтайды:
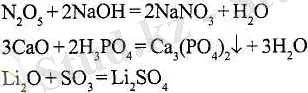
Бірқатар (бірақ бәрі емес) қышқылдық және негіздік оксидтер сумен әрекеттесіп, қышқылдық және негіздік гидроксидтер түзеді:
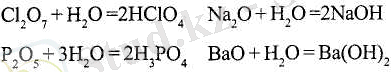
Негіздік және қышқылдық оксидтерді металдар мен бейметалдарды оттекте (немесе ауада) жағу арқылы алуға болады:
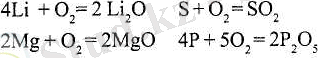
Екідайлы (амфотерлі)
гидроксидтер мен оксидтер
Көптеген элементтердің гидроксидтері мен оксидтері екі түрлі тұздар түзу арқылы екі дайлы қасиет көрсетеді.
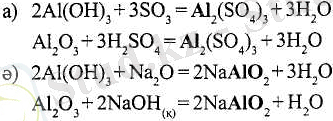
А1(ОН) 3 пен А1 2 О 3 (a) реакцияларында негіздік гидроксидтер мен оксидтердің қасиеттерін көрсетеді, яғни сілтілер тәріздес қышқылдар және қышқылдық оксидтермен әрекеттесіп, алюминий катионы А1 3+ бар тұз түзеді. Керісінше (ә) реакцияларында А1(ОН) 3 пен А1 2 О 3 қышқылдық гидроксидтер мен оксидтердің функциясын атқарады. Бұл кезде түзілген тұзда алюминий атомы А1 ІІІ А1О - 2 анионының (қышқыл қалдығының) құрамына кіреді.
Алюминий элементі бұл қосылыстарда металдың және бейметалдың қасиеттерін көрсетеді. Сонымен алюминий - екідайлы элемент. Осындай қасиеттерге А-топтардың элементтері (Be, Ga, Ge, Sn, Pb, Sb, Bi, Po және т. б. ), көптеген Б-топтардың элементтері (Сr, Mn, Fe, Zn, Сd және т. б. ) ие. Мысалы, мырыштың, екідайлығын мына реакциялар дәлелдейді:
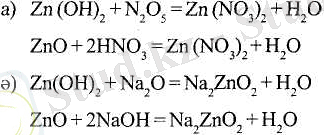
Егер екідайлы элемент өз қосылыстарында бірнеше тотығу дәрежесіне ие болса, онда екідайлы қасиет аралық тотығу дәрежесінде анық байқалады. Мысалы, хромның үш тотығу дәрежесі бар: +ІІ, +ІІІ және +VI. Сr III үшін қышқылдық және негіздік қасиеттер бірдей дәрежеде болса, Сr II үшін негіздік қасиеттер, ал Cr VI үшін қышқылдық қасиеттер басым байқалады:
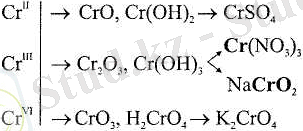
Тотығу дәрежесі +ІІІ болатын элементтің екідайлы гидроксиді көпіпілігінде мета-формада болады, мысалы:
АІО(ОН) - алюминий метагидроксиді,
FеО(ОН) - темір метагидроксиді (темір(Ш) үшін «Fе(ОН) 3 » орто-формасы болмайды) .
Екідайлы гидроксидтер іс жүзінде суда ерімейді, оларды алудың ең ыңғайлы әдісі сулы ерітіндіден аммиак гидраты көмегімен тұнбаға түсіру:
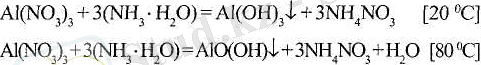
Аммиак гидраты - әлсіз негіз, сілті ерітіндісін (артығымен) пайдаланғанда алюминий гидроксиді тұнбаға түспейді, себебі өзінің екідайлығына байланысты алюминий оңай анионға ауысады:
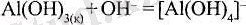
Екідайлы гидроксидтердің су ерітінділерінен тұнбаға түспеу мысалдарын келтірейік:
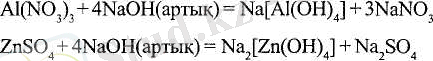
Пайда болған тұздар кешенді (комплексті) деп аталады, себебі олардың құрамына кешенді аниондар кіреді: [А1(ОН) 4 ] - және [Zn(OH) ] 2 -; бұл - тұздардың атаулары:
Na[Al(OH) 4 ] - натрий (III)
Na 2 [Zn(OH) ] - натрий тетрагидроксоцинкаты(II)
А1 2 О 3 және ZnO оксидтерін қатты сілтімен қыздырғанда, алынған тұздарды (жоғарыға көрсетілген) басқаша атайды:
NaAlO 2 -натрий диоксоалюминаты(Ш)
Na 2 ZnО 2 - натрий диоксоцинкаты(ІІ)
Кешенді тұздардың ерітінділерін қышқылдағанда кешендер ыдырайды:
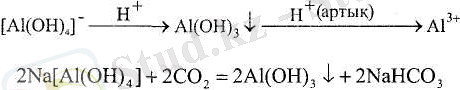
Көптеген екідайлы элементгер үшін гидроксидтердің дәл формулалары белгісіз, себебі су ерітінділерінен гидроксидтердің орнына гидратталған оксидтер тұнбаға түседі, мысалы МnО 2 ∙ nН 2 О, Sb 2 O 5 ∙ nН 2 О.
Екідайлы элементтер бос күйінде әрі типті қышқылдармен, әрі сілтілермен әрекеттеседі:
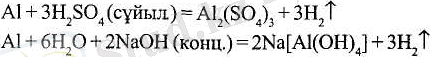
Бинарлы қосылыстар
Екі элементті (негіздік, екідайлы және қышқылдық оксидтерден басқа) және көп элементті (гидроксидтер мен тұздардан басқа) қосылыстардың көбі бинарлы қосылыстарға жатады, мысалы Н 2 О, H 2 S, KBr, N 2 O, NH 3 , CaC 2 , SiH 4 , H 2 O 2 , NH 4 C1, Mg 3 N 2 және т. б.
Бинарлы қосылыстарды қарапайым заттардан синтездейді немесе басқа әдістермен алады:

Кейбір бинарлы қосылыстар сумен оңай гидролизге ұшырайтынын еске түсіре кетейік (§7), бірақ олардың көпшілігі өте орнықты және суда, қышқылдарда, сілтілерде ыдырамайды.
Қос және аралас бинарлы қосылыстар кездеседі, мысалы:
KMgCl 3 - калий-магний хлориді
Рb(С1) F - қорғасын фторид-хлориді
SC1 2 O 2 - күкірт диоксид-дихлориді
(Fе II Fе 2 III ) О 4 - темір(ІІ) -дитемір(III) оксиді
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz