Фазалар ережесі және аралық фазалардың құрылысы мен қасиеттері


ҚАЗАҚСТАН РЕСПУБЛИКАСЫ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
Қ. И. СӘТБАЕВ АТЫНДАҒЫ ҚАЗАҚ ҰЛТТЫҚ ТЕХНИКАЛЫҚ УНИВЕРСИТЕТІ
ЭЛЕКТРОНИКА, МЕХАТРОНИКА ЖӘНЕ РОБОТОТЕХНИКА КАФЕДРАСЫ
РЕФЕРАТ
ТАҚЫРЫБЫ : ФАЗАЛАР ЕРЕЖЕСІ
Орындаған: 050716 мамандығының,
III тобының I курс студенті
Абдульманова Гаухар
Қабылдаған: оқытушы Жумашева Ж. Т
Алматы 2005
Мазмұны
- Кіріспе 3 бет
- Негізгі бөлім: Рефераттың мазмұны4-8 бет
2. 1. Фазалық ауысу 4 бет
2. 2. Аралық фазалар 5 бет
2. 2. 1. Электрондық қосылыстар 5 бет
2. 2. 2. Никель-арсенид типтес фазалар 7 бет
2. 2. 3. Құрылысы β-W ұқсас аралық фазалар8 бет
- Қысқаша қорытындылар9 бет
- Пайдаланған әдебиеттер тізімі9 бет
- Қосымшалар 10 бет
- Глоссарий 11 бет
Кіріспе.
Фазалар ережесі, фазалар заңы - тепе-теңдік күйдегі кез келген жүйе үшінфазалар саны (φ) мен варианттылық санының (v) қосындысы, компоненттер (құраушылар) саны (k) мен сол жүйенің тепе-теңдік күйін анықтайтын параметрлер санының (n) қосындысына тең болатын термодинамикалық қатыс:
φ + v = k + n
Бұл кезде күй параметрлері: температура (T), қысым (P), электр және магнит өрістерінің кернеуліктері т. б. барлық фазада бірдей болуы керек. Егер жүйе күйі тек температура (T) мен қысымның (P) әсерінен ғана өзгеретін болса, онда фазалар ережесі төмендегіше жазылады.
v = k + 2+ φ
Конденсацияланған жүйе үшін (мысалы, металдар қоспасы қысымының шамасы не тұрақты, не өзгеріп ( бірақ ол өзгерістің шамасы өте аз болғандықтан, жүйенің тепе-теғдік күйіне әсер) болмайды) отырады. Мұндай жағдайда фазалар ережесін v = k + 1- φ түрінде жазуға болады; жүйе қысымы айнымалы, ал температурасы тұрақты болған кезде фазалар ережесінің соңғы түрі анықталады. Фазалар ережесін Дж. Гиббс тұжырымдаған (1876) . Бұл ережені 19-ғ-ң соңғы кезі мен 20-ғ-ң бас кезінде голландия ғалымы Я. Вант-Гофф, нидерланды ғалымы Х. Розебом, сондай-ақ совет ғалымы Н. С. Курнаков т. б. өздерінің зерттеу жұмыстарында кеңінен пайдаланды. Фазалар ережесінің гетерогенді (әр текті) жүйелерін зерттеу үшін зор маңызы бар.
Негізгі бөлім
Фазалық ауысу.
Фазалық ауысу, -фазалық түрлену - кең мағынасында заттың сыртқы жағдайлардың өзгеруі кезінде бір фазадан екінші бір фазаға ауысуы; тар мағынасында сыртқы параметрлердің үздіксіз өзгеруі кезінде физ. қасиеттердің секірмелі түрде өзгеруі. Температураның, қысымның не т. б. кез келген физ. шаманың фазалық ауысуы болатын мәні ауысу нүктесі деп аталады. Фазалық ауысудың негізгі заңдылықтары мен классификациясы термодинамкалық теорияда қарастырылады. Заттың термодинамикалық функцияларының өзгеруіне сәйкес фазалық ауысудың 1-ші текті және 2-ші текті фазалық ауысу деп аталатын түрлері болады.
1-ші текті фазалық ауысу кезінде заттың тығыздығы мен термодинамикалық функциялары ауысу нүктесінде секірмелі түрде өзгереді. Мұндай ауысу кезінде фазалық ауысу жылуы деп аталатын жылу бөлінеді. 1-ші текті фазалық ауысуға барлық агрегаттық түрленулер, кристалдық тордың 1 модификациядан 2-ші модификацияға ауысуы т. б. жатады.
2-ші текті фазалық ауысу кезінде заттардың тығыздығы мен термодинамикалық функциялары үздіксіз өзгереді де, ал бұл функцияның физ. параметрлері бойынша алынған туындылары ауысу нүктесінде күрт өзгереді. Мұндай түрлену кезінде жылу бөлінбейді. 2-ші текті фазалық ауысу ферромагнетиктің магнит өрісінсіз парамагнетикке түрленуі, гелийдің асқын аққыштық күйге ауысуы, атомдардың реттеле орналасуы әсерінен кристалл симметриясының өзгеруі т. б. жатады. Барлық 2-ші текті фазалық ауысуды симметрияның өзгеру нүктесі ретінде қарастыруды А. Д. Ландау ұсынған.
Фазалық жылдамдық - гармоникалық толқын фазасының таралу жылдамдығы фазалық жылдамдық толқын жиілігі мен ұзындығы бойынша не дөңгелектік жиілік аралығы өрнектеледі: c=ƒλ=ω'k. . Фазалық жылдамдық ұғымын өзінің формасын өзгертпей таралатын гармоникалық толқындарға пайдалануға болады. Бұл шарт тек сызықты ортада ғана орындалады. Дисперсиясы жоқ толық өзінің формасын өзгертпей, фазалық жылдамдыққа жуық жылдамдықпен таралады. Ал дисперсиясы бар гармоникалық емес толқындар өзінің формасын өзгертеді. Сондықтан мұндай толқындар үшін фазалық жылдамдық ұғымын пайдалануға болмайды. Мұндай жағдайда топтық жылдамдық және толқын фронтының жылдамдығы деген ұғымдар пайдаланылады. Берілген жиіліктнгі фазалық жылдамдықты интерференцияның тәжірибелердің көмегімен табуға ьолады.
Аралық фазалар
Аралық фазаларда атомаралық хим. байланыс қатты ерітінділерге қарағанда әлде қайда күшті. Олардың атомдық құрылысы мен қасиеттері таза компоненттердікіне ұқсамайды. Хим. құрамдары кең концентрациялық аралықтар өзгергенімен, олар шекаралық қатты ерітінділерге де ұқсамайды.
Аралық фазалардың ғылыми классификациясы осы уақытқа дейін жасалып болған жоқ. Қазіргі кезде, көп компонентті системаларды еске алмағанның өзінде, екі компонентті қорытпалардың өзінде өте көп фазалар табылып отыр. Оларда классификациялаудың негізгі жолдарының бірі - атомаралық байланыс күштерінің түріне қарай: металдық, иондықжәне коваленттік аралық фазарға бөлу. Жалпы аралық фазалардың құрылысында қатты ерітінділердің құрылысын анықтайтын шарттардың көмегімен - атомдардың диаметрлерінің қатынасымен, компоненттердің валенттілігімен және олардың Менделеев кестесіндегі орналасуымен түсіндіруге болады.
Төменде аралық фазалардың тек бірнеше түрлері ғана қарастырылады.
Электрондық қосылыстар
Электрондық қосылыстар - атомдық диаметрлері бір-біріне жақын екі металл арасындағы фазалар. Екі компоненттің бірі - бір валентті немесе өтпелі, ал екіншісі - валенттілігі 2-ден 5-ке дейін болатын қарапайым металл. Өтпелі металдардың валенттілігі әр түрлі жағдайда 0-ден 2-ге дейін болады деп есептеледі. Юм-Розеридің зерттеулері көрсеткендей, бұл фазаларда барлық валенттік электрондардың жалпы атомдар санына қатынасы тұрақты болады. Егер e/n қатынасы бірдей болса, онда әр түрлі фазалардың кристалдық торлары ұқсас болады. Мысалы, хим. құрамы шамамен
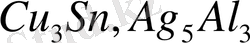 және
және
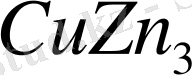 сияқты стехометриялық формулаларға сай келетін фазалардың кристалдық торлары бірдей - гексагональді болып келеді. Көрсетілген фазаларда компоненттердің атомдық концентрациялары әр рүрлі болса да, e/n қатынасы бірдей болатынын
1-кестеден
көруге болады.
сияқты стехометриялық формулаларға сай келетін фазалардың кристалдық торлары бірдей - гексагональді болып келеді. Көрсетілген фазаларда компоненттердің атомдық концентрациялары әр рүрлі болса да, e/n қатынасы бірдей болатынын
1-кестеден
көруге болады.
Электрондық концентрацияның көп системаларда қайталанатын ең жоғарғы, мүмкін болатын үш мәні белгілі: 3/2, 21/13 және 7/4.
e/n =3/2 болса, үш түрлі кристалдың торы бар - көлемдік центрленген куб, элементар ұясында 20 атомы бар β-Mn торындай күрделі куб және атомдары тығыз орналасқан гексагональдық торы бар β-фаза пайда болады.
e/n =21/12 болса, элементар ұясында 52 атомы бар, α-Mn торына ұқсас кристалдық торы бар γ фаза пайда болады. e/n=7/4 болса, тығыз гексагональді торы бар ε-фаза пайда болады. 2-кестеде кейбір электрондық қосылыстардың классификациясы келтерілген. Кестедегі теориялық формулаларда жоғары валентті екінші компоненттің ең үлкен конценрациясы алынған.
Cu-Zn, Cu-Al, Cu-Sn системаларының фазалық күй диаграммаларында β¸ γ және ε фазалық аймақтары бірінен кейін бірі орналасады. Cu-Al және Cu-Sn системаларында β-фаза эвтектоидтық өзгеріске ұшырайды.
Электрондық концентрациялар (3/2, 21/13, 7/4 ) ең жоғарғы мүмкін болатын шамалар болғандықтан, екінші компоненттің концентрациясы белгілі бір шектен асқанда системаның, еркін энергиясының өсуіне байланысты келесі фаза пайда болуы керек. Фазалық диаграммада мұндай қорытпа - көршілес екі фазалық аймақта болуы керек. Бірақ белгілі фазалық күй диаграммаларында бір фазалы аймақ 2-кестеде көрсетілген фазалардың стехиометриялық құрамының екі жағында да созылып жатады. Электрондық қосылыстардың пайда болуын да - электрондық концентрациядан басқа, компонент атомдарының диаметрлері де үлкен рөл атқарады. Компоненттердің атомдық диаметрлерінің айырмасы артқан сайын, фазалық күй диаграмасындағы электрондық қосылыстардың бір фазалық гомогендік аймағы тарыла түседі.
Көлемдік центрленген куб торы бар β-фазалар мен γ-фазалардың көпшілігі реттелген қатты ерітінділерге жатады. Олар реттелген құрылысын кейде балқу температурасына дейін сақтайды. β-Mnторындай немесе гексагональді торы бар β-фаза және ε-фаза жатады.
Көлемдік центрленген, құрамында өтпелі металдар бар кейбір β-фазалардың (NiAl, CoAl т. б. ) балқу температуралары өте жоғары болады. Балқу температураларына дейін құрылысының реттелуін сақтайды. Олардың пайда болу энегиясы үлкен. Фазалық диаграммаларда бұл фазаларға сәйкес ликвидус-солидус сызықтарының максимумдері анық көрінеді. Олардың тұрақты химиялық қосылыстардан айырмасы - концентрациялық ось бойында алатын аймағы кең.
NiAl, CoAl сияқты фазаларда алюминийдің концентрациясы 50%-тен асқанда ақаулы кристалдық тор пайда болады; реттелген кристалдық тордың төменгі валентті компоненттің атомдары ( Ni немесе Co) орналасатын түйіндері бос қалады. NiAl және CoAl фазаларында Ni мен Co валенттілігі 0-ге тең деп алынады. Сондықтан алюминийдің концентрациясы 50% болғанда e/n=3/2 теңдігі орындалады. Бірақ бөлме температурасында NiAl β-фазасындағы алюминийдің концентрациясы 55 %-ке дейін жетеді. Оның кристалдық ьорында бос түйіндер болғандықтан, тығыздығы азаяды. Бір сөзбен айтқанда, әрбір көлемге келетін элементар тордың саны көбейеді. Мұндай торы бар β-фазаның тепе-теңдік күйі. С. Т. Конобельский көрсеткендей, әрбір атомға келетін электрондардың санымен емес, бір элементар ұяға келетін электрондардың санымен шектеледі. Сондықтан “алу” торы бар β-фазалар үшін де, алюминийдің концентрациясы өскенде валенттік электрондар санының өсуіне қарамай, элементар тордың саны
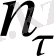 өсетіндіктен e/
өсетіндіктен e/
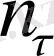 =3/2 қатынасы орындалады.
=3/2 қатынасы орындалады.
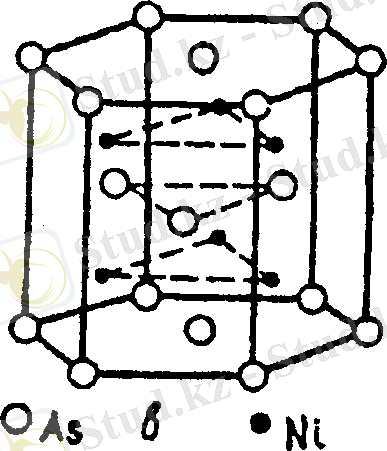
Никель-арсениф типтес фазалар
Никель-арсенид типтес фазалар, мысалы: алтын сияқты бір валентті (4-6-ға дейін) қарапайым металдармен немесе металоидтармен байланысқа тусуі нәтижесінде пайда болады. Никель-арсенид фазаларының химиялық құрамы стехиометрифлық АВ сай келеді. Олар балқу температурасына дейін тұрақты бодады немесе перитектикалық реакция нәтижесінде балқиды.
Никель-арсенид типтес фазалардың атомдық-кристалдық құрылысы аралық NiAs фазасының құрылысына ұқсас. 3-суретте NiAs фазасының кристалдық торы көрсетілген. Мұнда әр компоненттің концентрациясы 50-%ке тең және кристалдық тор гексагональдық системаға жатады. Металоидтың немесе қарапайым металл атомдары тығыз гексагональді тор құрайды. Ондағы бір элементар торға келетін атомдар саны 2х1/2+12*1/6+3=6 тең. Бір валентті немесе өтпелі маталл атомдары осы тордағы октаэдриялық ққуыстарға рорналасады. Олардың да бір элементар торға келетін саны 6-ға тең. Никель-арсенид типтес фазалардың, мысалы ретінде FeSe, NiTe, FeSn, CoSb, PdSb, NiSe, CrTe т. с. с. химиялық қосылыстарды келтіруге болады. Бұл фазалар металдың және коваленттік байланысы бар фазалардың арасындағы аралық фазаларға жатады. Олардың арасында металдың өткізгіштігі жоғары фазалар мен жартылай өткізгіштер де кездеседі.
Құрылысы β-W ұқсас аралық фазалар
Құрылысы β-W ұқсас аралық фазалардың химиялық құрамы
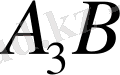 формуласына сәйкес келеді. Олар IV-VI топтардың өтпелі элементтері мен (А компоненттері) VIII топтың өтпелі элементтерінің немесе Ga, Si, Ge, Sn, As, Au, Cu (Вкомпоненттері) арасында пайда болады. Вкомпоненттерінің атомдары көлемдік центрленген кубтық тор құрады. Әрбір В атомы 12 А атомымен қоршалады.
формуласына сәйкес келеді. Олар IV-VI топтардың өтпелі элементтері мен (А компоненттері) VIII топтың өтпелі элементтерінің немесе Ga, Si, Ge, Sn, As, Au, Cu (Вкомпоненттері) арасында пайда болады. Вкомпоненттерінің атомдары көлемдік центрленген кубтық тор құрады. Әрбір В атомы 12 А атомымен қоршалады.
β-W ұқсас фазалар құрылысы реттелген . Олардың едәуір жоғары температураларға дейін сақталатын (22°K дейін) аса жоғары өткізгіштер болып табылады.
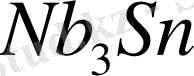 -дан тартылған сымнан (критикалық t 18°K) өте үлкен магнит өрістерін алу үшін (
-дан тартылған сымнан (критикалық t 18°K) өте үлкен магнит өрістерін алу үшін (
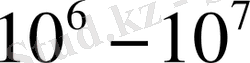 а/м дейін) аса жоғары өткізгіш соленоид жасайды.
а/м дейін) аса жоғары өткізгіш соленоид жасайды.
Кейде бір бинарлық системада компоненттер стехиометриялық құрамы әр түрлі химиялық қосылыстар құрады, мысалы:
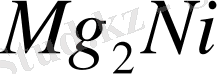 және
және
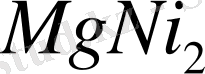 ,
,
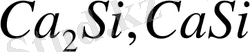 және
және
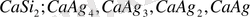 және
және
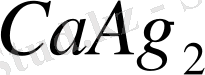 , т. с. с. көп жағдайда аралық фазалар ретінде тек химиялық құрамы тұрақты қосылыстар құрылса, онда металл-компоненттер бір-бірінде өте аз ериді немесе ерімейді.
, т. с. с. көп жағдайда аралық фазалар ретінде тек химиялық құрамы тұрақты қосылыстар құрылса, онда металл-компоненттер бір-бірінде өте аз ериді немесе ерімейді.
Өте көп химиялық құрамы тұрақты аралық фазалар жоғарыда аталған түрлерге жатпайды. Қазіргі кезде оларды топтап, жіктеу мүмкін емес.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz