Химиялық реакциядағы заттардың және энергияның өзгерісі: тотықтыру-тотықсыздандыру және иондық реакциялардың мәні мен шарттары


Тақырыбы: Химиялық реакциядағы энергия заттардың өзгерісі
Жоспар
Біз химиялық реакцияға қатысты көптеген білімдерді үйрендік, айталық химиялық реакцияның мәні - реакцияға қатысқан заттар молекуласындағы көне химиялық байланыстың үзілуі мен реакцияда түзетілген заттардағы жаңа химиялық байланыстың қалыптасуы, осы барыста, атомдар қайтадан бірігеді, заттарда өзгеріс болумен қатар энергия өзгерісі де туады. Ғылыми тәжірибелер мен адамзаттың тұрмыстық тәжірибелері бізге химиялық реакциядағы заттардың өзгерісі мен энергия өзгерісі тығыз байланыста болатындығын ұғындырады. Химиялық реакциядағы заттардың өзгерісі мен энергия өзгерісін зерттеу көлемі маңызға ие болып, адамзатты түрліше қасиеттегі өнімдермен қамдаумен бірге, аса мол энергия мен қамдап, адамзаттың тұрмысын жақсартып, адамзат қоғамын алға ілгерілетеді.
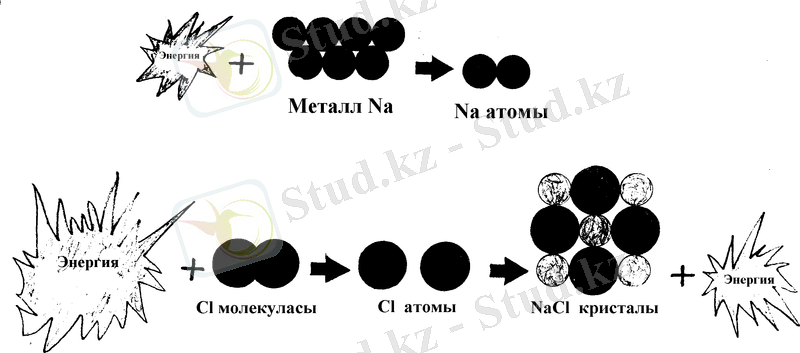
1. Маңызды тотықтырғыштар мен тотықсыздандырғыштар
Тотығу - тотықсыздану реакциясының теңдеуінде стрелка арқылы реакцияның алды-артындағы ұқсас бір түрлі элемент атомның электронның ауысу жағдайын көрсетуге болады. Мысалы:
Электрон Fe -ден CuSO 4 тағы Cu ++ ионына ауысады, Fe тотықсыздандырғыш, CuSO 4 тотықтырғыш.
Тотықтырғыш дегеніміз реакцияда электрон қосып алатын (немесе электрон жұбы өзіне қарай ауытқитын) заттарды, атап айтқанда, реакциядан кейін құрамындағы элементтілігі кемитін заттарды көрсетеді. Тотықтырғыштар - тотықтырғыштың қасиетке ие болып, реакцияда өзі тотықсызданады, одан түзілген зат тотықсыздану өнімі болады.
Тотықсыздандырғыш дегеніміз реакцияда электроннан айырылатын (немесе электрон жұбы өзінен алыстайтын) заттарды, атап айтқанда, реакциядан кейін құрамындағы элементтің валенттілігі артатын заттарды көрсетеді. Тотықсыздандырғыштар - тотықсыздандырғыштың қасиетке ие болып, реакцияда өзі тотығады, одан түзілген зат тотығу өнімі болады.
Тотықтырғыш пен тотықсыздандырғыш қасиеттері қарама-қарсы заттар, олар реакцияға қатынасқан зат ретінде тотығу-тотықсыздану реакциясына ортақ қатынасады, реакцияда электрон тотықсыздандырғыштан тотықтырғышқа ауысады, яғни, тотықсыздандырғыш электронмен қамдаушы, тотықтырғыш электронды қабылдаушы болады.
[ 1 - 3 сурет]
заттардың реакцияда тотықтырғыш әлде тотықсыздандырғыш болуын, негізінен элементтердің валенттілігі белгілейді, жалпылай айтқанда, элемент ең жоғарғы валентті күйде тұрғанда, оның атомы тек электрон қосып алады, сондықтан осы элемент тотықтырғыш қана болады. Мысалы: S +6 , элемент ең төмен валентті күйде тұрғанда, оның атомы тек электроннан айырылады, сондықтан осы элемент тотықсыздандырғыш қана болады. Мысалы: S -2 , элемент аралық валентті күйде тұрғанда, оның атомы реакция шарт - жағдайының ұқсамастығына қарай, электрон қосып алуы да, электроннан айырылуда мүмкін, сондықтан осы элемент тотықтырғыш та тотықсыздандырғышта болады. мысалы: S 0 , және S +4 .
1. Маңызды тотықтырғыштар.
Орта мектеп химиясында маңызды тотықтырғыштар, жалпы алғанда, төмендегідей бірнеше түрлі болады:
(1) актив бейметалл жай заттары, мысалы,
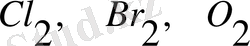 сияқты.
сияқты.
(2) элемент (мысалы, Mn сияқты) жоғары валент күйінде тұрғандағы тотықтары, мысалы, MnО 2 т. б.
(3) элемент (мысалы, S, N сияқты) жоғары валент күйінде тұрғандағы оттекті қышқылдары, мысалы: қою күкірт қышқылы, НNО 3 т. б.
(4) элемент (Mn, Cl, Fe сияқты) жоғары валент күйінде тұрғандағы тұздары мысалы: КMnО 4 , КClО 3 , FeCl 3 т. б.
(5) асқын тотықтар, мысалы:
Na 2 O 2 , H 2 О 2 т. б.
ә) маңызды тотықсыздандырғыштар.
Орта мектеп химиясындағы маңызды тотықсыздандырғыштар, жалпы алғанда, төмендегідей бірнеше түрлі болады:
(1) Актив металл жәй заттар, мысалы:
Na, Al, Zn, Fe т. б.
- кейбір бейметалл жәй заттары, мысалы:
H 2 , C, Si т. б.
- Элемент (мысалы С, S сияқты) төмен валентті күйде тұрғандағы тотықтары, мысалы:
СО, SО 2 , т. б.
- Элемент (мысалы Cl, S сияқты) төмен валентті күйде тұрғандағы қышқылдар, мысалы:
НCl, Н 2 S т. б.
- Элемент (мысалы S, Fe сияқты) төмен валентті күйде тұрғандағы тұздары, мысалы:
Na 2 SО 3 , FeSО 4 т. б.
ІІ. Маңызды тотықтырғыштар мен үнемі кездесетін реакциялары. [1-3 тәжірибе] «сүзгі қағаздан үшеу алып, оның біреуінің ортасына қаныққан NaBr ерітіндісін, басқа екеуінің ортасына қаныққан Kz ерітіндісін тамызайық». NaBr ерітіндісі тамызылған сүзгі қағаз бен KI ерітіндісі тамызылған сүзгі қағаздың біреуін реті бойынша, жаңа дайындалған қаныққан хлор суы құйылған құмыраның ауызының үстіне ұстап, сүзгі қағаздың ортасында қандай өзгеріс болатындығын бақылайық. Қаныққан КІ ерітіндісі тамызылған енді бір сүзгі қағазды қызыл күрең түсті бром орын алмастырып шыққан қағаздың үстіне тигізе қабаттап қойып, сүзгі қағаздың ортасында қандай өзгеріс болатындығын бақылайық.
Жоғарыдағы тәжірибе құбылыстарына талдау жасаңдар, әрі себебін түсіндіріңдер.
[2-3 тәжірибе] пробирнаға азырақ темір үгіндісін салып, оның үстіне 2ml дей қою күкірт қышқылын құйып, пайда болған құбылысты бақылайық. Енді бір приборкаға лайықты мөлшерде темір ұнтағын салып, үстіне 5ml дей сұйық күкірт қышқылын құйып, пайда болған құбылысты бақылайық, әрі түзілген газдың Н 2 екендігін дәлелдейік. Реакция аяқтағаннан кейін (темір ұнтағы сәл артық мөлшерде), үстіңгі қабатындағы тұнық ерітіндіні екі приборкаға бөліп құяық (3-4 сурет) .
Осы приборканың біреуіне бром суын құйып шайқап, қандай құбылыс пайда болатындығын бақылайық, енді біреуіне ә тамшы KSCN ерітіндісін тамызып, құбылысты бақылайық, онан кейін тағы бірнеше тамшы қою азот қышқылын тамызайық, ерітінді түсінуде қандай өзгеріс туылады? Жоғарыдағы тәжірибеде құбылыстарына талдау жасаңдар әрі себебін түсіндіріңдер.
[3-1 тәжірибеде] бастысы төмендегі реакциялар пайда болады:
[3-2 тәжірибеде] бастысы төмендегі реакциялар пайда болады:
Жоғарыдағы реакцияларға талдау жасау әрі оны үйренген тотығу-тотықсыздану реакцияларына қатысты білімдерге бірлестіру арқылы, орта мектеп сатысындағы маңызды тотықтырғыштар мен үнемі кездесетін реакцияларын төмендегі бірнеше тү йінге жинақтауға болады:
1. Тотықтырғышқа қарата айтқанда, ұқсас негізгі группадағы бейметалл атомдарының ең сыртқы электрондық қабатындағы электрон саны ұқсас, бірақ электрондық қабат саны ұқсамайды. Электрондық қабат саны артқан сайын, атом радиюся соғұрлым үлкейеді де, электронды соолғұрлым оңай қосып ала алмайды. Сондықтан жәй заттардың тотықтырғыштық қаисеті солғұрлым әлсіз болады. Мысалы:
F 2 , Cl 2 , Br 2 , I 2
Тотықтырғыштық қасиеті біртіндеп әлсірейді
2. қарата айтқанда, металл жай заттарының тотықсыздандырғыштық қасиеттерінің күшті - әлсіздігі металлдардың активтік қатарымен бірдей болады, яғни металдар артына орналасқан сайын, электроннан оңай айырылмайды, олардың тотықсыздандырғыштық қасиеті де әлсірей отырады. Мысалы:
K, Ca, Na, Mg, Al, Zn, Fl, Sn, (H) . Cu, Hg, Ag, Pt, Au
Тотықсыздандырғыштық қасиеті біртіндеп әлсірейді
3. Элемент жоғары валентті күйде тұрғандағы зат тотықтырғыштық қасиетке ие болады, ол белгілі шарт - жағдайда реакцияласады да, түзілген жаңа заттағы сол элементтің валенттілігі кемиді. Мысалы:
4. Элемент төмен валентті күйде тұрғандағы зат тотықсыздандырғыштық қасиетке ие болады, ол белгілі шарт - жағдайда тотықтырғыштармен реакцияласады да, түзілген жаңа заттағы смол элементтің валенттігі артады. Мысалы:
5. Сұйық күкірт қышқылы актив металл жай заттармен реакцияласқанда тотықтырғыш болады, мұнда
 тотықтырғыштың роль атқарады да, реакциядан кейін Н
2
түзіледі. Мысалы:
тотықтырғыштың роль атқарады да, реакциядан кейін Н
2
түзіледі. Мысалы:
Қою күкірт қышқылы күшті тотықтырғыш реакцияласқанда, тотықтырғыштың роль атқарады, әдетте реакциядан кейін SO 2 түзіледі. Мысалы:
6. Мейлі сұйық азот қышқылы болсын, әлде қою азот қышқылы болсын түгелдей күшті тотықтырғыш саналады, барлық металдар мен немесе бейметалдармен дерлік тотығу-тотықсыздану реакциясына кіріседі. Реакцияласқанда бастысы
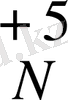 электрон қосып алып, тотықсызданып NO
2
, NO сияқтыларға айналады. Мысалы:
электрон қосып алып, тотықсызданып NO
2
, NO сияқтыларға айналады. Мысалы:
7. Көп түрлі айнымалы валентті металл элементтер әдетте, ең жоғары валентті күйде тұрғанда тотықтырғыштық қасиеті біршама күшті болады, валенттілігінің төмендеуіне ілесіп, олардың тотықтырғыштық қасиеті әлсіреп, тотықсыздандырғыштық қасиеті күшейеді.
Қорытып айтқанда, тотықтырғыш пен тотықсыздандырғыш белгілі шарт - жағдайда реакцияласқанда әдетте салыстырмалы әлсіз тотықсыздандырғыш және салыстырмалы әлсіз тотықтырғыш түзіледі. Яғни, лайықты шарт жағдайда, тотықтырғыштың қасиеті күшті заттардан, тотықтырғыштың қасиеті әлсіз заттарды алуға, тотықсыздандырғыштың қасиеті күшті заттардан, тотықсыздандырғыштық қасиеті әлсіз заттарды алуға болады. Мысалы:
Қалыпты температурада төмендегі реакциялар жүреді деп
берілген:
Fe 3+ , Fl 2+ , Cu 2+ , Br 2 тотықтырғыш өткенде, олардың тотықтырғыштық қабілеттерінің күшті-әлсіздік ретіне талдау жасаңдар.
Түсі өзгергіш ерітінді
4g глюкоза мен 4g NaOH -ын тығыны бар мөлдір сулану құмыраға салып, онан соң үстіне 150 ml су және 2~3 тамшы метиллен көгі сынағыш ерітіндісін қосып, тығынын тығындап, шайқасаңдар (3-5 сурет) ерітінді көк түске енеді, тыныш қойсаңдар ерітінді түссізденеді. Ерітіндіні қайта шайқасаңдар тағы көк түске енеді, тыныш қойсаңдар тағы түссізденеді, көп рет қайталауларыңа болады. Бір глюкозаның тотықсыздандырғыштық қасиетке ие болғандықтан, оны тотықсыздандырғыш етуге болады, ауадағы О 2 тотықтырғыштық қасиетке ие. Оны тотықтырғыш етуге болады. олар негіздік ерітіндіде тотығу-тотықсыздану реакциясына кіріседі. Ерітіндіні шайқағанда, құмырадағы ерітіндімен ауаның жанасу беті үлкейіп, түссіз группаны О 2 тотықтырып көп түсті группаны түзетін бағытқа қарай жүргізіледі, сондықтан ерітінді көк түске енеді. Ерітіндіні тыныш қойғаннан кейін ерітіндідегі О 2 азайып, реакция көк түсті группаны глюкоза тотықсыздандырып, түссіз группаға айналдыратын бағытқа қарай жүреді, сондықтан, ерітінді түссізденеді. Ерітіндідегі глюкоза жұмсалып болғанша, осылай қайталана береді.
Жаттығу
1. Бос орындарын толтырыңдар.
Cl 2 , H 2 , Al, CO, HCl, FeSO 4 , FeCl, KMnO 4 , HNO 3 және күкріт қышқылы аяқтылардың ішіндегі үнемі тотықтырғыш етілетіндері , үнемі тотықсыздырғыш етілетіндері №
2. Тәжірибеханада үнемі төмендегі реакциядан пайдаланып N 2 алынады:
осы реакциядағы электронның ауысу жағдайын көрсетіңдер ондағы тотықтырғыш тотықсыздандырғыш .
3. Қалыпты температурада төмендегі реакциялар жүргізіледі деп берілген:
жоғарыдағы тәжірибе фактілері Fe 2+ , Br - , І - сияқты қасиеттерінің күштісінен әлсізіне қарайғы рет тәртібі болатындығын түсіндіреді.
ІІ Таңдаңдар
1. Химиялық реакцияда, егер мәлім элемент қосылыс күйінен бос күйге өзгерсе, онда, осы элемент ( )
А. Тотығады.
В. Тотықсызданады.
С. Тотығу да тотықсыздану да мүмкін.
Д. Тотықтырғыш та, тотықсыздандырғышта емес.
2. реакциясында
А. Тотықтырғыш
В. Тотықсыздандырғыш
С. Әрі тотықтырғыш әрі тотықсыздандырғыш
Д. Тотықтырғыш та, тотықсыздандырғышта емес.
3. реакциясында егер 4 Mol Zn толық реакцияласқан болса, тотықсызданған HNO3-ның зат мөлшері ( )
А. 1 Mol
В. 2 Mol
С. 4 Mol
Д. 10 Mol
4. Төмендегі әр группадағы заттар үйлесімді шарт - жағдайда реакцияға кіреді. Осының ішіндегі тотықтырғыш пен тотықсыздандырғыштың зат мөлшерінің қатынасы 2:1 болатыны ( )
А.
В.
С.
Д.
ІІІ төмендегі тотығу-тотықсыздану реакцияларына түгел су қатынасады, электронның ауысу жағдайын көрсетіп судың тотықтырғыш әлде тотықсыздандырғыш екендігін көрсетіңіз.
1.
2.
3.
4.
ІV төмендегі заттар берілген: Fe, Cl 2 , Н Cl Ерітіндісі, Fe Cl 2 ерітіндісі, Fe Cl 3 ерітіндісі, Н 2 О, төмендегі талаптар бойынша олардан лайықты заттарды таңдап алып, реаксияластарып, реакцияның химиялық теңдеуін және иондық теңдеуін жазыңдар.
- Жай зат тотықсыздандырғыш болсын
- Жай зат тотықтырғыш болсын
- Ұқсас бір түрлі зат әрі тотықтырғыш әрі тотықсыздандырғыш болсын (иондық теңдеуін жазу талап етілмейді)
- Тотығу өнімі мен тотықсыздану өнімі ұқсас бір түрлі зат болсын
І иондық реакцияның мәні
CuSO 4 Ерітіндісі мен BaCl 2 ерітіндісін араластырған кезде, CuSO 4 тан ионданып шыққан Cu 2+ мен BaCl 2 дан ионданып шыққан реакцияластан, BaCl 2 дан ионданып шыққан Bа 2+ мен CuSO 4 тан ионданып шыққан SO 4 2- реакцияласатындығын, Bа 2+ мен SO 4 2- бірігіп ақ түсті ВаSO 4 тұнбасын түзетіндігін білеміз:
ВаSO 4 тұнбасы түзілетіндіктен, ерітіндідегі Ва 2+ мен SO 4 2- -ның қоюлықтары дереу кеңейеді, міне бұл СuSO 4 ерітіндісі мен BaCl 2 Ерітіндісінің реакцияға кірісуінің себебі:
Na 2 CO 3 Ерітіндісімен тұз қышқылын араластырғанда Na 2 CO 3 дан ионданып шыққан CO 3 2- мен тұз қышқылынан ионданып шыққан Н + реакцияласып, нашар ионданатын Н 2 СО 3 түзеді, Н 2 СО 3 тұрақсыз болғандықтан, тағы ыдырап СО 2 түзеді:
СО 2 мен Н 2 О түзілгендіктен ерітіндідегі СО 5 2- мен Н + ның қоюлығы тез төмендейді, міне бұл Na 2 CO 3 мен тұз қышқылының реакцияға кірісуінің себебі. Осындай мысалдардан тағы да көбін келтіруге болады. Адамдар көптеген, иондық реакциялардың зерттеу жүргізгеннен кейін, егер реакцияласқан заттардағы кейбір иондар бірігіп жаңа зат түзе алатын болса, онда, ерітіндідегі осы иондардың қоюлығы кемейіп иондық реаксия пайда болатындығын танып жеткен, міне бұл, иондық реакциясының мәні реакцияласқан заттардағы кейбір иондар қоюлығының кемеюі дегендік.
ІІ иондық реакциясының пайда болу шарттары
Иондық реакцияның мәні реакцияласқан заттардағы кейбір иондар қоюлығының кемеюі екен, ендеше, иондық реакциясының пайда болу шарттарын зерттеу, мәні жағынан алғанда, қандай шарт жағдайда реакцияласқан заттардағы кейбір иондардың қоюлығын кемейтуге болады дегенді зерттеу болып табылады. Қортып айтқанда, төмендегі шарттардың бірі әзірленсе, реакцияласқан заттардағы кейбір иондардың қоюлығы кеңейеді.
- нашар еритін зат түзілу
Мысалы, NaОН ерітіндісі мен CuSO 4 ерітіндісін араластырғанда СU 2+ мен ОН бірігіп нашар еритін Cu(OH) 2 тұнбасы түзілетіндіктен, ертіндідегі Cu 2+ мен ОН қоюлығы тез кеңейеді. Сондықтан осы иондық реакция пайда болады.
Орта мектеп химиясында үнемі кездесетін нашар еритін заттардың кейбір металдар, бейметалдар (мысалы Fe, S, Si) және тотықтардан (Al 2 O 3 , SiO 2 ), басқа тағы басты екі түрі бар: бір түрі, негіздер, мысалы, Mg(OH) 2 , Al(OH) 3 , Cu(OH) 2 , Fe(OH) 3 сияқтылар: енді бір түрі, тұздар, мысалы, Aga, AgBg, AgI, CaCO 3 , BaCO 3 , BaCO 4 т. б. қатысты иондардың қоюлығы жетерлік жоғары болғанда, болымсыз еритін зат түзілетін иондық реакциялар да пайда болады. Мысалы AgNO 3 Na 2 SO 4 Ерітіндісін араластырғанда, егер Ag + , SO 4 2- иондарының қоюлығы жетерлік жоғары болса да, Ag 2 SO 4 тұнбасы түзіледі. түзілетіндіктен, бұл реакция да пайда болады:
тұнба түзетін реакциялар өте тез жүрлетіндіктен әрі құбылысы анық болатындықтан, бұл реакциялар үнемі иондарды анықтайтын ерекше реакциялар етіледі. Мысалы, сұйық Азот қышқылында ерімейтін AgСl ақ түсті тұнбасының түзілуінен пайдаланып, СГ ионын анықтайды.
2. Нашар ионданатын зат түзілу. Мысалы, NaOH Ерітіндісі мен тұз қышқылын араластырғанда, Н + мен ОН қосылып нашар ионданатын Н 2 О түзілетіндіктен, Ерітіндідегі Н + мен ОН-ның қоюлығы дереу кемейеді, сондықтан, осы йондық реакция пайда болады:
Қышқыл мен негіз реакцияласқанда, түгел Н 2 О түзіледі, сондықтан, қышқылмен негіздің бейтараптану реакциялары түгелдей пайда болады.
Орта мектеп химиясында үнемі кездесетін нашар ионданатын заттар онша көп емес, Н 2 О дан басқа тағы СН 3 СООН, Н 2 СО 3 , NH 3 . H 2 O және C 6 H 5 OH сияқтылар бар. Мысалы, тұз қышқылы мен NaOH ерітіндісі реакцияласқан, NH 3 . H 2 O түзіледі.
NH 4 Сl ерітіндісі мен NаОН ерітіндісі реакцияласқанда NH 3 . H 2 O түзіледі.
Міне бұл, әдетте айтылатын күшті қышқылдан пайдаланып, әлсіз қышқылды алуға, сондай-ақ күшті негізден пайдаланып әлсіз негізден түзілген тұздарда гидролиздену реакциясы пайда болуының себебін де түсіндіріп бере алады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz